摘要:
目的:分析原发性胃恶性淋巴瘤(PGL)的临床特征、治疗方法的选择及影响预后的因素。方法:回顾性分析徐州市中心医院2012年11月至2020年11月收治的72例PGIL患者的临床资料,并探讨患者初诊时临床特征及其与预后之间的关系。结果:72例PGL患者中男36例,女36例,男女比例为1:1。发病中位年龄60 (30~78)岁。发病部位以胃窦30.5% (22例)最常见。病理类型以B细胞淋巴瘤为主,占86.1%。随访时间3~110个月不等,中位随访56个月。PGL患者1年、3年预期生存率分别为98.3%、81.6%,单因素分析显示,年龄 > 60岁(p = 0.028)、临床分期为III/IV期 (p = 0.001)、B症状(p < 0.001)、国际预后指数(IPI)评分3~5分(p = 0.028)、ALB < 35 g/l (p = 0.003)、高水平LDH (p = 0.003)、病理分型为T细胞淋巴瘤(p = 0.006)为影响总生存期的预后危险因素,差异具有显著性(p < 0.05)。COX回归模型多因素分析显示,国际预后指数(IPI)评分3~5分(p = 0.022)为预后不良的独立危险因素。结论:PGL在中老年男性更常见,以DLBCL最常见的病理类型。年龄 > 60岁、临床分期处于III/IV期、IPI指数 ≥ 3、LDH表达高水平、ALB降低、B症状、T细胞源性的预后较差。IPI评分3~5分为预后不良的独立危险因素。
Abstract:
Objective: To analyze the clinical characteristics, treatment choice and prognostic factors of primary gastric malignant lymphoma (PGL). Methods: The clinical data of 72 patients with PGL admitted to Xuzhou Central Hospital from November 2012 to November 2020 were retrospectively analyzed, and the clinical characteristics of the patients at their initial diagnosis and their relationship with prognosis were discussed. Results: Among the 72 PGL patients, 36 were male and 36 were female, the ratio of male to female was 1:1. The median age of onset was 60 (30~78) years. The most common site was antrum 30.5% (22 cases). The pathological type was B-cell lymphoma, accounting for 86.1%. The 1-year and 3-year expected survival rates of PGIL patients were 98.3%, 81.6%, respectively, according to univariate analysis. Age > 60 years old (p = 0.028), the clinical stage for III/IV symptoms (p = 0.001), B Symptoms (p < 0.001), the international prognostic index (IPI) score 3 to 5 points (p = 0.028), ALB < 35 g/l (p = 0.003), high levels of LDH (p = 0.003), pathological classification for T cell lymphoma (p = 0.006) risk factors to influence the outcome of overall survival, with significant difference (p < 0.05). Multivariate analysis of COX regression model showed that the international prognostic index (IPI) score 3 to 5 points (p = 0.028) was an independent risk factor for poor prognosis. Conclusion: PGIL is more common in middle-aged and elderly men, especially in stomach, among which DLBCL is the most common pathological type. Age > 60 years of age, clinical stage III/IV stage, IPI index ≥ 3, LDH expression or high levels, B Symptoms, B and T cell source and ALB < 35 g/l. IPI index ≥ 3 is an independent risk factor for poor prognosis.
1. 引言
原发性胃淋巴瘤(primary gastric lymphoma, PGL)是指起源于胃黏膜下淋巴组织的恶性肿瘤,总发病率为30%~40% [1],是最常见的结外淋巴瘤 [2]。PGL患者通常缺乏特异性的临床特征,早期常无任何症状,难以发现,而晚期部分患者可以表现为上腹痛、呕血、反酸呕吐等消化道症状,有时以急腹症为首发表现,因此PGL在实际临床工作中常被漏诊。为了提高对胃恶性淋巴瘤的诊治,我们回顾性分析了72例PGL患者的临床资料,探讨原发性胃肠淋巴瘤的临床特点、治疗方式的选择及影响预后的因素。
2. 资料与方法
2.1. 研究对象
收集2012年11月至2020年11月于徐州市中心医院就诊的胃淋巴瘤72例。所有PGIL患者均经内镜、超声或CT穿刺或术中取得标本并经病理确诊。收集统计PGL患者的各项临床资料,包括:性别、年龄、实验室资料、发病部位、病理分型、治疗方式及预后情况。本文符合《赫尔辛基宣言》中的相关要求,患者及其家属知情同意并签署同意书。
2.2. 诊断标准和临床分期
收集的所有PGL患者均符合Dawson 诊断标准 [3]:① 浅表及纵隔淋巴结肿大;② 白细胞计数及分类正常;③ 消化道为病变的主要位置;④ 临床资料完整。临床分期均以Musshoff修改的Ann-Arbor分期为标准进行分期 [4]。
2.3. 随访
截止至2020年11月8日,共62例患者获得随访,随访率86.1%,中位随访时间56个月,最长随访时间110个月。
2.4. 统计学方法
采用SPSS 26.0软件进行统计学处理,预后单因素生存分析采用Kaplan-Meier法,组间比较使用Log-Rank检验,使用Cox回归模型进行预后多因素分析,p < 0.05为差异有统计学意义。
3. 结果
3.1. 临床特征
72例PG1L患者中男36例,女36例,男女比例为1:1。发病中位年龄60 (30~78)岁。病理类型以弥漫大B细胞淋巴瘤为主,占83.8%。随访时间3~110个月不等,中位随访56个月。临床基本资料及实验室检测结果,见表1。


Table 1. Basic clinical data of PGL patients
表1. PGL患者临床基本资料
注:B症状:有38℃以上、不明原因发热或盗汗、6个月内原因不明的体重减轻10%症状之一;IPI:国际预后指数;ALB:白蛋白;LDH (乳酸脱氢酶)升高:>271 U/L;β2微球蛋白升高:>2.71 mg/L。a随访满三年且具有完整资料的例数为31例。
3.2. 胃淋巴瘤分布部位
本研究收集的72位PGL患者中,胃窦部22 (30.5%)例,胃角部4 (5.6%)例,胃底部7 (9.7%)例,胃体部9 (12.5%)例,贲门部4 (5.6%)例,多部位26 (36.1%)例,见图1。
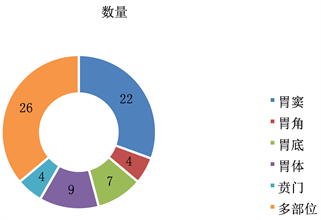
Figure 1. Distribution of different parts of the body
图1. 不同部位分布情况
3.3. PGL患者生存分析
截止至2020年11月08日,72例患者中有62例获得完整随访资料,中位随访56 (3~110)个月。72例PGL患者1年、3年预期生存率分别为98.3%、81.6%,共死亡9例(14.5%)。研究结果显示手术联合化疗及单纯化疗的预后生存明显优于单纯手术的患者,但是差异不具有显著性(p > 0.05),见图2(a)、图2(b),但是随访过程中发现单纯化疗的生活质量要高于手术患者,其中1例拒绝治疗,2例放疗患者,因数量太少未纳入统计。
3.4. PGL的预后情况
收集的PGIL患者中随访满3年生存情况,49例纳入此次统计。49例PGL患者的3年生存率为83.6%。通过对PGL患者3年生存率单因素分析结果提示,年龄 > 60 岁(p = 0.028)、临床分期为III/IV期(p = 0.001)、B症状(p < 0.001)、国际预后指数(IPI)评分3~5分(p = 0.028)、ALB < 35 g/l (p = 0.003)、高水平LDH (p = 0.003)、病理分型为T细胞淋巴瘤(p = 0.006)为影响总生存期的预后因素,差异具有统计学意义,见表2。COX回归模型多因素分析显示,国际预后指数(IPI)评分3~5分(p = 0.022)为预后不良的独立危险因素,见表3。
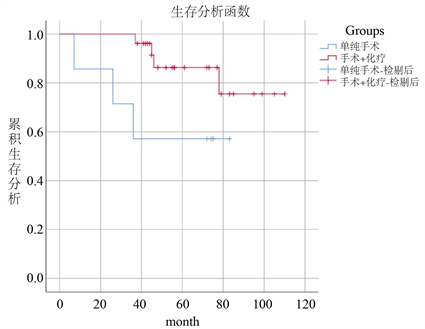 (a)
(a)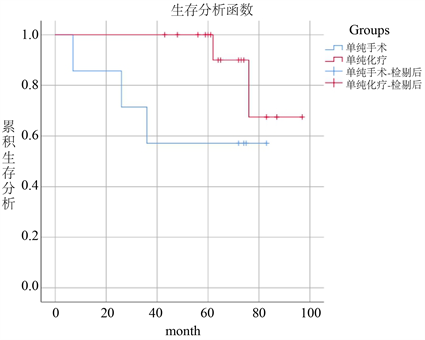 (b)
(b)
Figure 2. Comparison of different treatments
图2. 不同治疗方式对比


Table 2. Single factor analysis of prognostic factors in patients with primary gastric malignant lymphoma
表2. 原发胃恶性淋巴瘤患者影响预后的单因素分析
注:B症状:有38℃以上、不明原因发热或盗汗、6个月内原因不明的体重减轻10%症状之一;ALB:白蛋白;LDH (乳酸脱氢酶)升高:>271 U/L;β2微球蛋白升高:>2.71 mg/L;a随访满三年且具有完整资料的例数为31例,b随访满3年的例数总共为49例。


Table 3. Multivariate analysis of prognostic factors in patients with primary gastric malignant lymphoma
表3. 原发胃恶性淋巴瘤患者预后影响因素多因素分析
注:B症状:有38℃以上、不明原因发热或盗汗、6个月内原因不明的体重减轻10%症状之一;IPI:国际预后指数;ALB:白蛋白;LDH (乳酸脱氢酶)升高:>271 U/L。
4. 讨论
结外恶性淋巴瘤(Extra-nodal lymphoma, ENL)是指位于淋巴结以外的淋巴器官或者非淋巴组织聚集器官的恶性淋巴瘤,发病部位最常见于胃其次是肠道,其发病率分别为60%~70%、20%~30% [5],占胃肠道恶性肿瘤的0.9%~6.5%,男性略多于女性 [6]。近年来,PGL 的发病率呈现出升高趋势,这可能与人们饮食习惯及生活方式改变有关,也与人们的就医观念、诊断技术及仪器的提升有关。但是对于PGIL患者的临床特征、影响预后的因素、治疗方案的选择等方面仍存在明显短板。目前PGL患者发病原因未明,但是有部分学者提出其可能与幽门螺旋杆菌感染、患者自身免疫状况、EB病毒感染及长期慢性炎症等存在关联 [7]。
本次研究结果显示,72例PGL患者中男女比例为1:1,发病的中位年龄是60岁,以中老年多见,与现有的大多数研究结果相符合,但是性别方面略有不同 [6],这与收集的样本量不足及样本中不包含肠道淋巴瘤存在相关性。大多数患者最开始发病时缺乏特异性临床表现,仅以腹痛、腹胀、呕血、反酸等消化道表现为主诉入院,也有部分以B症状为唯一表现,常被误诊为其他消化道肿瘤,因此对于中老年患者特别注意鉴别胃淋巴瘤。PGL患者确诊主要依赖于胃镜、超声或CT穿刺及外科手术取得的标本经病理学证实。PGL主要来自黏膜的淋巴组织恶变,内镜下多为溃疡浸润等表现,缺乏特异性,特别是早期黏膜破坏尚不明显,使得取材诊断难度很高,易产生假阴性结果 [8],因此对PGL患者建议多点深部取材,可以降低漏诊率。
PGL细胞起源分为B细胞源性和T细胞源性。本研究中的72例PGL患者,B细胞源性淋巴瘤最为多见,占86.1% (62例),T细胞源性13.9% (10例),三年生存率分别为84.4%、50%,结果提示T细胞源性患者预后更差,差异具有统计学意义。Fang JC等发现B细胞源性的淋巴瘤临床表现以腹部包块较为多见,而T细胞源性的淋巴瘤以穿孔、疼痛以及B症状更为常见,这与T细胞源性预后生存更差存在相关性 [9]。在实际临床工作中一旦发现T细胞源性淋巴瘤,尽早对患者采取个体化治疗措施。但是关于T细胞型PGL患者的治疗方案仍存在巨大的短板,缺乏标准的治疗方案,需要进一步开发新的针对T细胞型淋巴瘤的靶向药物 [10]。
目前,PGL的治疗方式主要为手术、放化疗、HP根除治疗以及联合治疗等。但是针对PGL的治疗缺乏一个“金标准”,外科手术曾一度被认为是PGL的首选治疗方式,但随着对该病研究的不断深入,人们发现由于淋巴瘤是一种全身性疾病,单纯手术并不能使患者产生较好的预后,反而会增加机体创伤、术后感染及死亡率,然而以蒽环类药物为基础的CHOP方案和R-CHOP方案在治疗PGL方面取得了较满意的疗效,因此已逐渐替代手术成为首选治疗方式 [11]。但是外科手术治疗仍具有其特有的优势,例如减轻肿瘤的压迫、明确病理、控制消化道出血、穿孔等并发症。在本次研究中共有42例患者接受了手术治疗,其中有35例患者术后辅以CHOP/R-CHOP方案化疗,27例接受单纯化疗,单纯手术、手术联合化疗及单纯化疗三者的三年生存率分别为57.1%、84.6%、87.5%。虽然差异不具有统计学意义,但是经过随访发现,化疗、手术结合化疗患者的3年及远期预后要优于单纯手术患者,尤其是化疗患者的生活质量更高,这与手术创伤及术后出现的消化道并发症密不可分,PGL易感人群主要偏向于中老年人群,其机体的恢复能力相对较低。这也提醒我们,在面对PGIL患者时一定要严格把控手术适应症。
在实际临床中,我们发现血清肿瘤负荷相关标志物(LDH及β2微球蛋白水平)在反映淋巴瘤大小、侵袭性及预后预测中具有较高的应用价值。本研究结果提示LDH水平升高(P = 0.008, χ2 = 7.001)比LDH正常水平的患者预后差,这可能与PGIL患者体的内淋巴瘤细胞大量增殖分化,需要大量的能量供应,而此时糖酵解成为其能量来源的最佳选择 [12],血清LDH水平也随之升高,同时临床分期晚、治疗效果差的患者体内淋巴瘤瘤细胞的增殖分化更加活跃,因此其LDH水平也更高。β2微球蛋白是一种低分子血清蛋白质,正常人其合成速度和细胞模释放量维持在一种稳定的状态,而PGL患者体内特定微环境血清导致淋巴瘤细胞合成β2微球蛋白的速度加快导致平衡打破。Kanemasa Y等推荐血清β2微球蛋白水平作为评估PGL患者预后的新指标 [13]。本组研究结果提示PGL血清β2微球蛋白水平的升高(χ2 = 3.381, P = 0.066)的患者比血清β2正常的患者预后较差,但是差异不具有统计学意义。这可能与样本量不足导致分析结果出现差异,需要收集更多的样本进行验证。
综上所述,临床分期、B症状、IPI、ALB < 35 g/l、病理分型、LDH对评估PGL患者的预后情况具有重要价值,而HGB < 100 g/L及β2微球蛋白患者虽然不具有统计学差异(P > 0.05),但是分析结果提示HGB < 100及β2微球蛋白患者预后更差,这可能与我们收集的样本量不足及随访时间存在相关性。其中IPI评分3~5分为预后不良的独立危险因素,对患者预后状况及总体生存存在负面影响,对此类PGL患者应尽早采取积极的个体化应对措施。
NOTES
*通讯作者。