1. 绪论
纳米技术的快速发展为肿瘤的诊疗带来了新机遇 [1]。纳米结构的形成不仅能够通过EPR效应靶向肿瘤组织,增加肿瘤细胞的内吞,还能有效降低药物的肾清除率(长效驻留率)。近年来,各种各样的纳米载药体系被提出并进行了实验研究,都展现出了优越的治疗性 [2] [3] [4]。为了减轻药物带来的全身毒副作用,降低耐药可能性,解决药物降解与清除,人们研发了多种可以向肿瘤区域进行有效递送并控制释放的抗癌药物纳米载体 [5] [6]。但制备纳米载药体系所用材料本身存在的生物相容性、生物安全性等问题需要始终限制着载药体系的研究和发展 [7] [8] [9] [10]。
作为治疗癌症的两种最常见的光疗方法,光热疗法和光动力疗法推动着纳米载药体系的不断发展。近来,许多光热材料 [11] [12] (例如贵金属材料,过渡金属硫氧化物,碳材料和上转换纳米材料)和光动力材料 [13] [14] (例如酞菁氰,卟啉和其他染料分子)已用于光热疗法(Photothermal therapy, PTT)和光动力疗法(Photodynamic therapy, PDT)。无机纳米材料是早期用于研究光热/光动力联合治疗的材料,如碳纳米管,其具有高纵横比、超轻重量、高机械强度、高导电性和高导热性,可用于癌症的热消融、诊断和药物输送,然而,无机纳米材料分散性差,容易引起免疫反应限制了其临床应用 [15]。卟啉类和卟啉衍生物类光敏剂是最早开发也是最早上市的肿瘤光动力治疗药物 [16]。然而,刺激卟啉而发挥作用的可见光(VIS)难以穿透组织到达深部肿瘤组织,只能用于治疗皮肤或浅层组织。700~1100 nm的近红外光照辐射(Near-infrared light radiation, NIR)为大多数生物分子的吸收窗口,可以穿透深层组织,在肿瘤PTT和PDT中具有广阔的应用前景 [17] [18]。
近年来,基于共轭聚合物的有机近红外吸收材料研究的发展,为探索强近红外吸收和高光热转换效率且无生物毒性的光热转换材料提供了新的思路 [19] [20]。此外,有研究表明随着作用光谱的红移,PDT的杀伤深度有趋于增大的变化。在治疗窗口内(近红外)辐射可能是刺激光敏剂在更深层组织进行光动力治疗的有效方法,因此,研究开发基于近红外波长吸收光敏剂的高效PDT药物治疗体系十分有必要。
本研究针对纳米载药体系存在的生物相容性的问题以及光动力治疗中穿透深度不够的问题,采用具有强近红外吸收、高光热转换效率以及无生物毒性的聚多巴胺(Polydopamine, PDA)为光热剂与药物载体,具有近红外吸收、高活性氧产量的吲哚菁绿(Indocyanine green, ICG)为光敏剂和被载药物,通过水热法制备用于光热/光动力联合治疗的ICG/PDA复合纳米载药体系。该方法基于PDA大量的离域π电子,将芳香分子ICG通过π-π堆积和疏水相互作用实现ICG的有效装载,旨在解决材料生物相容性的同时,利用简单一步法构建结构简单、单一刺激因素控制的复合近红外光照控释系统。
2. 材料和方法
2.1. 材料和试剂
以吲哚菁绿ICG和盐酸多巴胺DA为主要原料,采用一步法制备材料ICG/PDA,通过人卵巢癌细胞试验,对材料的治疗性能进行测试与表征。实验所用原料试剂如表1所示,仪器设备如表2所示,细胞如表3所示。

Table 1. Experimental reagents and raw materials
表1. 实验用试剂与原料

Table 2. Experimental instruments and equipment
表2. 实验用仪器与设备

Table 3. Cells used in the experiment
表3. 实验用的细胞
2.2. 材料制备与合成
以盐酸多巴胺及吲哚菁绿为原料,水热法制备ICG/PDA纳米复合体系。1) 氧化自聚合制备PDA纳米粒:称取100 mg盐酸多巴胺,溶于100 mL Tris缓冲液(10 mM),室温下磁性搅拌反应24 h。11,000 r/min速度离心5 min,收集产物,去离子水洗涤三遍后备用。2) 水热法制备ICG/PDA纳米粒:盐酸多巴胺(100 mg)溶于100 mL Tris缓冲溶液(10 mM),室温下搅拌4 h后,称取10 mg ICG溶于2 mL去离子水,逐滴加入到上述反应溶液中。室温下继续反应20 h,ICG在PDA的后续聚合过程中通过π-π堆积和疏水作用装载到PDA纳米微球内部。反应结束后,离心(11,000 r/min,5 min)收集产物ICG/PDA NPs,并用去离子水洗涤一次后备用,如图1所示。

Figure 1. Schematic diagram of the preparation of ICG/PDA nanoparticles
图1. ICG/PDA纳米粒的制备原理图
2.3. 材料组成与结构表征
通过扫描电子显微镜(SEM)进行纳米颗粒的形貌分析。通过动态光扫描(DLS)分析表征了PDA、ICG/PDA NPs的流体动力学直径(DH)和zeta电位(ζ)。用傅立叶变换红外(FT-IR)光谱仪对DA和PDA进行结构鉴定。通过紫外分光光度计测得ICG、PDA和ICG/PDA等材料的紫外–可见吸收光谱,分析测得合成材料的特征吸收峰位置是否出现红移,鉴定材料是否成功负载ICG。
2.4. 材料理化性能测试
光热转换与循环稳定性测试:在功率密度为1 W/cm2的近红外激光照射下,对ICG、PDA和ICG/PDA材料(CICG = 10 μg/mL)进行了光热转换性能和5次光热循环稳定性测试,并利用近红外照相机拍摄热成像照片、数字测温仪进行温度变化曲线记录。
活性氧产量测试:200 μg ICG/PDA溶于2 mL 1:1000培养基配置的DCFH-DA溶液制备浓度为100 μg/mL的材料/DCFH-DA分散液。将10 μg的ICG充分溶解于2 mL的用培养基按照1:1000配置好的DCFH-DA溶液中制备浓度为5 μg/mL的ICG/DCFH-DA分散液。在功率密度1 W/cm2的近红外激光辐照下,分别对上述分散液进行时长60 min的光照辐射,每间隔10 min取100 μL分散液用培养基稀释至2 mL,通过混合液的荧光发射曲线在520 nm左右吸收峰的上升速度,比较不同材料活性氧产生速度,通过混合液荧光发射曲线在520 nm处上升幅度比较不同材料活性氧产生量。
2.5. 细胞试验研究
采用HUVECs和SKOV3进行体外生物学行为研究。材料的生物相容性通过细胞毒性试验表征,采用CCK-8测定了不同浓度材料作用下的细胞活性。通过对与ICG/PDA材料共孵育2 h的细胞进行了时长为10 min的近红外激光辐照(1 W/cm2),在激光共聚焦下观察了材料入胞的情况。
胞内活性氧产效实验通过将材料和DCFH-DA先后与细胞共孵育2 h和30 min后,在功率密度1 W/cm2的近红外激光下进行10 min的光照,荧光倒置显微镜下观察绿色荧光的强度进行评价。
通过体外细胞药物疗效试验验证本研究制备材料ICG/PDA的治疗效果,将接板的细胞,随机分A、B两组,A为光照组、B为非光照组。接板过夜后吸弃培养基,加入完全培养基稀释的药物孵育2 h (设置control,每个样至少三组平行实验)后取出,非光照组与光照组至于同一环境条件下,将光照组在808 nm激光辐射下光照10 min/孔,能量密度为2.2 W/cm2,随后所有孔用PBS轻柔润洗2次,避免冲洗掉死亡细胞。Calcein-AM/PI双染试剂盒对药物作用后的细胞进行活死染色10~30 min,除去染液后,荧光显微镜下观察荧光,并拍照记录。
2.6. 数据处理与统计
所有试验数据均通过归一化处理。数据采用SPSS 24.0统计软件进行分析数据均数及标准差,组间比较采用单因素方差分析,P值 < 0.05为有统计学意义,柱状图由Origin Pro 9.1软件绘制。
3. 结果与讨论
3.1. 材料的组成与结构
纳米复合材料的形貌、粒径和荷电性是决定载药系统是否能够以稳定的形态通过循环聚集到肿瘤组织区域、实现靶向运载和协助胞吞的关键。因此,利用DLS和SEM观察了所制备材料的形貌、粒径分布以及材料荷电情况。所制备PDA,ICG/PDA NPs的组成与结构表征结果如图2所示。
SEM结果表明,PDA与ICG/PDA纳米材料的形态完整均匀,均是单分散状态微球(图2(a),图2(b),图2(d),图2(e)),这有利于材料实现胞吞。PDA NPs和ICG/PDA NPs的最终的平均水合粒径分别为222 nm,226 nm (图2(f)),与SEM结果一致。ICG/PDA NPs的ζ电位较PDA NPs呈现负向增加,侧面说明ICG实现了成功装载(图2(c))。
图2(g)是DA·HCl与PDA的UV-vis吸收光谱对比图,在DA聚合形成PDA后不仅在溶液颜色上发生了明显的改变,从无色透明的DA溶液变成了深棕色的PDA溶液,也在UV-vis光吸收上实现了从无到有的变化。从图中可知深棕色的聚多巴胺在紫外到近红外的波长范围内有宽频段的单调吸收。如图2(h)所示,图中红色曲线和蓝色曲线分别代表了冻干处理后的PDA NPs和DA·HCl粉末的红外光谱图。与DA·HCl相比,PDA在1300~400 cm−1指纹区的吸收峰精细性较差。众所周知,指纹区对分子结构的变化高度敏感,由此可推测出DA·HCl分子结构在聚合形成PDA过程中发生了结构性的变化,黑色虚线标志的1520、1615和3420 cm−1处的吸收带分别对应了先按结构中的N-H、芳环上的C-H和儿茶酚基团中的-OH的剪切振动,这些特征吸收带的明显变化也在结构变化上证明了PDA生成。
UV-vis吸收曲线显示,复合后的ICG/PDA材料较ICG的特征吸收峰明显红移,这是由于当ICG分子吸附到正在聚合的PDA纳米颗粒表面后,相互接触的ICG分子通过离域电子的传导致使材料吸收峰发生红移,说明PDA的大量离域π电子与芳香分子ICG之间发生了π-π共轭,实现了ICG的成功装载(图2(i)),通过UV-vis测得的吸光度与材料浓度的对应关系,对ICG/PDA复合纳米材料进行载药量计算,最终算的ICG/PDA材料的ICG装载率达到了4%,包封效率约69%。

Figure 2. Composition and structure characterization results. (a, b) SEM images of PDA; (d, e) SME images of ICG/PDA; (c) Zeta potential; (f) Hydrated particle size; (g) PDA and DA UV-vis absorption curve comparison chart; (h) Fourier infrared (FT-IR) curve of PDA and DA; (i) UV-vis absorption curve comparison chart of ICG/PDA system
图2. 组成与结构表征结果图。(a, b) PDA的SEM图;(d, e) ICG/PDA的SME图;(c) zeta电位;(f) 水合粒径;(g) PDA与DA的UV-vis吸收曲线比较图;(h) PDA与DA的傅里叶红外(FT-IR)曲线;(i) ICG/PDA体系的UV-vis吸收曲线比较图
PDA复杂的连接方式决定了PDA对光的吸收在一定波长范围内呈现出连续性,结构的变化也赋予了PDA在近红外光照辐射下可实现光吸收与光热转换,其过程可描述为PDA分子的价电子吸收近红外光子能量后发生量子化的能级跃迁,而PDA独特的聚合方式所形成的分子内与分子间氢键与π-π堆叠决定了PDA分子的激发价电子以热的形式释放能量发生非辐射衰减来实现PDA的光热转换,而这种非辐射衰减的方式决定了激发态电子不经过发射荧光,而是通过猝灭或能量转移的方式回到基态,这种能量转移形式能够解决光热剂与光敏剂协同治疗过程中吸收不匹配或能量转移、复杂的共轭化学等问题。因此,理论上PDA独特结构决定其能够在与光敏剂ICG共同制备合成的光热/光动力协同治疗体系能够实现合适能量吸收匹配与转移,并猝灭ICG的荧光,保证ICG在体系内的稳定性,从而达到提高了ICG的单线态氧产率的目的。与此同时,ICG装载到纳米颗粒表面之后,与周围的水/氧分子之间接触减少,相互作用减弱,有利于降低光漂白作用,并且其分散性增加,阻止了ICG分子间的进一步聚集,解决了ICG单独存在时所具有的浓度聚集性以及ICG单独存在时更容易出现光漂白现象的问题,这也从理论上证明了后续材料体外光热转换实验结果。
3.2. 光热转换与活性氧产生
本研究制备的ICG/PDA体系是用于光热/光动力联合治疗的纳米载药体系,因此,我们采用近红外照相机和UT325接触式数字测温仪测试了不同材料光热转换能力以及光热循环稳定性,以次来评估所制备的ICG/PDA材料是否具备光热治疗的能力。此外,我们通过DCFH-DA对材料产生活性氧的速度和最终产量进行测试,以评估所制备ICG/PDA材料是否具备光动力治疗的能力。我们按照图3(b)所示方法对材料进行了近红外光照辐射并测试,结果如图3所示。

Figure 3. Results of material performance characterization. (a) ICG/PDA system photothermal conversion absorption curve comparison diagram; (b) illumination test schematic diagram; (c) photothermal conversion principle diagram; (d) ICG; (e) ICG/PDA and (g) PDA light Thermal cycle curve; (h) ICG/PDA system photothermal cycle stability comparison diagram; (f) ICG/PDA active oxygen test result diagram; (i) ICG active oxygen test result diagram
图3. 材料性能表征结果图。(a) ICG/PDA体系光热转换吸收曲线比较图;(b) 光照试验示意图;(c) 光热转换原理图;(d) ICG;(e) ICG/PDA与(g) PDA的光热循环曲线;(h) ICG/PDA体系的光热循环稳定性比较图;(f) ICG/PDA的活性氧测试结果图;(i) ICG的活性氧测试结果图
从图3(a),图3(c)可直观的发现,在相同PDA浓度和光照条件下,不同材料温度随时间上升,且上升速度呈现为ICG/PDA > PDA > ICG > UP水,充分说明了所制备的ICG/PDA材料较ICG和PDA具有更好的光热转换效果,材料分散溶液温度能够在光照10 min后升高约31.5℃,此外,ICG/PDA材料在光照下温度上升速度较ICG和PDA更快。
图3(d),图3(e),图3(g)分别是ICG、ICG/PDA、PDA的光热循环温度变化曲线,图3(h)是ICG/PDA体系的光热循环温度变化比较图,结果表明,ICG/PDA和PDA具有较好的光热循环稳定性,而ICG在近红外光照辐射下温度上升幅度逐渐减小,这说明与PDA复合形成ICG/PDA复合纳米材料之后,实现了光照循环的稳定,避免了ICG光照漂白失效的发生。
图3(f),图3(i)分别是用DCFH-DA溶液分散的ICG/PDA和ICG在1 W/cm2的近红外光照辐射下照射10、20、30、40、50、60 min后的荧光发射曲线。上升幅度越高,说明产生活性氧越多,曲线斜率越大,说明活性氧产生速度越快。结果表明,随着照射的进行,材料的活性氧产量逐渐增加,且ICG/PDA的活性氧产生速度较ICG更快,在最终试验结束时活性氧终产量较ICG更多。
3.3. 细胞毒性与抑癌效应
材料的生物相容性决定了材料是否能够应用于人体,因此,生物安全性与生物相容性是生物医学材料在临床应用中必需高度关注的性能,也是评价所有肿瘤纳米载药体系的重要环节。在本节中,对制备的复合纳米材料的细胞毒性、细胞内化以及光照毒性抑制等进行评价。ICG/PDA材料对人脐静脉内皮细胞HUVECs的细胞毒性,结果如图4(a),图4(b)所示。

Figure 4. Cytotoxicity and internalization results of ICG/PDA materials. (a) Cell morphology of HUVECs after 24 hours of co-cultivation with ICG/PDA materials; (b) HUVECs cytotoxicity quantitative chart; (c) SKOV3 cell internalization result
图4. ICG/PDA材料的细胞毒性和内化结果图。(a) 与ICG/PDA材料共培养24 h后HUVECs形态图;(b) HUVECs细胞毒性定量图;(c) SKOV3细胞内化结果图
图4(a)结果表明,材料对HUVECs细胞的细胞数量与细胞生长状态都没有较显著的影响,仅在高浓度材料共孵育条件下有极少数细胞呈圆缩、疏松贴壁,但无胞浆内颗粒或显示形态学方面的改变,能够观察到轻微的细胞生长抑制现象,没达到细胞毒性的标准。如图4(b)所示,随着材料浓度的上升,不同材料组细胞存活率均 > 80%,说明本实验制备的材料均具有较好的细胞生物相容性(c ≤ 200 μg/mL)。
图4(c)是SKOV3细胞与浓度为100 μg/mL的ICG/PDA共培养2 h后,在功率密度为1 W/cm2的近红外光照下材料内化的结果图,红色的荧光是ICG通过能量转换发射出的荧光,蓝色的荧光是核定位染料DAPI的荧光,结果表明,ICG/PDA能够有效进入细胞内部,此外,在近红外光照下,ICG/PDA能够解离开来,并释放ICG分子,解离下来的ICG不仅在细胞质内扩散,还能够进入细胞核内,有利于进一步的治疗开展。
为了进一步测试材料入胞后活性氧产效,本研究采用DCFH-DA试剂盒对细胞进行了活性氧测试。将含相同ICG浓度(10 μg/mL)的不同材料溶液分别与不同细胞共培养后进行光照辐射,通过在倒置荧光显微镜下拍取SKOV3细胞荧光照片对材料经过近红外光照后在胞内产生的活性氧量进行评价与分析,结果如图5所示。

Figure 5. Test results of the production of reactive oxygen species in the cells
图5. 材料在细胞内活性氧生产测试结果图
图示蓝色荧光是核定位染料DAPI的荧光,绿色荧光是DCFH-DA试剂被材料产生的活性氧所氧化,形成了绿色荧光物质,荧光越强说明产生的活性氧越多。Control组和PDA组的细胞未出现显著绿色荧光,说明细胞本身和PDA材料无活性氧产生,而在与含有ICG的材料共孵育后的细胞组光照后均出现了绿色荧光,说明活性氧是ICG在近红外光照条件下产生的,且合成的ICG/PDA材料具有较好的活性氧产生量。
最后,我们通过Calcein-AM/PI细胞活死染色定性评价了ICG/PDA材料对细胞的光毒抑制作用。通过控制激光照射距离和输出功率,获得激光功率密度为2.2 W/cm2、辐照圆圈直径为1 cm的光照条件。将前一天用6孔板接板的细胞与含有ICG浓度为10 μg/mL的ICG/PDA材料共孵育2 h后,将激光光斑中心调节至与6孔板(d = 3 cm)中心重叠后进行时长10 min的近红外激光辐照。
图6是SKOV3细胞的未光照区域、光照过渡区域和光照辐射区域细胞活死染色图,绿色是Calcein-AM染料染色的活细胞,红色是PI染料染色的死细胞,染色不明显的细胞可能存在凋亡趋势。Calcein-AM/PI细胞活死染色图结果表明,没有光照的部分细胞边缘清晰且形态饱满,核质分明;而进行了光照部分的细胞周围材料沉积显著且细胞扁平而破碎,核质不清;过渡区域由于处于能量边界区域,出现了活细胞死细胞共存的现象。结果表明光热–光动力协同治疗具有高选择性,同时也提示临床选择合适的光照辐射区域与激光辐照强度是实现肿瘤根治的必要条件。
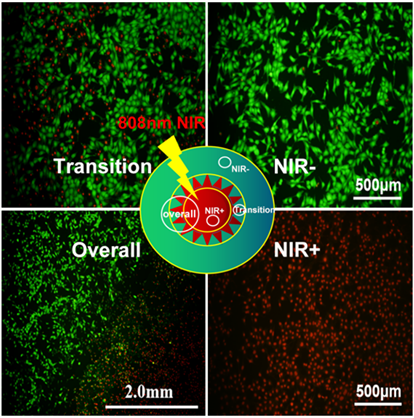
Figure 6. Test results of the phototoxicity inhibition effect of materials on cells
图6. 材料对细胞的光毒抑制作用测试结果图
4. 结论
综上所述,本研究采用一步法制备ICG/PDA复合纳米材料,制备条件温和,过程简单。ICG/PDA复合纳米粒较游离ICG具有更好的光热循环稳定性,有较高的载药量和灵敏的近红外响应性药物控制释放性能,一定程度解决光热剂与光敏剂协同治疗过程中吸收不匹配或能量转移、复杂的共轭化学等问题,因此ICG/PDA纳米材料体系能够实现有效的能量利用。所制备的ICG/PDA纳米复合材料较PDA和ICG有更高的光热转换效果,升温速度更快,活性氧产生速度更快,活性氧产量更高。ICG/PDA纳米复合材料具有较高的生物相容性,能够有效的被细胞摄取,在近红外光照下,能够实现优异的光照抑制毒性。因此,本研究所制备的ICG/PDA复合纳米材料具有了在近红外响应性下实现多模式联合治疗肿瘤的较大潜力,为后续在近红外响应性下实现多模式协同靶向治疗肿瘤的光热–光动力协同治疗体系研究提供了指导和借鉴。
NOTES
*通讯作者。