1. 引言
ALL是最常见的儿童恶性肿瘤,占所有儿童癌症的三分之一。在过去的几十年里,不断更新的化疗方案改善了ALL儿童的预后,五年生存率提升至近90%,因此,化疗后产生的后遗症越来越受到重视。在后续随访中,ALL患儿在特定的神经认知功能方面有一定的缺陷,特别是处理速度和执行能力方面。与这些认知副作用相对应,儿童癌症治疗也有可能诱发不良的急性神经系统症状,例如癫痫发作、头痛、精神状态改变和白质脑病,最常见的则为可逆性后部白质脑病(PRES) [1]。但相关病例报告较少,因此现报道1例接受第2次大剂量甲氨蝶呤化疗期间出现可逆性后部白质脑病的案例。
2. 病例资料
患儿,男,7岁,因“发热5天,发现血象异常2天”于2020年12月29日首次入我院。入院后查血常规 + CRP:白细胞计数130.96 × 109/L,中性粒细胞计数7.07 × 109/L,淋巴细胞计数119.57 × 109/L,红细胞计数2.99 × 1012/L,血红蛋白75 g/L,血小板97 × 109/L,CRP 6.01 mg/L;颅脑CT正常,E2A-PBX1融合基因阳性,经MICM分型明确诊断为急性淋巴细胞白血病(ALL-B)。按中国儿童肿瘤协作组CCCG-ALL-2020方案规范化疗 [2]。顺利完成诱导缓解、CAT、CAT+方案化疗,D19MRD 1.39%,D46MRD < 0.01%。行第一次大剂量甲氨蝶呤(HD-MTX),内生肌酐清除率为71.7 ml/min,根据患儿肌酐水平及方案调整剂量为全量80% (3.8 g),20小时甲氨蝶呤浓度57.20 umol/L,定时给予左亚叶酸钙解救,至甲氨蝶呤浓度 < 0.01 umol/L。
2021年4月4日为行第2疗程大剂量甲氨蝶呤(HD-MTX)入院。查体无阳性指征,完善脑脊液常规、生化、甩片未提示异常。
4月13日行HD-MTX化疗:给予全量MTX为5 g/m2 (其中0.475 g于0.5 h内静脉滴注,余4.275 g持续静脉滴注23.5 h),输注开始后2小时,给予醋酸地塞米松5 mg + 注射用阿糖胞苷35 mg + 注射用MTX12.5 mg三联鞘注一次。HD-MTX前3小时,开始水化和碳酸氢钠碱化(检测尿PH值 > 7)。常规进行MTX甲氨蝶呤浓度检测,20小时浓度为53.1 umol/L。
化疗后20 h,患儿出现头晕、恶心、腹痛、呕吐,考虑与化疗药物相关,予调整水化碱化并加用止吐、补液支持治疗,患儿症状未见好转。调整左亚叶酸钙解救时间至甲氨蝶呤后32 h。44 hMTX浓度为29.8 umol/L,立即给予左亚叶酸钙(100 mg/m2)解救治疗。
化疗后70 h患儿突发抽搐一次,表现为意识丧失,呼之不应,双目凝视,肢体僵硬,持续约3分钟,给予地西泮5mg镇静后缓解。当时测血压140/95 mmHg。查体:左上肢及左下肢肌张力增高,左下肢巴氏征阳性。完善颅脑MRI平扫检查,示双侧额顶枕叶散在斑片状略长T1长T2异常信号,FLAIRR像呈高信号(见图1),DWI呈局部高信号(见图2)。行脑电图检查示2~7 Hz中–高波幅慢活动,各区多量,部
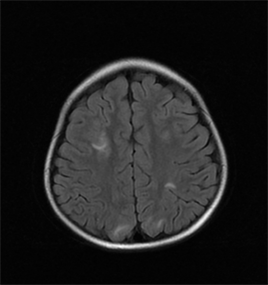
Figure 1. Skull MRI-T2 FLAIR sequence. Bilateral fronto-parietal occipital lobes were scattered with patchy slightly long T1 and long T2 abnormal signals
图1. 头颅MRI-T2 FLAIR序列。双侧额顶枕叶散在斑片状略长T1长T2异常信号
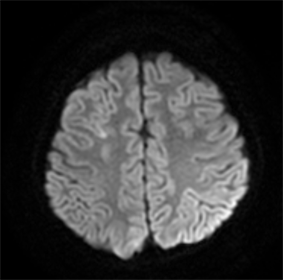
Figure 2. Skull MRI-DWI sequence. Bilateral fronto-parietal occipital lobe scattered patchy scattered high signal changes
图2. 头颅MRI-DWI序列。双侧额顶枕叶散在斑片状散在高信号改变
分呈节律出现。给予患儿血液滤过处理,未再出现抽搐,恶心、呕吐缓解。外送脑脊液脱髓鞘抗体及自身免疫脑炎抗体检查,结果未见明显异常。患儿仍有间断头痛,血压最高150/90 mmHg,给予卡托普利、呋塞米降压,甘露醇缓解脑水肿。经过治疗患儿甲氨蝶呤浓度逐渐下降至小于0.01 umol/L,血压控制稳定,未再出现抽搐症状。2周后复查颅脑MRI平扫检查未出现病变区域(见图3、图4)。
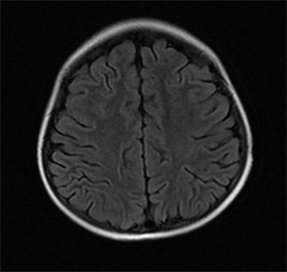
Figure 3. Head MRI-T2 FLAIR sequence
图3. 头颅MRI-T2 FLAIR序列
本例患儿系ALL (中危),在进行第2次HD-MTX化疗后24小时内出现恶心、头痛、抽搐、血压升高等不良反应,颅脑MRI平扫提示双侧额顶枕叶散在斑片状异常信号,期间完善脑脊液常规、生化和流式检查,未提示异常。经对症治疗2周后症状消失,复查颅脑MRI平扫原病灶恢复正常,排除中枢神经系统浸润。且未使用抗感染治疗,排除颅内感染的发生,综合以上,诊断为可逆性后部白质脑病。
3. 讨论
在急性儿童淋巴细胞白血病的整个治疗过程中,甲氨蝶呤是治疗的基本药物,除了全身控制白血病外,对于预防和治疗中枢神经系统病变也至关重要。然而甲氨蝶呤可能引起急性、亚急性和长期神经毒性,其机制可能是通过中枢神经系统叶酸稳态或直接破坏神经元引起的 [3]。临床症状通常与白质脑病有关,影像学有其特殊改变。
PRES在1996年由Hinchey [4] 等首先报道,并指出本病多见于恶性高血压或子痫、严重肾脏疾病、恶性肿瘤化疗以及各种器官组织移植后接受免疫抑制治疗的患者 [5]。PRES常急性或亚急性起病,表现为头痛、癫痫发作、意识障碍、视觉障碍及局灶性神经功能缺损等。其中,头痛、意识障碍和癫痫发作较常见,头痛常为逐渐起病的弥漫性钝痛,意识障碍可从轻度意思模糊到重度昏迷,癫痫持续状态相对少见。视觉障碍可为视力下降、视野丧失、皮质盲或幻觉。当患者同时出现头痛、癫痫发作或视觉障碍时,需高度怀疑PRES。先前报道表明大多患者可以安全地接受后续甲氨蝶呤的治疗,但有些患者会出现神经毒性复发。大剂量甲氨蝶呤和10岁以上的儿童患急性脑病的风险增加 [6]。本病例中,患儿表现出全身强直阵挛性癫痫发作,伴有血压升高,这与其他研究者描述的症状一致。
在ALL诱导化疗阶段发生PRES可能与HD-MTX静脉注射及鞘内注射关系密切。鞘内注射甲氨蝶呤对中枢神经细胞有直接的毒性作用,损伤神经元及星形胶质细胞,干扰了同型半胱氨兴奋性氨基酸、S-腺苷甲硫氨酸和S-腺苷半胱氨酸、腺苷和生物蝶呤的代谢通路,导致兴奋性氨基酸及腺苷生成增加,生物蝶呤减少,使得血脑屏障和血管内皮受损,从而产生神经组织血管性水肿 [7]。
PRES诊断首选颅脑MRI检查,PRES在急性期典型影像学特点为顶枕叶皮层下白质为主的血管源性水肿,T1加权成像(T1-weighted MR imaging, T1WI)呈低信号,T2WI呈高信号,液体衰减反转恢复(TLAIR)序列显示为点状或片状异常高信号。FLAIR和DWI图像有助于区分血管源性水肿和细胞毒性水肿,后者在PRES病变中明显。血管源性水肿在DWI中显示等信号或低信号,在弥散成像(apparent diffusion imaging coefficient, ADC)显示为高信号,而细胞毒性水肿在DWI中显示为高信号,在ADC图上显示为低信号 [8]。除顶枕叶外,病变异常也累及额叶、颞叶及小脑。PRES病变常对称分布,也可不对称,甚至仅为单侧分布,类似肿瘤病变 [9]。需将以下疾病与PRES相鉴别,如传染性脑炎、急性播散性脑脊髓炎、进行性多灶性白质脑病、血管炎、脑静脉窦血栓形成和缺血性中风等 [10]。
美国St Jude儿童医院Bhojwani等 [7] 研究示42小时MTX水平与亚叶酸剂量的比率与神经毒性事件的风险增加无关,这表明亚叶酸钙的充分解救可能减弱了MTX的神经毒性。大多数临床神经毒性的发生是短暂的,症状缓解后大多数患者均可成功接受后续的HD-MTX和IT治疗,研究报道14例发生MTX相关中枢神经系统毒性的病例,其中13例再次接受MTX鞘内注射或HD-MTX,12例未再发生神经系统毒性。同时他们发现在出现神经症状的10名患者中,有3名在首次服用大剂量MTX后但在神经毒性事件发生前MRI为阴性,因此不能认为MRI阴性预示着缺乏神经毒性。
高血压和诱导缓解化疗是儿童肿瘤患者PRES的危险因素。化疗过程中常见的并发症如高血压、全身炎症反应、败血症、高黏滞综合征、电解质失衡可能会对预后产生负面影响并改变疾病的发展进程。一项研究表明,血清乳酸脱氢酶升高(LDH)是内皮功能障碍的标志物,在化疗过程中并发PRES的患者该指标升高具有统计学意义 [11]。
本病例无放疗及免疫抑制剂治疗史,化疗期间肾功能正常,检测MTX血药浓度增高,排泄延迟,在第2周期HD-MTX化疗第2天出现神经系统损害,并出现血压升高,结合颅脑MRI检查诊断为PRES。考虑可能与以下因素有关:患儿MTX用药基因提示毒性小,但年龄偏大,MTX在体内的吸收、分布、转化和排泄接近青少年,耐受性以及代谢能力低于低龄儿童;既往化疗可能影响患儿的血脑屏障功能及脑脊液内环境,导致MTX中枢神经毒性敏感性增强;MTX对中枢神经毒性作用具有剂量累计效应。
该病例E2A-PBX1融合基因阳性,此基因阳性提示起病时肿瘤负荷高,但早期治疗反应好,MRD转阴快,远期生存差主要是由于其缓解后容易复发,且复发时常发生克隆演化,出现新的分子学异常 [12]。并未有文献表明E2A-PBX1融合基因阳性与PRES的发生呈相关性。
早期诊断和立即纠正PRES的病因是成功的关键。其治疗原则是去除诱因、控制血压、减少或停止正在应用的免疫抑制剂或细胞毒性药物、降颅压、控制癫痫发作、纠正内环境紊乱等对症治疗。对于PRES后哪些患者应该接受抗癫痫治疗尚未达到共识 [13]。推迟下一个疗程的大剂量静脉注射MTX,此可有效地清除神经毒性药物。积极应用降压药物控制高血压,应用甘露醇和地塞米松等有助于减轻血管源性水肿降低颅内压。研究发现,甲氨蝶呤相关PRES的发生与脑脊液腺苷生成显著增加相关,氨茶碱作为腺苷受体拮抗剂可有效缓解甲氨蝶呤相关PRES的症状。相关文献报道,当患儿再次接受大剂量甲氨蝶呤或鞘内注射时可再次出现PRES,联合应用氨茶碱可起到预防效果 [14]。大剂量皮质醇类固醇可引起高血压,然而,除非血压不受控制,去除类固醇被证明是不利的 [15]。PRES若能进行早期诊断并及时准确的管理,其预后通常是良性的,一般症状可在出现后数天或数周内恢复。然而,延迟诊断和不当管理可能导致永久性脑损伤,甚至死亡 [16]。因此建议至少两年的临床检测、EEG和MRI随访,以进一步评估PRES的预后 [17]。
4. 结论
早期认识PRES是儿童时期各种疾病和治疗过程中的并发症,可有助于及时准确地诊断和适当地治疗。PRES是一种罕见但通常可逆的并发症,预后良好,尤其是接受急性淋巴细胞白血病治疗的患儿中,排除中枢神经系统出血、中枢神经系统白血病浸润、脑炎等原因导致的类似临床表现后,积极进行相应的治疗。我们应该强调密切检测患有严重神经系统疾病和血压升高的重要性。当检测到血压升高,尤其是出现急性意识改变或抽搐发作的情况下,应高度怀疑PRES。
NOTES
*通讯作者Email: 18753205085@163.com