

1. 引言
酪氨酸酶(tyrosinase, EC1.14.18.1)是一种含铜的金属氧化还原酶 [1],广泛分布于动植物、微生物及人体中,具有单酚酶和二酚酶活性 [2],其活性中心的双核铜离子在酶催化中起重要作用,是黑色素生成的关键酶,抑制其活性可有效阻止黑色素的生成 [3]。近年来,酪氨酸酶抑制剂的开发取得明显进展,美白类产品日趋活跃 [4] [5]。虽已多种酪氨酸酶抑制剂作为美白剂,投入大批量生产,但仍具有某些缺点 [6] [7]。而天然提取物具有多种生物活性、且毒性低,因此已成为国内外开发美白化妆品的研究热点 [8] [9] [10]。
油茶(Camellia oleifera Abel)为山茶科山茶属木本植物,为常绿小乔木,耐贫瘠、适生范围广,被誉为“瘠土明珠”,又因其种子可榨油供食用,故名“油茶”,是我国重要的木本油料作物,与油橄榄、椰子、油棕并称为世界四大木本油料作物 [11] [12] [13]。
虽然我国油茶资源丰富、市场潜力大,但是油茶壳等加工副产物利用率低,高附加值产品少,尚未得到高效利用 [14] [15]。目前,关于油茶壳提取物对酪氨酸酶活抑制的研究较少。基于此,本研究以油茶壳提取物为研究对象,探究油茶壳提取物对酪氨酸酶的抑制作用机理,为油茶壳的高值化利用提供新思路,促进油茶产业的发展。
2. 材料试剂与仪器
2.1. 实验材料
油茶壳:产自浙江衢州,2020年11月采购。
油茶壳提取物:实验室自制。
2.2. 实验试剂
酪氨酸酶(25 KU)、曲酸、L-酪氨酸:上海麦克林生化科技有限公司;PBS:白鲨生物科技有限公司;L-DOPA:上海阿拉丁生化科技股份有限公司;无水乙醇、碳酸钠、亚硝酸钠、硝酸铝、氢氧化钠:均为分析纯,国药集团化学试剂有限公司。
2.3. 实验仪器
DFT-250手提式高速万能粉碎机:温岭林大机械有限公司;40方孔试验标准筛(0.425 mm筛孔):上虞市康南仪器厂;KQ-300DB型数控超声波清洗器:昆山超声仪器有限公司;RE-52AA旋转蒸发器:上海亚荣生化仪器厂;LGJ真空冷冻干燥机:北京松源华兴科技发展有限公司;BS 25 S电子天平:赛多利斯科学仪器(北京)有限公司;HH-S数显恒温水浴锅:常州翔天实验仪器厂;Bio Tek酶标仪:美国伯腾仪器有限公司;WH-861涡旋仪:太仓市华利达实验设备有限公司。
3. 方法
3.1. 油茶壳提取物的制备
参考姜天甲等 [16] 的方法并加以改动,准确称取粉粹过筛的油茶壳20.0 g (精确到0.1 mg),按照1:15 (g/mL)的料液比,加入300 mL 60%体积分数的乙醇溶液,于60℃下超声提取3 h,所得溶液经过4000 r/min离心20 min,取上清液过滤,减压旋蒸除去乙醇,真空冷冻干燥48 h后,得到油茶壳提取物粉末。用时超声溶解至所需浓度溶液。
3.2. 油茶壳提取物对酪氨酸酶单酚酶的抑制作用
参考陈艳梅 [17] 的方法,以L-酪氨酸为底物,以曲酸为阳性对照,测定油茶壳提取物对酪氨酸酶单酚酶的抑制作用。反应体系(700 μL)包含200 μL待测液、200 μL 0.01 mol/L PBS缓冲液(pH = 6.80)、100 μL 100 U/mL酪氨酸酶溶液和200 μL 0.5 mg/mL L-酪氨酸溶液。以37℃恒温条件下单位时间内475 nm下吸光值A475的变化作为单酚酶活性,横轴截距即为单酚酶迟滞时间。以样品浓度(mg/mL)为横坐标,抑制率(%)为纵坐标,绘制曲线,测定酪氨酸酶单酚酶活力抑制率50%时的样品浓度IC50值。
3.3. 油茶壳提取物对酪氨酸酶二酚酶的抑制作用
3.3.1. 油茶壳提取物对二酚酶活性的抑制效果
参考T/SHRH 015-2018的方法加以改动,以L-DOPA为底物,以曲酸为阳性对照,测定油茶壳提取物对酪氨酸酶二酚酶活性的抑制效果。反应体系(700 μL)包含200 μL待测液、200 μL 0.01 mol/L PBS缓冲液(pH = 6.80)、100 μL 100 U/mL酪氨酸酶溶液和200 μL 1 mg/mL L-DOPA溶液。以37℃恒温条件下单位时间内475 nm下吸光值的变化作为二酚酶活性。以样品浓度(mg/mL)为横坐标,抑制率(%)为纵坐标,绘制曲线,测定酪氨酸酶二酚酶活力抑制率50%时的样品浓度IC50值。
3.3.2. 油茶壳提取物对二酚酶的抑制类型
参考朱绮琴等 [18] 的方法加以改动,在700 μL的反应体系中,固定底物L-DOPA浓度为1 mg/mL,改变加入的酪氨酸酶量(50 U/mL、75 U/mL、100 U/mL、125 U/mL、150 U/mL和175 U/mL),测定不同浓度油茶壳提取物(0 mg/mL、0.1 mg/mL、0.2 mg/mL、0.3 mg/mL、0.4 mg/mL和0.5 mg/mL)对二酚酶活力的影响,以酶浓度(mg/mL)为横坐标,以反应速率为纵坐标,作图。
3.3.3. 油茶壳提取物对二酚酶的抑制机理及抑制常数的测定
参考Cui等 [19] 的方法在700 μL的反应体系中,固定酪氨酸酶浓度为100 U/mL,改变底物L-DOPA的浓度(0.167 mg/mL、0.2 mg/mL、0.25 mg/mL、0.333 mg/mL、0.5 mg/mL和1.0 mg/mL(分别为6、5、4、3、2和1的倒数)),测定不同浓度油茶壳提取物(0 mg/mL、0.05 mg/mL、0.1 mg/mL、0.2 mg/mL、0.3 mg/mL、0.4 mg/mL、0.5 mg/mL和0.6 mg/mL)对二酚酶活力的影响,以Lineweaver-Burk双倒数作图,以底物浓度的倒数(1/[S])为横坐标,反应速率的倒数(1/v)为纵坐标,探究油茶壳提取物对二酚酶的抑制机理。通过直线的斜率和纵轴截距对抑制剂浓度二次作图,可计算出抑制剂对游离酶抑制常数KI和对酶–底物络合物抑制常数KIS。
3.4. 油茶壳提取物总多酚含量的测定
参照T/AHFIA 005-2018的方法加以改动,采用Folin-Ciocalteu法,以没食子酸为标准品,测定油茶壳提取物中的总多酚含量。
3.5. 油茶壳提取物黄酮含量的测定
参照SZDB/Z 339-2019的方法加以改动,采用NaNO2-Al(NO3)3-NaOH比色法测定油茶壳提取物中的黄酮含量。
3.6. 统计学方法
各试验重复3次,数值均以
± SD表示;采用Excel 2016进行数据处理;采用SPSS 25.0软件Pearson相关性分析统计检验,**表示相关性极显著(p < 0.01),差异具有统计学意义;采用Origin 2018软件进行绘图。
4. 结果
4.1. 油茶壳提取物对单酚酶抑制作用
在700 μL反应体系中,以L-酪氨酸为底物,以曲酸为阳性对照,探究油茶壳提取物对酪氨酸酶单酚酶的抑制作用。
油茶壳提取物对单酚酶的抑制作用如图1所示。图1(a)显示随着油茶壳提取物浓度逐渐增加,曲线变化趋势明显变缓,表明单酚酶活性逐渐降低,酶活抑制率逐渐增大。图1(b)显示油茶壳提取物浓度对酪氨酸酶单酚酶迟滞时间的影响,可以看到在0.02 mg/mL至0.30 mg/mL的范围内,迟滞时间与抑制剂浓度呈现良好的线性关系,拟合的回归方程为y = 15.93x + 2.33 (R2 = 0.9740)。这表明油茶壳提取物对单酚酶的抑制作用主要是通过降低酶活和增加酶的迟滞时间两种方式来抑制酶促反应。
曲酸对单酚酶的抑制作用如图2所示,可以看到0.08 mg/mL的曲酸作用下的酶促反应曲线趋于水平,对单酚酶的迟滞时间已达27.11 ± 0.02 min,证明曲酸可以显著增加酪氨酸酶单酚酶的迟滞时间。
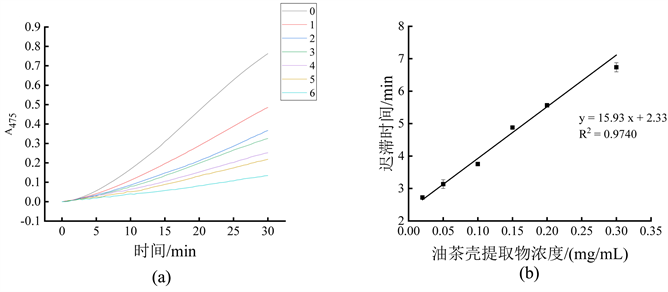 注:图(a)为不同浓度油茶壳提取物对酶促反应吸光值的影响,曲线0~6依次代表油茶壳提取物浓度为0 mg/mL、0.02 mg/mL、0.05 mg/mL、0.10 mg/mL、0.15 mg/mL、0.20 mg/mL和0.30 mg/mL;图(b)为不同浓度油茶壳提取物对单酚酶迟滞时间的影响。
注:图(a)为不同浓度油茶壳提取物对酶促反应吸光值的影响,曲线0~6依次代表油茶壳提取物浓度为0 mg/mL、0.02 mg/mL、0.05 mg/mL、0.10 mg/mL、0.15 mg/mL、0.20 mg/mL和0.30 mg/mL;图(b)为不同浓度油茶壳提取物对单酚酶迟滞时间的影响。
Figure 1. Inhibitory effect of Camellia oleifera shell extract on monophenolase
图1. 油茶壳提取物对单酚酶抑制作用
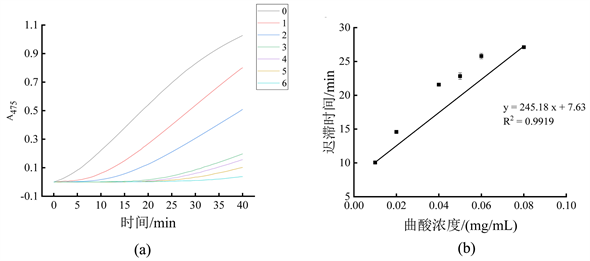 注:图(a)为不同浓度曲酸溶液对酶促反应吸光值的影响,曲线0~6依次代表曲酸浓度为0 mg/mL、0.01 mg/mL、0.02 mg/mL、0.04 mg/mL、0.05 mg/mL、0.06 mg/mL和0.08 mg/mL;图(b)为不同浓度曲酸对单酚酶迟滞时间的影响。
注:图(a)为不同浓度曲酸溶液对酶促反应吸光值的影响,曲线0~6依次代表曲酸浓度为0 mg/mL、0.01 mg/mL、0.02 mg/mL、0.04 mg/mL、0.05 mg/mL、0.06 mg/mL和0.08 mg/mL;图(b)为不同浓度曲酸对单酚酶迟滞时间的影响。
Figure 2. Inhibitory effect of kojic acid on monophenolase
图2. 曲酸对单酚酶抑制作用
表示油茶壳提取物对单酚酶活力抑制效果如图3所示。由图3(a)可知,0.02 mg/mL油茶壳提取物对酪氨酸酶单酚酶活力抑制率达21.05% ± 0.25%,0.10 mg/mL油茶壳提取物对其抑制率已达57.66% ± 0.23%。由图3(b)可知,抑制曲线y = 52.14x + 109.87 (y为酶活抑制率,单位为%;x为以10为底、油茶壳提取物浓度的对数值lg [I],单位为mg/mL;R2 = 0.9959),由该抑制曲线计算出油茶壳提取物对酪氨酸酶单酚酶的IC50为0.0711 mg/mL,说明油茶壳提取物对酪氨酸酶单酚酶具有较好的抑制效果。
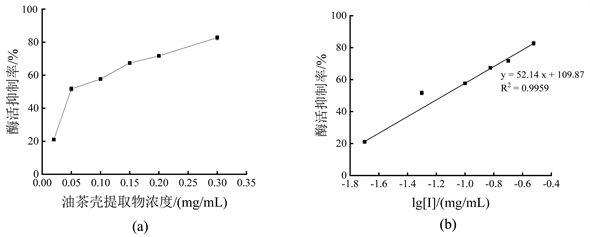 注:图(a)为油茶壳提取物浓度对酶活抑制作用;图(b)为抑制剂浓度取对数后,对酶活抑制作用曲线。
注:图(a)为油茶壳提取物浓度对酶活抑制作用;图(b)为抑制剂浓度取对数后,对酶活抑制作用曲线。
Figure 3. Inhibitory effect of Camellia oleifera shell extract on monophenolase activity
图3. 油茶壳提取物对单酚酶活力的抑制效果
图4表示曲酸对单酚酶活力抑制效果。根据曲酸对单酚酶的抑制曲线y = 89.38x + 187.39 (y为酶活抑制率,单位为%;x为以10为底、曲酸浓度的对数lg [I],单位为mg/mL;R2 = 0.9967),计算出曲酸对酪氨酸酶单酚酶的IC50为0.0290 mg/mL,说明曲酸对酪氨酸酶单酚酶具有很强的抑制作用。
4.2. 油茶壳提取物对二酚酶抑制作用
4.2.1. 油茶壳提取物对二酚酶的IC50
在700 μL反应体系中,以L-DOPA为底物,以曲酸为阳性对照,探究油茶壳提取物对酪氨酸酶二酚酶的抑制作用。
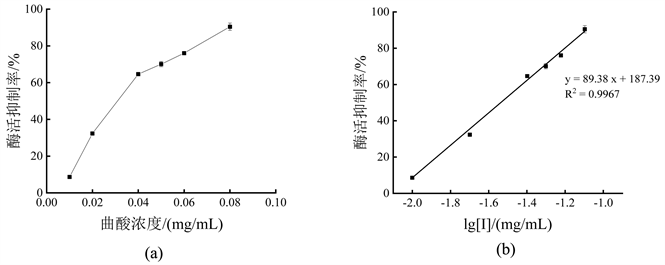 注:图(a)为曲酸浓度对酶活抑制作用;图(b)为抑制剂浓度取对数后,对酶活抑制作用曲线。
注:图(a)为曲酸浓度对酶活抑制作用;图(b)为抑制剂浓度取对数后,对酶活抑制作用曲线。
Figure 4. Inhibitory effect of kojic acid on monophenolase activity
图4. 曲酸对单酚酶活力的抑制效果
油茶壳提取物对酪氨酸酶二酚酶的抑制作用见图5。由图可知,0.05 mg/mL油茶壳提取物对酪氨酸酶二酚酶活力抑制率达31.03% ± 0.26%,0.10 mg/mL油茶壳提取物对其抑制率已达42.80% ± 0.34%,浓度为0.30 mg/mL时,抑制率为52.67% ± 0.50%。进一步绘制油茶壳提取物对二酚酶的抑制曲线为y = 27.41x + 68.03 (y为酶活抑制率,单位为%;x为以10为底、油茶壳浓度的对数值lg [I],单位为mg/mL;R2 = 0.9738),由该抑制曲线计算出油茶壳提取物对酪氨酸酶二酚酶的IC50为0.2199 mg/mL,说明油茶壳提取物对酪氨酸酶二酚酶同样具有较好抑制作用。
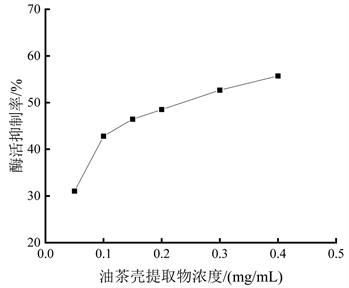
Figure 5. Inhibitory effect of Camellia oleifera shell extract on diphenolase
图5. 油茶壳提取物对二酚酶的抑制作用
4.2.2. 油茶壳提取物对二酚酶的抑制类型
在700 μL的反应体系中,固定底物L-DOPA浓度为1 mg/mL,依次改变油茶壳提取物的浓度,测定不同酪氨酸酶浓度下其二酚酶活力,绘制酶浓度(mg/mL)与反应速率的曲线图。实验结果如图6所示,得到一组斜率不同、均过原点的直线,因此判断油茶壳提取物对酪氨酸酶二酚酶的抑制类型为可逆抑制。
4.2.3. 油茶壳提取物对二酚酶的抑制机理
在确定油茶壳提取物对二酚酶的抑制类型为可逆抑制的基础上,进一步探究抑制机理。在700 μL的反应体系中,固定酪氨酸酶浓度为100 U/mL,改变底物L-DOPA的浓度,测定不同浓度油茶壳提取物对二酚酶活力的影响,采用Lineweaver-Burk双倒数作图法,以底物浓度的倒数(1/[S])为横坐标,反应速率的倒数(1/v)为纵坐标,探究油茶壳提取物对二酚酶的抑制机理。
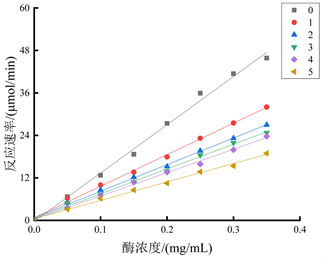 注:直线0~5依次代表油茶壳提取物浓度为0 mg/mL、0.1 mg/mL、0.2 mg/mL、0.3 mg/mL、0.4 mg/mL和0.5 mg/mL。
注:直线0~5依次代表油茶壳提取物浓度为0 mg/mL、0.1 mg/mL、0.2 mg/mL、0.3 mg/mL、0.4 mg/mL和0.5 mg/mL。
Figure 6. Type of inhibition of diphenolase by Camellia oleifera shell extract
图6. 油茶壳提取物对二酚酶的抑制类型
油茶壳提取物对二酚酶的抑制机理如图7所示,不同浓度的抑制剂作用下,得到一组平行直线,这表明油茶壳提取物对酪氨酸酶二酚酶的抑制作用为反竞争性抑制,只能作用于酶–底物络合物,不能作用于游离酶,油茶壳提取物同时影响米氏常数Km与最大反应速度Vmax。
 注:直线0~7依次代表油茶壳浓度为0 mg/mL、0.05 mg/mL、0.1 mg/mL、0.2 mg/mL、0.3 mg/mL、0.4 mg/mL、0.5 mg/mL和0.6 mg/mL。
注:直线0~7依次代表油茶壳浓度为0 mg/mL、0.05 mg/mL、0.1 mg/mL、0.2 mg/mL、0.3 mg/mL、0.4 mg/mL、0.5 mg/mL和0.6 mg/mL。
Figure 7. Inhibitory mechanism of Camellia oleifera shell extract on diphenolase
图7. 油茶壳提取物对二酚酶的抑制机理
以油茶壳提取物浓度为x轴,分别以直线的斜率和纵轴截距为y轴,作图。实验结果如图8所示。由图8(a),不同油茶壳提取物作用下,直线斜率相对稳定,表明油茶壳提取物不能作用于游离酶,因此油茶壳提取物对游离酶结合常数KI为零。由图8(b),得到曲线方程为y = 10.7487x + 2.2973 (R2 = 0.98625),求得油茶壳提取物对酶–底物络合物抑制常数KIS为10.7487 mg/mL。
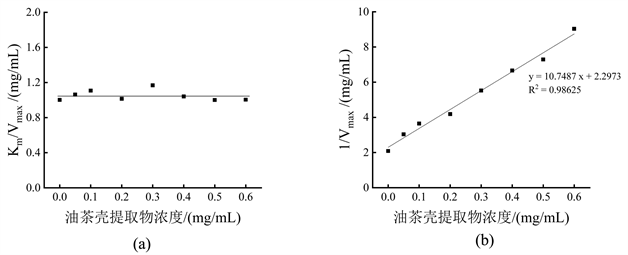 注:图(a)为油茶壳提取物对二酚酶的KI;图(b)为油茶壳提取物对二酚酶的KIS。
注:图(a)为油茶壳提取物对二酚酶的KI;图(b)为油茶壳提取物对二酚酶的KIS。
Figure 8. Inhibition constant of Camellia oleifera shell extract on diphenolase
图8. 油茶壳提取物对二酚酶的抑制常数
油茶壳提取物与曲酸对酪氨酸酶的抑制效果汇总至表1,由表可得,油茶壳提取物与曲酸均为良好的酪氨酸酶抑制剂,油茶壳提取物对酪氨酸酶的抑制机理为反竞争性可逆抑制,曲酸为混合型可逆抑制。

Table 1. Inhibitory effect of different inhibitors on tyrosinase
表1. 不同抑制剂对酪氨酸酶的抑制效果
4.3. 油茶壳提取物总多酚含量
采用Folin-Ciocalteu法测定油茶壳提取物中总多酚含量,以没食子酸计。图9(a)为总多酚标准曲线,拟合的回归方程为y = 8.0527x + 0.0237 (R2 = 0.9984)。根据总多酚标准曲线,计算油茶壳提取物中总多酚含量为30.22% ± 1.02%。
 注:图(a)为总多酚标准曲线(以没食子酸计);图(b)为黄酮标准曲线(以芦丁计)。
注:图(a)为总多酚标准曲线(以没食子酸计);图(b)为黄酮标准曲线(以芦丁计)。
Figure 9. Standard curves of total polyphenols and flavonoids
图9. 总多酚、黄酮标准曲线
4.4. 油茶壳提取物黄酮含量
采用NaNO2-Al(NO3)3-NaOH法测定油茶壳提取物中黄酮含量,以芦丁计。图9(b)为黄酮标准曲线,拟合的回归方程为y = 0.5050x + 0.0030 (R2 = 0.9992)。根据黄酮标准曲线,计算油茶壳提取物中黄酮含量为13.52% ± 0.24%。
采用Pearson相关性分析统计检验,油茶壳提取物对酪氨酸酶活性抑制率与其活性成分的相关性分析结果如表2所示,油茶壳提取物对酪氨酸酶活抑制率与其总多酚、黄酮含量的相关性系数分别为0.850和0.756,表明总多酚、黄酮可能是油茶壳提取物发挥抑制酪氨酸酶活力作用的主要物质。

Table 2. Correlation analysis of Camellia oleifera shell extract tyrosinase activity inhibition rate with active ingredients
表2. 油茶壳提取物酶活抑制率与活性成分的相关性分析
注:**表示相关性极显著(p < 0.01)。
5. 结论
本研究以油茶壳提取物为研究对象,探究油茶壳提取物对酪氨酸酶单酚酶和二酚酶活性的影响。实验结果表明油茶壳提取物对酪氨酸酶单酚酶与二酚酶均具有较好抑制效果,对单酚酶主要是通过降低酶活和增加酶的迟滞时间两种方式来抑制酶促反应,对二酚酶的抑制作用为反竞争性可逆抑制,总多酚、黄酮可能是油茶壳提取物发挥抑制酪氨酸酶活性作用的主要物质。本研究为油茶壳提取物作为天然产物来源的酪氨酸酶抑制剂的开发利用提供了研究思路和理论依据。
基金项目
国家自然科学基金(2016C37013)。