摘要: 目的:运用网络药理学方法,分析扶正抑瘤方治疗原发性肝癌的作用机制。方法:通过TCMSP数据库查询扶正抑瘤方中4味药的有效成分及对应的靶点。通过Genecard数据库收集原发性肝癌的相关靶点,并与药物的靶点进行匹配,获得交集靶点。将交集靶点导入String数据库中绘制蛋白互作图,并通过Cytoscape3.8.2对PPI图进行可视化分析,找出关键靶点。建立Excel表,利用Cytoscape3.8.2及插件Cytohubba筛选出扶正抑瘤方中主要活性成分。通过R软件对关键靶点进行GO分析和KEGG通路富集分析,在Cytoscape3.8.2中绘制药物–靶点–疾病–靶点网络图。结果:共收集到扶正抑瘤方的有效成分14个,相关的靶点694个,疾病靶点8803个,交集靶点184个,从中筛选出Degree值较高的作为蛋白相互作用中的关键靶点共5个(JUN, IL6, AKT1, CXCL8, CDKN1A)。筛选出度值排列在前3位的活性成分,依次是槲皮素、豆甾醇和β-谷甾醇。经过GO分析得到2457个生物学过程,经过KEGG富集分析,得到106条信号通路,包括AGE-RAGE信号通路、PI3K-ART信号通路、MAPK信号通路、IL-17信号通路、TNF信号通路等。讨论:扶正抑瘤方治疗原发性肝癌具有多成分、多靶点,多途径的特点,筛选的关键靶点和主要通路为阐明治疗原发性肝癌的作用机制提供了科学依据。
Abstract:
Objective: To analyze the mechanism of Fuzheng anti-tumor prescription in the treatment of pri-mary hepatocellular carcinoma by network pharmacology method. Methods: The active compo-nents and corresponding targets of four drugs in Fuzheng anti-tumor prescription were queried through TCMSP database. Related targets of primary liver cancer were collected from Genecard da-tabase and matched with drug targets to obtain intersection targets. The intersection targets were imported into the String database to draw the protein interaction map, and the PPI map was visu-alized and analyzed by Cytoscape3.8.2 to identify the key targets. Build Excel table, Cytoscape3.8.2 and Cytohubba were used to screen out the main active ingredients in Fuzheng anti-tumor pre-scription. GO analysis and KEGG pathway enrichment analysis of key targets were performed by R software, and drug-target-disease-target network map was drawn in Cytoscape3.8.2. Results: A total of 14 active components, 694 related targets, 8803 disease targets, and 184 intersection targets were collected. Among them, 5 key targets (JUN, IL6, AKT1, CXCL8, CDKN1A) with higher degree were selected as the key targets in protein interaction. The top 3 active ingredients were quercetin, stigmasterol and β-sitosterol. After GO analysis, 2457 biological processes were obtained, and after KEGG enrichment analysis, 106 signaling pathways were obtained, including AGE-RAGE signaling pathway, PI3K-ART signaling pathway, MAPK signaling pathway, IL-17 signaling pathway, TNF sig-naling pathway, etc. Conclusion: Fuzheng anti-tumor prescription has the characteristics of mul-ti-component, multi-target and multi-pathway in the treatment of primary liver cancer. The key targets and main pathways screened provide a scientific basis for elucidating the mechanism of ac-tion in the treatment of primary liver cancer.
1. 引言
原发性肝癌是目前我国常见恶性肿瘤之一。原发性肝癌是一种恶性程度极高、预后较差的恶性疾病。世界卫生组织下属国际癌症研究机构(International Agency for Research on Cancer, IARC)最新研究数据显示,2020年,中国新发癌症病例数已经超过了世界其他国家,其中,肝癌的新发病例数达到了41万,排在第5位。原发性肝癌发病率居恶性肿瘤第6位,新增90.6万例,死亡率居第3位,仅仅低于肺癌和胃癌,共计83万例。近5年全球原发性肝癌平均年发病例数为99.5万例,亚洲73.2万例,占全球73.6%,中国42.3万例,占全球42.5% [1] [2]。原发性肝癌起病隐匿,危害程度大,很多人发现肝癌时已经到了中晚期,而在临床上,对于中晚期肝癌患者的治疗方式往往只有放疗、化疗和手术等,预后较差。这些治疗方式对于疾病的缓解虽然有效,但同时也会使患者产生耐药性,并带来较多的毒副反应,例如降低免疫力,降低生存质量和增加疾病负担等 [3] [4]。近年来,中药治疗肝癌开始越来越受到人们的重视。相比西药来说,中药具有毒性小的特点。对于肝癌患者来说,中药可补血填精,促进造血功能的恢复;可益气固本,提高患者的免疫功能;可和胃降逆,减少胃肠反应,提高患者的生存质量 [5] [6]。
随着医学的发展,人们对于疾病的治疗思维开始由过去的单一因素作用转变为多种药物、多成分、多靶点以及多种途径共同作用的治疗方式,基于这种思维方式,网络药理学也开始逐渐兴起。而中药中多成分共同作用方式与网络药理学方法契合。相关临床研究表明:扶正抑瘤方对于肝癌的治疗具有有效作用。基于上述研究,本文对于扶正抑瘤方治疗原发性肝癌的作用机制进行探讨。
2. 材料和方法
2.1. 预测扶正抑瘤方的有效化学成分和靶点
中药系统药理学数据库与分析平台(Traditional Chinese Medicine System Pharmacological Database and Analysis Platform, TCMSP)是中药网络药理学常用的数据库之一 [7]。在TCMSP中将“红芪”、“当归”、“莪术”、“墓头回”作为关键词依次输入,查询收集四味药物的成分,由于人体的吸收、代谢和排泄等都会对药物的作用产生一定影响,所以参考药代动力学参数(ADME),将口服生物利用度(Oralbioavailability, OB) ³ 30%和类药性(Drug-like, DL) ³ 0.18作为限定条件 [8],筛选出活性较高的化合物即作为扶正抑瘤方的有效成分。在TCMSP数据库收集的有效成分界面点击“Related Targets”即可得到扶正抑瘤方有效成分作用的相关靶点,并在Uniprot数据库中查找收集药物靶点所对应的基因名称。
2.2. 获取疾病的相关靶点
在Genecards数据库中,以“primary hepatic carcinoma”作为关键词检索原发性肝癌的作用靶点,删去重复项,得到原发性肝癌相关疾病的靶点基因。
2.3. 交集靶点的获取
利用Venn2.1软件进行韦恩图的绘制,在List1中输入药物的靶点所对应的基因名称,List2中输入原发性肝癌的相关靶点基因,得到药物与疾病的共同作用靶点。
2.4. 通过扶正抑瘤方“活性成分–靶点”网络筛选关键活性成分
扶正抑瘤方“活性成分–靶点”网络主要通过软件Cytoscape3.8.2进行构建和分析。将检索到的药物活性成分和药物与疾病的共同作用靶点制成Excel表格,导入到Cytoscape3.8.2软件中完成相关网络构建,图中以“节点”表示药物的有效成分和相关基因,用“边”表示两者之间的关系。采用Cytohubba插件进行网络特征分析,筛选其中较为重要的活性成分。在得到的网络图中,成分或基因所在圆圈颜色越深,Degree值越大,该活性成分越重要。
2.5. 构建靶点蛋白互作图
在String数据库(https://string-db.org/)中导入整合得到的扶正抑瘤方的交集靶点,物种选择“Home sapiens”,可信值设置为0.98,得到蛋白质相互作用关系的网络图,在setting中将网络图调整合适后,以TSV格式导出。在已知的相互作用下,蓝色的线表示从策划数据库中得到的蛋白质的相互作用,而紫色的线表示经过实验获得的蛋白质之间的相互作用。将获得的TSV文件导入Cytoscape3.8.2中作可视化分析,按照Degree大小,从中找出核心靶点。
2.6. GO功能分析与KEGG通路富集分析
在R软件中导入获得的交集基因,要求P < 0.05,得到GO功能分析与KEGG通路富集分析图。GO功能分析可从细胞成分(components of cells, CC),生物学过程(biological process, BP)和分子功能(Molecular function, MF)三个方面进行分析。由于GO分析和KEGG分析的富集结果较多,所以选择排在前20的富集结果进行分析,最终以条形图和气泡图的方式呈现。
2.7. 构建成分–靶点–疾病–通路网络
在Cytoscape3.8.2软件中导入药物有效成分、药物和疾病所对应靶点以及KEGG通路信息,构建成分–靶点–疾病–通路网络。通过layout调整图形,通过style调整有效成分、靶点和通路的颜色、形状和大小。图中节点代表有效成分、靶点和通路,边表示节点与节点相互作用的关系,而度值则表示在网络中该节点与其它节点之间的连接数。
3. 结果
3.1. 扶正抑瘤方有效成分的筛选和靶点预测
通过TCMSP数据库,得到扶正抑瘤方的药物成分共280个,将这280个成分按照口服生物利用度OB ³ 30%和类药性DL ³ 0.18的限定标准进行筛选,得到药物有效成分20个,由于MOL004644、MOL000906和MOL000940这3个成分没有对应的靶点,故剔除,再排除重复的3个成分,最终得到14个有效成分,如表1所示。在Related targets中查询扶正抑瘤方有效成分的相关作用靶点共694个,并在Uniprot中将蛋白名称转换为基因名。

Table 1. Active ingredients of Fuzheng anti-tumor prescription
表1. 扶正抑瘤方有效活性成分
3.2. 收集原发性肝癌相关靶点和交集靶点
在Genecard数据库中以“primary hepatic carcinoma”为关键词,查询原发性肝癌的相关靶点,整理后共8803个。将扶正抑瘤方有效成分作用靶点与原发性肝癌相关靶点进行匹配,绘制韦恩图,如图1,得到184个扶正抑瘤方治疗原发性肝癌的潜在作用靶点。
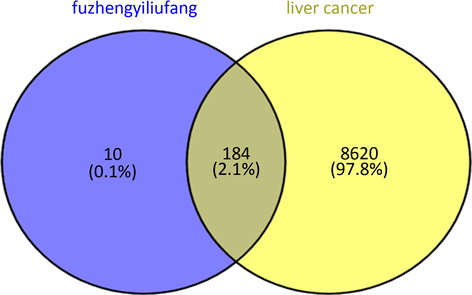
Figure 1. Intersection targets of Fuzheng anti-tumor prescription and primary liver cancer
图1. 扶正抑瘤方与原发性肝癌的交集靶点

Figure 2. Component-target-disease-pathway network diagram
图2. 成分–靶点–疾病–通路网络图
3.3. 成分–靶点–疾病–通路网络(Component-Target-Disease-Pathway Network Diagram)
将收集到的扶正抑瘤方的有效成分、预测的靶点、疾病的靶点和KEGG通路进行整理,导入到Cytoscape3.8.2中,得到成分–靶点–疾病–通路网络图,如图2。该网络中,包含221个节点,2064条边,其中扶正抑瘤方的活性成分14个,KEGG通路20条。
3.4. 筛选关键活性成分
根据网络分析结果,预测槲皮素(MOL000098, Degree = 272)、豆甾醇(MOL000449, Degree = 52)和β-谷甾醇(MOL000358, Degree = 52) 3种活性成分为扶正抑瘤方中发挥作用的主要成分,其次为柚皮素(MOL004328, Degree = 31)、刺芒柄花素(MOL000392, Degree = 28)和维斯体素(MOL000500, Degree = 22),如图3。
3.5. 构建蛋白互作网络图
将收集到的184个潜在作用靶点导入到String软件中绘制蛋白网络互作图,将物种设置为人类(Homo sapiens),可信值设置为0.98,得到该PPI图中共有184个节点,131条边,平均度值为1.42,如图4。将得到的TSV格式文件导入Cytoscape3.8.2中,对PPI图中靶点进行可视化分析,如图5。按照Degree值大于2.84的标准选出扶正抑瘤方的靶点37个,取前5个进行分析,分别是JUN (转录因子,degree = 11),IL-6 (白细胞介素6,degree = 10),AKT-1 (丝氨酸/苏氨酸蛋白激酶1,degree = 10),CXCL-8 (雌激素硫酸转移酶抗体8,degree = 8),CDKN1A (细胞周期蛋白依赖性激酶抑制剂1A,degree = 8)。这5个靶点在原发性肝癌的治疗中具有重要意义。
3.6. GO功能分析与KEGG通路富集分析
将扶正抑瘤方的有效成分作用靶点和原发性肝癌作用靶点取交集后获得的184个潜在作用靶点导入到R软件中,按照P < 0.05的条件,将富集程度排在前20的筛选出作GO分析和KEGG分析,得到184个作用靶点参与了2456个生物学过程和106条KEGG信号通路。
通过GO分析可得,细胞成分89个,主要富集在薄膜筏、膜微结构域、膜区、转录、囊腔、核染色质、胞质囊腔、质膜筏、分泌颗粒内腔和小凹,如图6。细胞生物学过程2207个,主要是对营养水平的反应、对脂多糖的反应、对细菌源分子的反应、对类固醇激素的反应、对氧气水平的反应、抗氧化反应、对金属离子的响应、对抗生素的反应、对缺氧的反应和对氧水平下降的反应,如图7。分子功能160个,主要参与DNA结合转录激活因子活性,RNA聚合酶II特异性、受体配体活动、细胞因子受体结合、细胞因子活性、酰胺绑定、泛素样蛋白连接酶结合、磷酸酶绑定、核受体的活动、转录因子活性,直接配体调控序列特异性DNA结合和血红素结合部位,如图8。
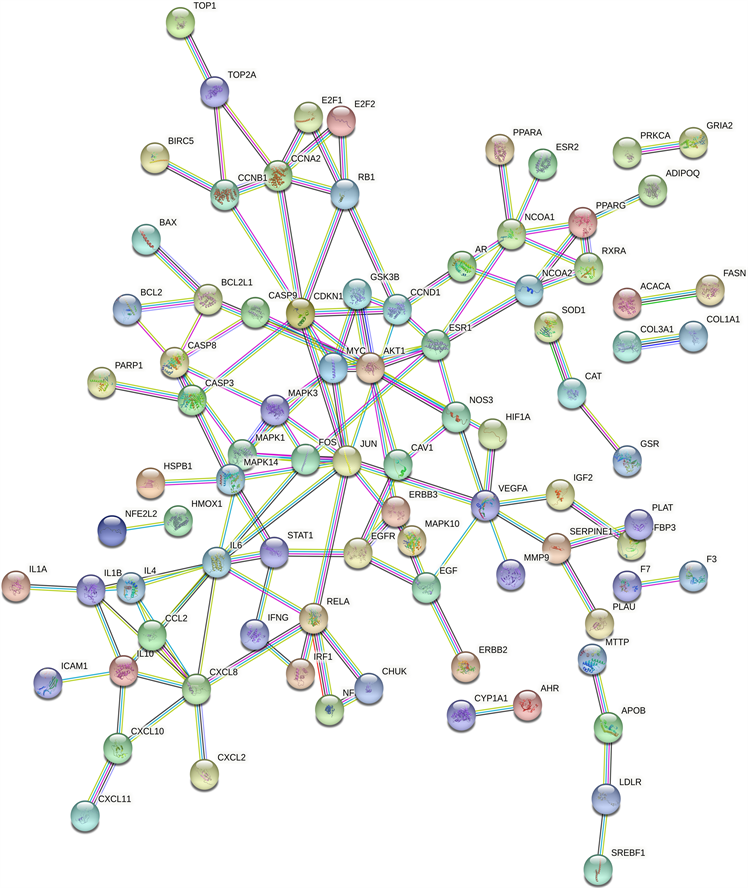
Figure 4. Protein interaction network diagram (PPI diagram)
图4. 蛋白相互作用网络图(PPI图)
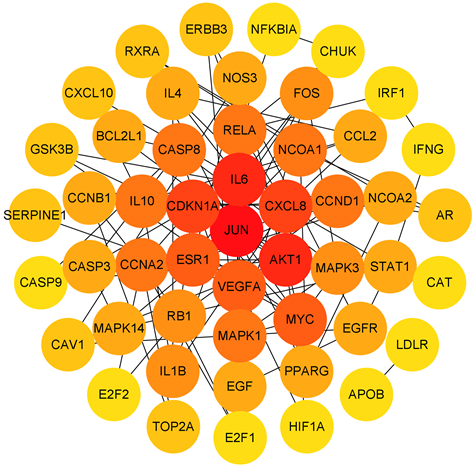
Figure 5. Visualization of the PPI plot
图5. PPI图的可视化
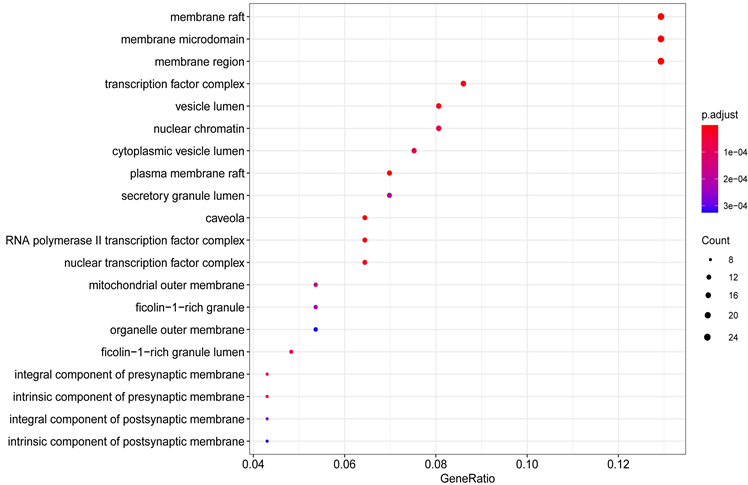
Figure 6. GO Analysis CC diagram of Fuzheng anti-tumor prescription in the treatment of primary liver cancer (top 20)
图6. 扶正抑瘤方治疗原发性肝癌的GO分析CC图(前20位)

Figure 7. GO analysis BP diagram of Fuzheng anti-tumor prescription in the treatment of primary liver cancer (top 20)
图7. 扶正抑瘤方治疗原发性肝癌的GO分析BP图(前20位)
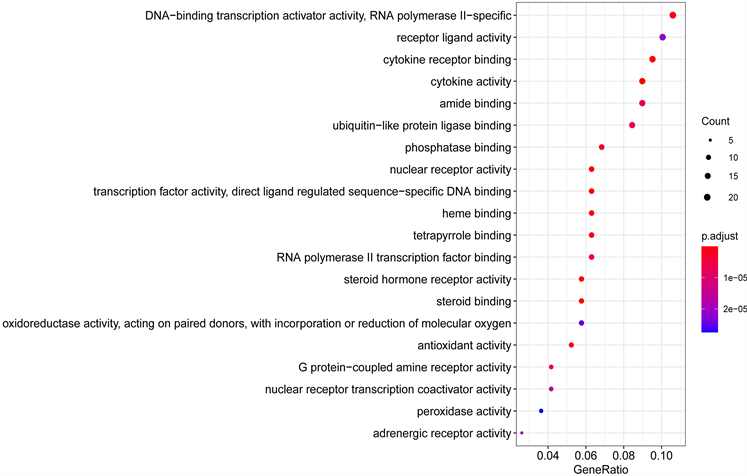
Figure 8. MF figure of GO analysis of Fuzheng anti-tumor prescription in the treatment of primary liver cancer (top 20)
图8. 扶正抑瘤方治疗原发性肝癌的GO分析MF图(前20位)
KEGG通路分析结果显示:扶正抑瘤方对原发性肝癌起作用的主要通路是糖尿病并发症的AGE-RAGE信号通路、PI3K-AKT信号通路、MAPK信号通路、IL-17信号通路、TNF信号通路、细胞衰老、内分泌的阻力、HIF-1信号通路、松弛素信号通路和细胞凋亡等,如图9。
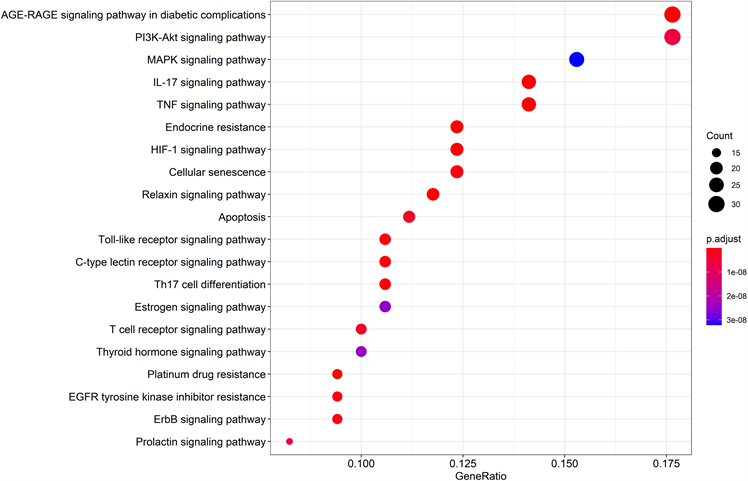
Figure 9. KEGG pathway enrichment diagram of Fuzheng anti-tumor prescription in the treatment of primary liver cancer (top 20)
图9. 扶正抑瘤方治疗原发性肝癌的KEGG通路富集图(前20位)
4. 讨论
肝癌在中医学中归属于“癥瘕、积证、臌胀、肥气”等范畴 [9]。原发性肝癌的发病机制目前尚不明确,可能与多种因素的综合作用有关,目前认为与肝硬化,病毒性肝炎,黄曲霉素,寄生虫病以及环境和遗传因素密切相关。在中医的角度,王文志等人提出肝癌的发生常受机体内外因素共同影响,内因常为肝郁气滞,邪毒积聚,气滞郁结,而外因则常为饮食不洁,情志所伤,邪气侵入,内外因共同作用,导致肝癌的发生 [10]。因此对于肝癌的治疗重在疏肝理气,清热解毒,活血化瘀,调整饮食,愉悦心情。扶正抑瘤方是由甘肃省名老中医赵健雄教授根据多年经验研制,主要包含红芪、当归、莪术和墓头回4味中药 [11]。其中红芪具有补气升阳,固表止汗,利水消肿,生津养血,行滞通痹,脱毒排脓,敛疮生肌的功效 [12],临床上常用来治疗气虚的乏力、食少、便溏以及便血。另外经过现代医学证明,还可有免疫促进、延缓衰老的作用;莪术可行气止痛,破血祛瘀,临床常用来治疗经闭、痛经、胸痛 [13];墓头回可清热解毒,收敛止血 [14],临床上常用来抗肿瘤,治疗失眠;当归可养血和血,补血止痛 [15],临床上常用当归治疗月经不调、经闭痛经和跌打损伤等病症。4味药共同作用于机体,起到扶正祛邪,标本兼治的作用,对原发性肝癌患者的治疗可具有良好效用。
本研究通过网络药理学的方法对扶正抑瘤方中的抗癌作用进行分析,筛选出了扶正抑瘤方有效活性成分14个,潜在药物靶点184个,生物学过程2456个,共涉及106条通路。网络分析发现扶正抑瘤方可能作用于JUN、IL-6、AKT1、CXCL8、CDKN1A等核心靶点,主要活性成分为槲皮素、豆甾醇和β-谷甾醇等,糖尿病并发症的年龄–年龄信号通路和PI3K-ART信号通路等关键通路发挥抗原发性肝癌的作用。研究通过网络的方式表现出了药物、靶点、基因和疾病之间的复杂关系,为进一步探寻原发性肝癌的治疗方式提供了思路。
网络分析结果显示扶正抑瘤方治疗原发性肝癌的主要化合物是槲皮素、豆甾醇和β-谷甾醇。有许多研究表明槲皮素具有良好的抗肿瘤活性,而其发挥抗肿瘤作用主要是通过抑制肿瘤细胞的生长增殖、诱导肿瘤细胞的凋亡机制和抑制肿瘤细胞的侵袭转移等机制完成。槲皮素抑制肿瘤细胞的增殖常常通过阻滞细胞正常生长所要经过的G1/S期和G2/M期实现,当这两个关键调控点受到阻滞,细胞将无法在细胞周期内进行正常的有丝分裂与增殖 [16]。相关研究也发现槲皮素浓度越高、作用时间越长,对肿瘤细胞的抑制作用也越强 [17] [18]。有研究表明槲皮素可以通过抑制Bcl-2等抗凋亡蛋白,剂量依赖性地降低Hela细胞的活力,以及降低促凋亡蛋白和抗凋亡蛋白的比例促进肿瘤细胞的凋亡 [19]。此外,槲皮素高效低毒的特点也使得它具有更大的开发潜能。尽管目前对于描述豆甾醇抗肿瘤作用的文献较少,但仍可了解到豆甾醇对多种肿瘤细胞均具有肿瘤抑制作用,例如人肝癌细胞、胃癌细胞、肝管癌细胞等。与槲皮素一样,豆甾醇也主要是通过阻滞细胞周期、调控细胞凋亡和破坏肿瘤血管生成等机制发挥其抗肿瘤作用。张硕等 [20] 的研究发现白花蛇舌草中豆甾醇可通过增加G0/G1期细胞比例,降低G2/M期细胞比例,促进肝癌细胞的凋亡。有研究表明,β-谷甾醇可促进Bax蛋白表达,同时降低Bcl-2蛋白表达并活化Bid,即通过调节线粒体的功能来调节细胞凋亡,发挥抗肿瘤作用 [21]。李庆勇等 [22] 的研究发现,β-谷甾醇、豆甾醇对人肝癌细胞SMMC-7721具有明显的增殖抑制作用。
根据筛选出来的核心靶点的Degree参数得知扶正抑瘤方主要通过JUN、IL-6、AKT1、CXCL8、和CDKN1A等靶点治疗原发性肝癌。JUN是一种致癌转录因子,通常说JUN常指c-JUN,c-JUN和c-FOS共同组成AP-1,常在在RAS蛋白参与下,通过MAPK途径被激活 [23]。在结直肠癌等多项肿瘤研究中,当对c-JUN对糖基转移酶β3GnT8的调控过程进行干扰时,HG-CD147糖蛋白糖基化水平也会受到影响,最终可抑制癌细胞的增殖 [24]。IL-6是白细胞介素家族的一员,是一类具有多效活性的细胞因子,参与多种细胞的生长分化,在多种疾病的炎性反应和免疫学过程中也发挥着重要的作用。IL-6在体内的含量过多或过少都会影响疾病的发生发展。对于原发性肝癌患者来说,肝细胞往往是受损状态,此时肝脏不能完全清除IL-6,机体的廓清作用便会减弱,导致体内的IL-6增加,从而影响疾病的发生发展。相关研究表明:IL-6/STAT3信号通路会影响肝癌发展。例如鳖甲煎丸通过下调Bcl-2,上调Bax基因表达,并抑制IL-6/Stat信号通路,发挥其抗肿瘤作用 [25]。同时,有研究证实多种癌症细胞均可产生IL-6,而其含量主要与所患疾病的预后有关 [26]。AKT1是AKT家族(丝氨酸/苏氨酸蛋白激酶)的一个亚型,该家族的不同亚型(AKT1, AKT2, AKT3)在调节细胞增殖、转移和迁徙均表现出不同甚至相反的作用 [27]。CXCL8即雌激素硫酸转移酶抗体,它是一类趋化因子,由PBMCs或PMNs产生。当与受体CXCR1和CXCR2结合以后可以使中性粒细胞趋向肿瘤炎性组织,使得肿瘤环境恶化。因此。可以通过阻断CXCL8与CXCR1、CXCR2的结合,改善肿瘤环境 [28]。临床上常用的风湿药“艾拉莫德”就是通过降低CXCL8的浓度来降低肝癌细胞的增殖转移 [29]。CDKN1A是细胞周期蛋白依赖性激酶抑制剂。CDKN1A基因的表达状态会影响卵巢癌、鼻咽癌、前列腺癌等的发生发展,但其表达常受抑癌蛋白p53的控制 [30]。
GO功能分析显示,扶正抑瘤方的潜在作用靶点在生物进程中主要涉及对营养水平和对氧气等的反应和在细胞成分中的细胞膜、细胞质和囊腔,以及在分子功能的DNA结合转录激活因子活性,RNA聚合酶II特异性、受体配体活动。因此,对于原发性肝癌的治疗可基于这些生物过程进行。KEGG富集分析显示,扶正抑瘤方治疗原发性肝癌的多条通路都与肿瘤密切相关,如PI3K-AKT信号通路、MAPK信号通路、IL-17信号通路、TNF信号通路等。PI3K/AKT信号通路在肝细胞癌增殖、存活和迁移方面比较重要,已经被证明在肝细胞癌中频繁失衡。作为PI3K/AKT信号通路下游的一个调控因子,当AKT失活时,PI3K/AKT信号通路活化就会受到抑制,AKT无法通过PI3K活化作用生成P-AKT,从而抑制细胞增殖,促进细胞凋亡,最终达到抑制肿瘤发生发展的效果。相关研究证实,AKT1在HCC中表达水平较高,在发生发展过程中起促癌作用,当沉默AKT1的表达就能抑制肝癌细胞的增殖及迁移 [31] [32]。此外许多研究也证实AKT1基因多态性与原发性肝癌的发生可能有密切的关系。MAPK可以将细胞外的信号传导至细胞内,去参与细胞增殖、分化和凋亡,调节细胞周期等。MAPK信号通路目前包含4条通路,包括ERK1/2通路、JNK/SAPK通路、p38 MAPK通路和ERK5/BMK通路,而这几条通路拥有不同功能,例如其中JNK/SAPK通路主要参与细胞对物理因素(辐射,温度变化,渗透压)等的应激,而p38 MAPK通路更多参与炎症、细胞分化、细胞凋亡和调整细胞周期等,因此成为了许多抗炎药物研发的靶位 [33] [34]。因此,在原发性肝癌的发生过程中,MAPK通路起着重要的调控作用。有关走马胎活性组分对肝癌HepG2细胞DUSPs/MAPK信号通路影响的研究,就是通过降低MAPK磷酸化水平,进而抑制肝癌的发生发展 [35]。IL-17信号通路,IL-17是Th17细胞产生的功能性因子,通过由IL-17与受体IL-17R组成的异二聚体受体复合物发出信号,激活NF-κB、MAPKs和C/EBPs等下游通路,诱导细胞因子和趋化因子的表达 [36]。过程中的ACT1被认为是IL-17信号传导的主要介质。在多项研究中IL-17已被证明与肿瘤的形成、生长和转移密切相关,但是并不能确定IL-17对肿瘤产生促进还是抑制的作用,这与肿瘤微环境有关 [37]。
综上,本研究通过运用网络药理学的方法,获得了扶正抑瘤方的有效成分,收集了扶正抑瘤方治疗原发性肝癌的潜在作用靶点和相关通路,构建了成分–靶点–疾病–通路网络,直观地描述了其相互作用关系,为后期原发性肝癌的治疗以及临床药物的研制提供了思路。但是因为本方所含药物较少,加之墓头回、莪术和当归3味药物筛选出来的有效成分较少,可能会对结果有所影响。另外,由于本项研究数据均是在数据库中获得,便无法全面考虑临床中药物应用情况。因此,本研究应建立实验进行进一步研究。