1. 引言
卵巢肿瘤(Ovarian Neoplasms)是一种常见的女性生殖系统肿瘤,其发病率居女性生殖系统肿瘤第3位,且发病率有逐年增高的趋势,其病死率居于女性生殖系统肿瘤首位,浆液性卵巢癌为卵巢恶性肿瘤最常见的病理类型。卵巢癌的临床表现多样,发病隐匿性较高,多数患者就诊时往往已经发展至临床晚期并多伴有转移 [1] 。虽然随着医学技术的发展,手术技术的提高及铂/紫杉醇一线化疗药物的应用,卵巢癌的治疗效果已大大改善,但晚期卵巢癌患者预后仍较差,5年生存率仅为47% [2] [3] 。本文针对III期高级别浆液性卵巢癌患者的不同转移路径进行比较,分析不同的转移路径对卵巢癌预后的影响。
2. 资料与方法
2.1. 一般资料
回顾性统计2000~2020年期间就诊于青岛大学附属医院经手术及术后病理确诊为的III期高级别浆液性卵巢癌患者的临床数据。为排除临床阴性但病理阳性的淋巴结转移病例对结果的影响,本研究仅选取清扫淋巴结者进行研究 [4] 。纳入标准:1) 经肿瘤细胞减灭术并接受淋巴结清扫及以铂类为基础的化疗治疗的 FIGO III期卵巢癌患者;2) 所有患者的病理类型均经术后病理证实为高级别浆液性卵巢癌。排除标准:1) FIGO I-II期及IV期上皮性卵巢癌患者;2) 除浆液性卵巢癌外的其他上皮类型卵巢癌患者;3) 合并其他恶性肿瘤患者;4) 临床资料不完整患者;5) 失访者。共535例患者中单纯腹腔种植转移者226例(42.24%),单纯淋巴结转移者54例(10.09%),两种转移均发生者255例(47.66%)。因国际妇产科联盟(FIGO)提出的分期中未将两种转移均发生者及单纯腹腔种植转移者分开讨论,因此本文将其归为一组,根据转移路径分为单纯淋巴结转移组54例与腹膜转移组481例。
2.2. 治疗方法
所有患者均接受了手术治疗,即肿瘤细胞减灭术,其中达到满意减灭(残余病灶 < 1 cm)的400例,不满意减灭(残余病灶 ≥ 1 cm)的135例。术后均接受以铂类药物为基础的化学药物治疗,治疗完全结束并达到临床缓解后6个月以上复发者为临床铂敏感型,治疗完全结束并达到临床缓解后6个月以内复发者为临床铂耐药型 [5] [6] [7] [8] 。其中临床铂敏感型为404例,临床铂耐药型为131例。
2.3. 随访观察
出现以下情况中的2个或2个以上时,考虑患者卵巢癌复发:①血清CA125水平异常升高;②出现腹腔液及(或)胸腔积液;③妇科检查发现肿块;④影像学检查发现复发病灶;⑤出现不明原因的肠梗阻 [9] 。复发者有297例,未复发者有238例。
2.4. 统计学方法
回顾性病例资料研究,临床病理资料均从His系统、联众数字医学系统或医渡云数据库中提取。采用SPSS26.0统计软件进行数据分析,应用卡方检验及Wilcoxon秩和检验分析患者临床病理特征、化疗敏感或耐药、复发率、生存率等临床因素与患者不同转移路径之间的关系,观察各临床因素对患者预后的影响。以首次治疗时间至复发时间之间定义为无进展生存期(Progression Free Survival, PFS)。以首次治疗时间至死亡时间或随访截至日期之间定义为总生存期(Overall Survival, OS)。总随访时间为入组时间至死亡时间或随访截至时间。将死亡定义为事件发生,存活或随访结束为删失(Censoring) [10] 。采用Kaplan-Meier法绘制生存曲线,并采用对数秩检验(Log-rank test)对上述不同临床病理特征间的生存差异进行检验,多因素生存分析采用Cox比例风险回归模型,以P < 0.05为差异具有统计学意义。
3. 结果
3.1. 不同转移路径之间临床病理特征的差异
统计符合纳入标准的III期高级别浆液性卵巢癌患者的临床数据。随访至2020年12月31日,随访期间,共有535例患者符合纳入标准。其中腹膜转移组481人(89.91%),单纯淋巴结转移组54人(10.09%),比较两组患者临床病理特征的差异。如表1所示:

Table 1. Differences in clinicopathological features of different metastasis modes
表1. 不同转移方式临床病理特征的差异
用卡方检验及Wilcoxon秩和检验分析不同转移路径与多个临床病理特征之间的关系。统计两组患者未行治疗前化验得到的血清初始CA125水平,其中单纯腹膜转移组54例,腹膜转移组478例,治疗前未行CA125检测者3例。根据正态性检验结果可知两组数据不服从正态分布,采用Wilcoxon秩和检验分析腹膜转移组的治疗前初始CA125水平的中位数为878.15 U/mL,单纯淋巴结转移组的治疗前初始CA125水平的中位数为581.00 U/mL。统计两组患者血清初始HE4水平,其中单纯腹膜转移组33例,腹膜转移组314例,治疗前未行HE4检测者188例。腹膜转移组的治疗前初始HE4水平的中位数为512.80 U/mL,单纯淋巴结转移组的治疗前初始HE4水平的中位数为198.90 U/mL,即单纯淋巴结转移组的治疗前初始CA125水平及初始HE4水平较腹膜转移组更低,两组间差异均有统计学意义(P < 0.05)。腹膜转移组接受新辅助化疗的比率为60.08%,单纯淋巴结转移组接受新辅助化疗的比率为29.63%,两组间差异有统计学意义(P < 0.05)。不同转移路径的年龄、总化疗次数及手术满意度的临床病理特征比较,差异均无统计学意义(P > 0.05)。
3.2. 不同转移路径的化疗敏感性与复发率
以治疗完全结束并达到临床缓解后6个月以上是否复发为标准,将病例资料分为化疗敏感组与化疗耐药组,采用卡方检验的方法,比较不同转移路径之间化疗敏感性有显著差异(P = 0.038),单纯淋巴结转移组的化疗敏感率(86.79%)较腹膜转移组的化疗敏感率(74.22%)更高,对化疗更敏感。根据卵巢癌复发的标准,将病例资料分为复发组和未复发组,采用卡方检验的方法,比较不同转移路径之间复发率有显著差异(P = 0.004),腹膜转移组的复发率为56.75%;单纯淋巴结转移组的复发率为37.03%,即单纯淋巴结转移组较腹膜转移组复发率更低。如表2所示。

Table 2. Chemotherapeutic sensitivity and recurrence rate in different metastatic modes
表2. 不同转移路径的化疗敏感性与复发率
3.3. 不同转移路径的生存分析比较
采用Kaplan Meier生存分析曲线估计不同转移路径患者的总生存率、无进展生存率及5年生存率,进一步比较不同转移路径患者的生存时间的差异,结果总结如表3所示:

Table 3. Comparison of survival time of different transfer modes
表3. 不同转移路径的生存时间比较
不同转移路径的无进展生存率与总生存率之间差异均有统计学意义(P < 0.05)。单纯淋巴结转移组无进展生存率为55.9%,大于腹膜转移组的无进展生存率26.5%,两者的中位无进展生存时间分别为20个月与17个月;单纯淋巴结转移组的总生存率为48.9%,大于腹膜转移组的总生存率11.8%,两者的中位总生存时间分别为77个月与51个月。而单纯淋巴结转移组的5年总生存率为56.5%,腹膜转移组的5年总生存率为33.6%,两者的中位5年总生存时间分别为43个月与38个月,两者间差异无统计学意义(P = 0.089),但单纯淋巴结转移组5年总生存率较腹膜转移组高,可见单纯淋巴结转移组较腹膜转移组生存率更高,预后更好。Kaplan Meier生存曲线见图1~3所示:

Figure 1. Progression-free survival curves for ovarian cancer patients with different metastatic pathways (Kaplan Meier)
图1. 不同转移路径的卵巢癌患者无进展生存曲线(Kaplan Meier)
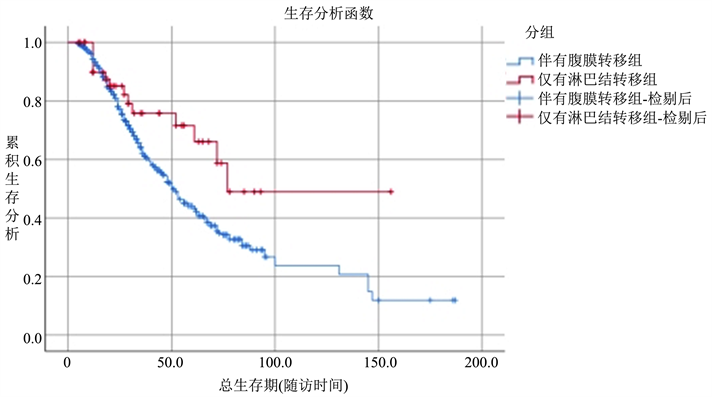
Figure 2. Overall survival curves for ovarian cancer patients with different metastatic pathways (Kaplan Meier)
图2. 不同转移路径的卵巢癌患者总生存曲线(Kaplan Meier)

Figure 3. 5-year overall survival curves for ovarian cancer patients with different metastatic pathways (Kaplan Meier)
图3. 不同转移路径的卵巢癌患者5年总生存曲线(Kaplan Meier)
不同的转移路径是III期高级别浆液性卵巢癌患者预后的影响因素,将其他可能影响预后的因素构建COX比例风险回归模型,进一步行生存分析。
应用:ROC曲线(受试者工作特征曲线)分析,按照约登指数最大法(约登指数 = 敏感度 + 特异度 − 1)计算出Cut-off值,将回归模型中初始CA125水平及初始HE4水平按Cut-off值进行分组,转化为分类变量,如图4和图5所示:

Figure 4. Initial CA125 level ROC curve
图4. 初始CA125水平ROC曲线
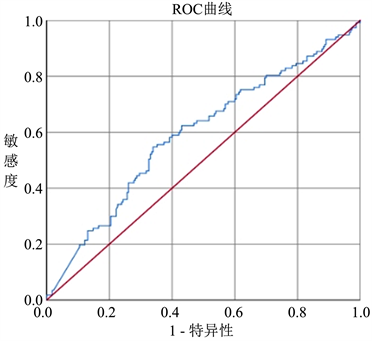
Figure 5. Initial HE4 level ROC curve
图5. 初始HE4水平ROC曲线
初始:CA125水平的ROC曲线的Cut-off值为861.5 U/ml,曲线下面积(AUC)为0.570,敏感度56.0%,特异度55.1%,P = 0.006,95%的置信区间为0.521~0.618。根据Cut-off值将初始CA125水平分为≥5861.5 U/ml组及<861.5 U/ml组。初始HE4水平的ROC曲线的Cut-off值为587.9 U/ml,曲线下面积(AUC)为0.593,敏感度54.7%,特异度66.1%,P = 0.005,95%的置信区间为0.529~0.657。根据Cut-off值将初始HE4水平分为≥587.9 U/ml组及<587.9 U/ml组。
卵巢恶性肿瘤诊断与治疗指南(2021年版)建议接受满意的肿瘤细胞减灭术的III期患者共化疗6个疗程,或在血清肿瘤标志物正常后至少化疗2个疗程 [11] 。由此将总化疗次数分为≤6次及>6次两组。
对各影响因素进行单因素COX比例风险回归分析,筛选P < 0.05的影响因素纳入多因素COX比例风险回归分析,得到校正后有显著差异的影响因素,即对患者预后有显著影响 [10] [12] ,结果如表4所示:

Table 4. COX proportional risk regression analysis of different transfer paths
表4. 不同转移路径的COX比例风险回归分析
经统计分析得到初始HE4水平、化疗敏感性2个变量为影响III期高级别浆液性卵巢癌预后的独立因素,且与化疗耐药者相比化疗敏感者预后更好(HR:0.307,95% CI:0.205~0.458,P = 0.000),与初始HE4水平较高者相比初始HE4水平较低者预后更好(HR:1.662,95% CI:1.109~2.491,P = 0.014)。
4. 讨论
临床上,早期卵巢癌肿瘤组织局限时,采用细胞减灭术、化疗等常规疗法治愈率高达90%。然而,在疾病扩散到其他盆腔器官后,如子宫、膀胱、腹部或腹膜外,由于肿瘤细胞减灭术和肿瘤治疗的效果有限,治愈率大幅下降 [13] 。我国卵巢癌的发病率在全世界范围内位居前列,且成逐年上升的趋势,卵巢癌作为病死率最高的妇科恶性肿瘤,已严重威胁女性的生命和健康。
2013年,国际妇产科联合会(FIGO)对卵巢癌、输卵管癌和原发性腹膜癌的分期进行了修正,修正后的分期中较为重要的变化为:经组织病理学证实的单纯淋巴结转移,由原来的IIIC期降级为IIIA1期,伴有腹膜转移者则根据病灶的大小被列入IIIA2、IIIB及IIIC期中 [14] 。此修正是基于临床证据,在此之前,已有多位专家学者对单纯淋巴结转移者的预后进行过分析。Bunja [15] 及William A.等人 [16] 的研究表明,接受满意肿瘤细胞减灭术的EOC患者,因腹膜后受累,即淋巴结转移阳性而升级为IIIC期的患者具有较低的侵袭性,其PFS和OS较伴有腹膜转移的IIIC期患者更长,预后更接近IIIA和IIIB期患者,提示这些患者可能代表了IIIC期患者中的一个独特亚群。G Ferrandina [17] 及Onda T等人 [18] 将仅有淋巴结转移的卵巢癌患者与有显微或小腹膜转移(≤2 cm)的卵巢癌患者的临床结果进行比较,研究结果表明,与显微或小腹膜定植相比,仅有淋巴结转移的肿瘤患者显示出更好的临床预后,具有相对较好的生存率。此外,与IIIA/B期相比,仅有淋巴结转移阳性的IIIC期患者的临床预后更好。FIGO提出新的分期后,Mikkel Rosendahl等人 [19] 的研究进一步验证了修订后的FIGO分期对患者的预后具有更好的指导意义,单纯淋巴结转移者的预后比伴有腹膜转移者的预后更好。而E Sun Paik [20] 在分析修订版FIGO分期(2013)对上皮性卵巢癌预后的影响时发现,IIIC期与IIIA1期卵巢癌患者相比只是显示了生存不良的趋势,对预后的影响(尤其是OS的改变)并无显著的统计学差异,甚至在多因素分析中,原III期(1988)伴有腹膜转移的卵巢癌患者的OS,较仅有淋巴结转移的卵巢癌患者要好,具体原因目前尚不清楚。Wataru Yamagami等 [21] 对日本的9747例卵巢癌患者展开研究时发现,仅有淋巴结转移的患者与伴有显微腹膜转移患者的5年总生存率之间无明显差异。由此可见,修订版的FIGO分期(2013)目前仍存在争议。
本文即针对临床上最常见的III期HGSOC展开研究,所有研究对象均接受了淋巴结清扫,根据术后病理将患者分为单纯淋巴结转移组54例与腹膜转移组481例(伴或不伴淋巴结转移)共535例。根据统计分析结果,不同转移路径的III期HGSOC患者患病年龄的构成比率、总化疗次数及手术满意度不存在显著差异(P > 0.05),即与HGSOC患者的不同转移路径无明显相关性。而不同转移路径的III期HGSOC的初始CA125水平、初始HE4水平及是否接受新辅助化疗之间存在显著差异(P < 0.05)。
本文收集两种不同转移路径的HGSOC患者治疗前初始CA125及初始HE4的值,经统计分析得到,相较于腹膜转移组的患者来说,单纯淋巴结转移组的患者治疗前初始CA125及初始HE4的值更低,两者差异有统计学意义(P < 0.05)。进一步对不同转移路径的III期HGSOC患者的化疗敏感性、复发率等进行数据统计及分析得到,相较于腹膜转移的患者来说,初始CA125及初始HE4水平相对较低的单纯淋巴结转移的患者对化疗更敏感,复发率更低。
CA125及HE4目前已广泛应用于临床,作为卵巢癌及子宫内膜癌等的恶性肿瘤的肿瘤标志物,其在血清中的含量变化往往与肿瘤的诊断、治疗效果、肿瘤进展及复发有关。在临床上,超过80%的上皮性卵巢癌患者循环CA125升高,是卵巢癌早期诊断的最佳生物标志物 [22] 。有研究提出CA125可致抗肿瘤免疫功能受损,表明CA125在癌症发生中也起一定作用 [23] 。梁旭东等人 [24] 的研究表明,铂耐药及铂部分敏感的卵巢癌患者CA125水平较铂敏感的患者高,提示其对耐药性的预测有一定的参考意义。
Shigenobu Emoto等人 [25] 的研究发现,CA125水平与腹膜转移程度和恶性腹水的存在显著相关。CA125值升高的患者中位生存期明显短于CA125值正常者。多因素分析显示,腹膜转移程度和CA125水平升高是影响预后的独立因素。Daniel W. Cramer等人 [26] 的研究也发现,浆液性卵巢癌的高CA125水平与较差的存活率显著相关。提示CA125水平偏高者与卵巢癌腹膜转移相关,且预后较差。
然而,CA125作为早期检测标记物的敏感性和特异性是有限的,只有50%出现症状的晚期卵巢癌患者血清CA125水平升高 [27] 。近几年,HE4用作卵巢癌肿瘤标志物的研究日益增多,卢仁泉等 [28] 的研究提出,HE4的敏感性和特异性优于广泛应用于临床的CA125,HE4水平与卵巢癌的发生密切相关。Seungho Lee、Lu Renquan、Richard G Moore等人 [29] [30] [31] 的研究表明,HE4的表达与癌细胞粘附、迁移和肿瘤生长有关,而且HE4诱导肿瘤细胞对抗癌药物产生耐药,激活AKT和ERK通路,提高肿瘤存活率。多位专家学者的研究表明,卵巢癌组织中HE4的表达与上皮性卵巢癌患者的预后不良和复发有关。Jiheum Paek [32] 指出,血清HE4水平升高的EOC晚期患者的PFS比正常的患者短。在多变量分析中,升高的血清HE4水平是晚期卵巢癌患者复发的独立危险因素。提示HE4水平偏高者与卵巢癌复发相关,且较易对化疗药物产生耐药,患者生存期较短,预后较差。这与本文的研究结果相似。
将患者的临床数据绘入Kaplan Meier生存分析曲线中,进一步估计不同转移路径III期HGSOC患者的生存率,腹膜转移组与单纯淋巴结转移组的总生存率及无进展生存率存在显著差异(P < 0.05),而单纯淋巴结转移组的5年总生存率为56.5%,腹膜转移组的5年总生存率为33.6%,两者间差异无统计学意义(P = 0.089),但单纯淋巴结转移组5年总生存率较腹膜转移组高。也就是说,单纯淋巴结转移组相较于伴有腹膜转移组的患者生存期更长,复发更晚,有更好的预后。这与前文中提到的许多专家学者的研究结果相似,并符合FIGO提出的2013版分期中提到的单纯淋巴结转移的卵巢癌患者预后好于伴有腹膜转移的患者。并且,本文中将III期HGSOC患者分为单纯淋巴结转移组、单纯腹膜转移组及两种转移都发生组展开分析,虽然三者间两两比较时差异无统计学意义,但我们发现三组之间存在一定的生存趋势,即单纯淋巴结转移组、单纯腹膜转移组及两种转移都发生组的总生存时间、无进展生存时间及5年总生存时间逐渐缩短。此外,针对III期HGSOC患者的预后,我们还观察了其他的影响因素,在总随访时间下,将年龄、化疗敏感性、肿瘤标志物、是否接受新辅助化疗、总化疗次数及手术满意度作为协变量,将死亡作为事件发生,存活或随访结束为删失,构建COX比例风险回归模型,进行多因素COX比例风险回归分析,得到校正后有显著差异的因素,即为影响患者预后的独立因素:初始HE4水平及化疗敏感性。且与化疗耐药者相比化疗敏感者预后更好(HR:0.307,95% CI:0.205~0.458,P = 0.000),与初始HE4水平较高者相比初始HE4水平较低者预后更好(HR:1.662,95% CI:1.109~2.491,P = 0.014)。这一结论进一步确定卵巢癌患者血清中HE4水平的差异不仅有助于患者的诊断,而且HE4在血清中水平的改变对于预测患者的复发及预后具有重要意义。
本文限定研究对象为接受了淋巴结清扫的III期HGSOC患者,剔除混杂因素较多的IV期患者及未清扫淋巴结者,对于预后的分析更可靠。但本文存在一定的局限性,首先,回顾性病例资料研究本身即存在一定的局限,且有病例资料模糊的缺陷;其次,接受新辅助化疗后虽大多数卵巢癌患者的转移灶内会留下痕迹,如砂砾体等化疗后病理改变,术前影像学诊断及术中探查情况也可辅助转移灶的诊断,但不排除部分微小转移的病灶影像学诊断不明显,在接受新辅助化疗后部分病灶内的转移性病理改变消失,术后病理分期存在误诊的可能。比如IV期患者本身诊断困难,随着治疗方案的实施,可能并不会被人发现,不排除误诊为III期的情况。近几年,由于分子检测、靶向治疗等新的检测方法及治疗方法的产生,如MMR、叶酸受体-a (FR-a)、RET、BRAF等分子检测项目及卢卡帕利等PARP抑制剂维持治疗药物的更新 [33] ,卵巢恶性肿瘤的预后较前明显改善,也成为探讨卵巢恶性肿瘤相关的热门话题,本文暂未分析参与靶向治疗对患者预后的影响,后续随着临床病理资料的完善及丰富,可能获得更有价值的信息。目前卵巢恶性肿瘤的分子转移机制仍不明确,随着研究的进行,越来越多的专家学者认为跨体腔转移,即腹膜转移与淋巴结转移有不同的生物学特征和临床行为,但至今仍未提出确切的结论,这将是我们后续需要进一步研究的方向。
5. 结论
单纯淋巴结转移的III期HGSOC患者较本伴有腹膜转移的III期HGSOC患者化疗更敏感,复发率更低,生存时间更长,预后更好。初始HE4水平及化疗敏感性为影响III期HGSOC患者预后的独立因素,且初始HE4水平较低者(<587.9 U/ml)预后更好。
声明
该文章所涉及病人的数据已获得病人知情同意。
NOTES
*通讯作者Email: qdwangn@126.com