摘要: 目的:通过对心脏非霍奇金淋巴瘤的病例报道,提高对心脏肿瘤相关疾病的认识。方法:报道1例心脏继发性非霍奇金淋巴瘤的临床表现及诊治过程,并对常见心脏肿瘤的临床及影像学特点进行文献回顾。结果:该例患者以反复胸闷、憋气伴全身水肿来诊,予以完善心脏超声示右心房占位,经手术治疗,术后病理诊断为:(右心房)大B细胞淋巴瘤–弥漫性大B细胞淋巴瘤,非特殊型;Hans分类:生发中心型;免疫组化结果示:CD20(+),Ki67(80%+),BCL2(+),BCL6(+),p53(野生型),PAXS(+),CD19(+),分子病理检查结果示:EBBR-ISH(−)。PETCT示淋巴瘤累及右心房壁、上腔静脉壁及直肠末段,现患者于血液科行化疗治疗。结论:对于全身水肿的患者,应积极完善心脏超声等相关检查,评估心脏结构及功能是否存在异常,对于心脏肿瘤,早期的诊断与治疗对患者的预后具有重大意义。
Abstract:
Objective: To improve the understanding of cardiac tumor related diseases through case reports of non-Hodgkin’s lymphoma in the heart. Method: Report the clinical manifestations, diagnosis and treatment of a case of secondary non-Hodgkin’s lymphoma of the heart, and review the literature on the clinical and imaging characteristics of common cardiac tumors. Result: The patient was diag-nosed with recurrent chest tightness, suffocation, and systemic edema, and was diagnosed with a right atrial mass on echocardiography. After surgical treatment, the postoperative pathological di-agnosis was: (right atrium) large B-cell lymphoma diffuse large B-cell lymphoma, non-specific type; Hans classification: germinal center type; The immunohistochemical results showed CD20 (+), Ki67 (80%+), BCL2 (+), BCL6 (+), p53 (wild-type), PAXS (+), CD19 (+), and the molecular pathological examination results showed EBBR-ISH (−). PETCT showed lymphoma involving the right atrial wall, superior vena cava wall, and distal rectum. The patient is currently undergoing chemotherapy treatment in the hematology department. Conclusion: For patients diagnosed with systemic edema, it is necessary to actively improve cardiac ultrasound and other related examinations to evaluate whether there are abnormalities in cardiac structure and function. For cardiac tumors, early diag-nosis and treatment are of great significance for the prognosis of patients.
心脏肿瘤属于一组异质性疾病,发生率低,有文献报道尸检中发生率为0.001%~0.28%,其包括原发肿瘤(良性肿瘤和恶性肿瘤)、其他恶性肿瘤的转移或局部侵犯,以及血栓或赘生物等,心脏转移瘤比原发心脏肿瘤更常见 [1] ,成人心脏原发肿瘤最常见的为粘液瘤,转移到心脏最常见的肿瘤是肺癌、乳腺癌、食道癌、恶性血液病,如淋巴瘤 [2] 。心脏肿瘤的临床表现从因其他原因进行的影像检查中偶然发现,到危及生命的表现,如心脏压塞、心律失常、梗阻和全身栓塞等 [3] 。心脏肿瘤的早期诊断难度较大,经食道超声心动图可提供更详细的3D图像,而心脏MRI在鉴别心脏肿块方面相对有效。
累及心脏的淋巴系统肿瘤相对罕见,心脏淋巴瘤根据原发部位可分为原发性和继发性,心脏原发淋巴瘤较少,约占所有心脏原发肿瘤的2%,后者较为常见,心脏累及率为9%~20%。其中弥漫性大B细胞淋巴瘤是最常见的病理类型 [3] 。为了解心脏淋巴瘤的诊断及治疗,我们对抢救室接诊的一位右房非霍奇金淋巴瘤病例进行分析,并进行文献复习。
患者,女,69岁,因“反复胸闷、憋气伴全身水肿9月余,加重1天”转入抢救室,患者9月余前无明显诱因,出现胸闷,憋气,伴全身水肿,遂就诊于外院,完善胸部CT示胸腔积液,心脏超声示EF值:56%,有少量心包积液,予以对症利尿治疗后出院,出院后患者规律口服降压药物,并间断口服利尿药物治疗,近半年来,患者大便偶有鲜血,量约1~2 ml。1天前,患者自觉憋喘症状较前加重,遂就诊于我院急诊科,进入抢救室后患者憋气明显,查体示:患者神志清,精神欠佳,喘憋貌,颜面部水肿,浅表淋巴结无肿大,胸廓无畸形,双侧呼吸运动对称,听诊右肺下叶呼吸音低,未闻及干湿性啰音,心前区无隆起,心尖搏动位于左第5肋间锁骨中线内0.5 cm处,未触及震颤,听诊心率87次/分,律齐,心音有力,A2 > P2,各瓣膜听诊区未闻及病理性杂音。腹软,全腹无压痛及反跳痛,双下肢呈凹陷性水肿。
完善胸部CT示:双肺炎性病变,右侧胸腔积液;心脏超声示:右房增大,右心内见一混合回声光团,充满右房,延伸至右室,大小约8 * 5 cm,活动度不大,右心内占位,性质未明。右心室收缩功能减低,右房增大,心包积液(中量),EF:55%,见图1。予以对症利尿、抗炎、平喘等对症治疗后,请心外科会诊后收入心外科病房,完善相关检查明确占位性质,考虑右房占位与子宫平滑肌瘤相关,予以完善经阴道彩色多普勒超声检查无明显异常,胸部增强CT及下腔静脉CT三维成像示右心房占位,下腔静脉走形可,未见明显充盈缺损,见图2;予以完善床旁经食道超声示:右房增大,右房内见一混合回声光团,充满右房,延伸至右室,大小约8 * 5 cm,活动度不大,未见明显蒂,其周边可见血流包饶,部分肿瘤延伸至上腔静脉内见图3。在全身麻醉下行心房肿瘤切除术,术中探查可见右心房占位,充满右心房并向右心室延伸,浸润房壁及三尖瓣瓣环,房壁质硬、不规则,考虑恶性肿瘤可能性大,经右房切口切开,见鱼肉胶冻样肿物充满右房,与右壁紧密粘连,刮匙取部分肿物送病理,刮匙刮除右房肿物,解除上下腔静脉开口及三尖瓣开口梗阻,切除部分侵润、硬化的右房壁,取合适大小材料修补右房壁。术后病理诊断为:(右心房)大B细胞淋巴瘤–弥漫性大B细胞淋巴瘤,非特殊型;Hans分类:生发中心型;免疫组化结果示:CD20(+),Ki67(80%+),BCL2(+),BCL6(+),p53(野生型),PAXS(+),CD19(+),分子病理检查结果示:EBBR-ISH(−)。患者术后转入心外科CCU进一步治疗,请血液科会诊建议完善PETCT,PETCT示淋巴瘤累及右心房壁、上腔静脉壁及直肠末段,见图4,图5。后患者进一步于血液科行骨髓穿刺,骨髓病理诊断为:骨髓组织增生大致正常,粒、红、巨核三系增生,未见肿瘤累及;完善肠镜检查,病理结果示:直肠侵袭性大B细胞淋巴瘤,符合弥漫性大B细胞淋巴瘤,患者目前行规律化疗。
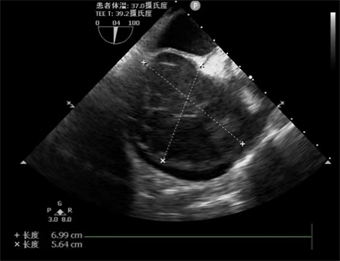
Figure 1. Echocardiographic representation of right atrial mass
图1. 超声心动图示右房占位
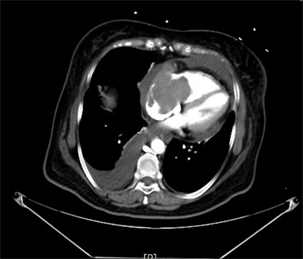
Figure 2. CT scan during arterial enhancement phase shows soft tissue density masses in the right atrium, locally protruding to the right ventricle
图2. 动脉强化期CT见右心房软组织密度团块影,局部凸向右心室

Figure 3. Transesophageal ultrasound showing right atrial mass
图3. 经食道超声示右房占位
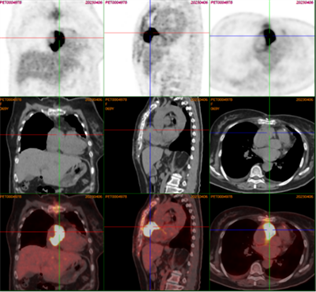
Figure 4. Soft tissue density shadow around the right atrium with FDG hypermetabolism, unclear boundary with atrial wall
图4. 右心房周围软组织密度影伴FDG高代谢,与心房壁分界不清
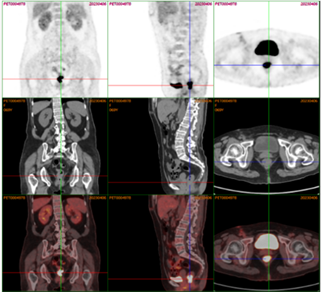
Figure 5. High metabolism of FDG in the distal rectum
图5. 直肠末段FDG高代谢
右心系统占位性病变包括血栓、肿瘤和赘生物等,右心良性肿瘤多为黏液瘤、血管平滑肌瘤、脂肪瘤等,恶性肿瘤以转移性为主,包括肝脏、肾、肺、泌尿系统转移瘤等,主要发生在右心房、右心室和(或)肺动脉内,有时累及上、下腔静脉。
血栓是最常见的心内肿块,可见于房腔或室腔内,心房血栓最常位于左心耳,在心房增大、心房颤动和二尖瓣疾病中因血流停滞而高发 [4] 。左室血栓最常见于心尖部,与收缩功能不全有关,特别是在左室室壁瘤的情况下。血栓一般也更常见于高凝状态的患者,如恶性肿瘤和抗磷脂抗体综合征,左侧血栓最可能累及大脑或冠脉循环,导致急性脑梗或心肌梗死,但也可能导致肾、脾、或肠系膜梗死 [5] 。右侧血栓可栓塞到肺循环导致肺栓塞。一般CT和超声心动图有助于区分肿瘤和血栓,但值得注意的是,肿瘤和血栓并不是相互排斥的,通常是共存的,因为肿瘤就像一个病灶,在其上可能形成血栓 [6] 。
心脏粘液瘤是常见的心脏原发性良性肿瘤,占心脏原发性肿瘤的50% [7] [8] 。它们通常发生在中年,90%的患者确诊年龄在30岁到60岁之间,在儿童中很少见,仅占该年龄段心脏良性肿瘤的10%,女性多见,发病部位多见于左心房、其次是右心房,据研究其起源于位于心脏卵圆窝和心内膜处的原始多能间充质干细胞,大部分粘液瘤为散发性,部分呈家族遗传性 [9] ,形态上可以是圆形、椭圆形或息肉样,大体通常为胶状的,表面光滑或有轻微的分叶,可以是有蒂或者无蒂 [10] 。粘液瘤最常见的诊断依据是超声心动图上的典型表现。CT和MRI在诊断不明确的不典型病例中有一定作用。由于粘液瘤容易出现肿块阻塞心腔,影响血流动力学或肿瘤部分脱落导致的栓塞等后果 [11] ,因此一旦发现,应该尽早进行手术治疗。
静脉内平滑肌瘤是一种临床少见的激素依赖性肿瘤,病理表现为良性病变,生长方式却类似恶性肿瘤,可在血管腔内结节样蔓延,部分可通过下腔静脉达右心腔和肺动脉心内浸润。右房内肿物可通过三尖瓣脱入右室,严重时导致机械性梗阻,对患者生命构成威胁。该病多发于绝经期女性,平均44岁,多数患者有子宫切除术后盆腔、腹部大血管及心腔内占位病变,且与子宫瘤的发生密切相关。
脂肪瘤通常是无症状的,状取决于起病部位。最常见于右心房或左心室。它们可起源于心内膜下(50%)、心外膜下(25%)和心肌(25%)。心内膜下脂肪瘤通常会引起梗阻症状,而起源于心肌的脂肪瘤则可能导致心律失常。
原发心脏淋巴瘤较少,约占所有心脏原发肿瘤的2%,累及心脏的非霍奇金淋巴瘤(NHL)是淋巴瘤结外累及较罕见的类型,心脏累及率约为9%~20% [12] 。原发性心脏淋巴瘤定义为:病变仅累及心脏及心包的恶性淋巴瘤,或初诊时发现心脏有大块肿瘤组织,或主要病灶位于心脏、以淋巴瘤心肌浸润引起的心脏症状为主要表现的患者,可伴有纵隔淋巴结肿大、胸膜渗出等转移征象。继发性心脏淋巴瘤定义为:起病时主要病灶和临床表现在心脏以外部位,但累及到心脏或疾病进展时累及心肌或心包。本病例中肿瘤主要累及心脏及直肠,患者有颜面部水肿症状,考虑为右心占位导致血液回流受阻而出现的上腔静脉综合征表现,同时患者间断便鲜血,肿瘤累及直肠,结合患者的临床表现及辅助检查结果,考虑诊断为继发性心脏淋巴瘤。
原发性心脏淋巴瘤(PCL)好发于右心,可能累及右心房,通常会出现心包积液,其临床表现往往无特异性,诊断延迟,预后差。最常见的症状是由于压迫或心力衰竭引起的呼吸困难。其他临床体征和症状在很大程度上取决于肿瘤的位置(例如,右心受累的上腔静脉阻塞)、心肌浸润(导致心律失常和心绞痛) [13] 。由于PCL临床诊断困难,使用现有的无创性影像检查是必要的。经食道超声心动图、CT和MRI在确定病变的位置、大小和范围方面非常有用,PET-CT是一种非常有价值的工具,有助于定位病变部位,帮助选择适当的干预措施进行快速组织诊断。PCL的诊断完全依赖于组织病理学和免疫组化来识别、分类和检查增殖活性。大多数NHL起源于B细胞,表达CD20、CD79a、CD19和其他B细胞标志 [14] 。据文献报道,弥漫性大B细胞淋巴瘤的预后很差,尤其是当有心肌浸润者。根据肿瘤的情况,PCL的主要治疗方法包括化疗、放射治疗和手术。仅化疗一项就有61%的病例得到缓解,总体上显示非常有效 [15] 。弥漫性大B细胞淋巴瘤是最常见的类型,由于其高侵袭性,早期开始化疗往往是有效的。PCL最常见的死亡原因是心力衰竭,其次是脓毒症和淋巴瘤的进展。发生比例较小的其他疾病有心律失常、血栓、脑血管意外和心源性猝死 [16] 。
对于心脏占位,心内肿块的识别应首先考虑到患者的临床病史。要考虑的重要因素包括年龄,既往心脏病史,如房颤、瓣膜病等基础疾病会使患者发生血栓的风险升高,当肿块接近瓣膜时,应考虑感染性心内膜炎的危险因素,如留置静脉导管或静脉注射毒品、免疫缺陷的患者。对于女性右心房占位性病变患者,建议常规检查下腔静脉及子宫、附件及盆腔,一旦发现下腔静脉内有条索状异常回声、且患者有子宫病变或相关病史,应考虑静脉内平滑肌瘤病。几乎任何心脏肿块都可能出现全身症状,如发烧和体重减轻。
心脏肿块的直接肿瘤效应可进一步分为梗阻、心脏压塞和心律失常。如果肿块位于右心房或右室,则会导致右侧心力衰竭症状,包括周围性水肿、腹水或上腔静脉综合征。在较大的左房或左室肿块中,因肺水肿引起的呼吸急促较为常见。心脏压塞是心脏肿瘤中最常见的危及生命的表现,其发生是由于心包腔内充满液体并限制心脏充盈。这常见于心脏或心包的转移性疾病,尤其常见于乳腺癌或肺癌的直接扩散。心脏肿瘤可由于正常心肌的破坏而导致心律失常。任何心律失常都可能发生,包括房颤、室性心动过速和室颤。在本例患者中,临床症状主要以憋喘及全身水肿为主,合并心包积液,胸腔积液,接诊此类症状的患者时,病因除了考虑肾功能不全、心力衰竭、低蛋白血症、甲状腺功能减退等常见疾病外,应进一步明确心衰的病因,评估心脏功能,完善心脏超声等检查,尽快明确病因,对于心脏占位的患者,早期的诊断与治疗对患者的预后具有重大意义。