摘要: 目的:分析非小细胞肺癌(Non-Small Cell Lung Cancer, NSCLC)患者预后的影响因素,并建立评估NSCLC患者预后的列线图模型,为临床诊疗提供依据。方法:选择2017年1月至2020年12月初次就诊于青岛市市立医院经组织病理学确诊为NSCLC患者共429例为研究对象,分析患者的临床资料及初治前相关血液学指标,采用单因素及多因素COX回归分析影响NSCLC患者总生存期(Overall Survival, OS)的独立预后因素并建立列线图模型用于预测NSCLC患者的生存率,时间依赖性ROC曲线(Time-Dependent ROC, Time ROC)评价模型的判别区分能力,决策曲线(Decision Curve Analysis, DCA)分析评估预测模型的临床实用性,采用X-tile软件按照预后指数(Prognostic Index, PI)将患者分为高、低风险组。结果:多因素COX回归分析结果显示TNM分期、病理类型、神经元特异性烯醇化酶(Neuron-Specific Enolase, NSE)、前白蛋白(Prealbumin, PAB)及全身免疫炎症指数/血清白蛋白(Systemic Immune-Inflammation Index/Albumin, SII/ALB)、吸烟史是NSCLC患者OS的独立预后因素。基于以上独立预后因素建立评估NSCLC患者预后的列线图模型,建模组的1年、3年、5年生存率的ROC曲线下面积(Area Under Curve, AUC)分别为0.744、0.799、0.843。验证组分别为0.843、0.794、0.871,提示该预测模型具有较好的判别区分能力,决策曲线分析示该预测模型具有较好的临床实用性。PI的最佳截断值为0.48,Kaplan-Meier生存分析及Log-rank检验显示整体组、建模组及验证组中低风险组患者OS均显著优于高风险组患者OS (P < 0.001)。结论:TNM分期、病理类型、NSE、PAB、SII/ALB、吸烟史是影响NSCLC患者预后的因素,基于以上因素建立的列线图模型对NSCLC患者的生存率有较好的临床预测价值。
Abstract:
Objective: To analyze the factors influencing the prognosis of NSCLC patients, and establish a nomogram model to evaluate the prognosis of NSCLC patients, so as to provide a basis for clinical diagnosis and treatment. Methods: A total of 429 patients with NSCLC diagnosed by histopathology in Qingdao Municipal Hospital from January 2017 to December 2020 were selected as the study objects. Clinical data and related hematological indicators before initial treatment were analyzed. Univariate and multivariate COX regression analysis was used to analyze the independent prognostic factors affecting the overall survival of NSCLC patients, and a nomogram model was established to predict the survival rate of NSCLC patients. The discriminant and distinguishing ability of the time-dependent ROC curve evaluation model was evaluated, and the clinical practicability of the prediction model was evaluated by decision curve analysis. X-tile software was used to divide patients into high and low risk groups according to prognostic index. Results: Multivariate COX regression analysis showed that TNM stage, pathological type, neuron-specific enolase, prealbumin and systemic immune-inflammation index/albumin, and smoking history were independent prognostic factors for OS in NSCLC patients. Based on the above independent prognostic factors, a nomogram model was established to evaluate the prognosis of NSCLC patients. The area under ROC curve of 1-year, 3-year and 5-year survival rates in the modeling group were 0.744, 0.799 and 0.843, respectively. The results of the verification group were 0.843, 0.794 and 0.871, respectively, suggesting that the prediction model had good discriminant and distinguishing ability, and the decision curve analysis showed that the prediction model had good clinical practicability. The optimal cut-off value of PI was 0.48. Kaplan-Meier survival analysis and Log-rank test showed that the OS of patients in the low-risk group was significantly better than that of patients in the high-risk group in the whole group, modeling group and verification group (P < 0.001). Conclusion: TNM stage, pathological type, NSE, PAB, SII/ALB and smoking history are the factors that affect the prognosis of patients with NSCLC. The nomogram model established based on the above factors has a good clinical prediction value for the survival rate of patients with NSCLC.
1. 引言
癌症是人类面临的一个严重的全球公共卫生问题,其中大约每年有200万人被新诊断为肺癌 [1] 。在我国原发性肺癌仍居恶性肿瘤首位,其中NSCLC占比80%~85% [2] 。虽然分子靶向治疗及免疫治疗在一定程度上改善了NSCLC患者的生存质量,但多数晚期患者的预后不容乐观 [3] 。因而探索一项经济高效的评估NSCLC患者预后的预测模型至关重要。大量研究表明,免疫、炎症和营养状况在恶性肿瘤的发生发展及预后中起着重要的作用,SII/ALB作为一种新的预测癌症预后的综合性指标,其已被证实与肝细胞癌 [4] 、小细胞肺癌 [5] 等预后相关,PAB较ALB更能敏感地反映机体营养状态变化,与恶性肿瘤的恶性程度、转移情况以及预后关系密切 [6] 。NSE除了作为研究小细胞肺癌的疾病程度外,也有研究证实其与NSCLC患者抗肿瘤治疗后的预后密切相关 [7] 。本研究旨在基于影响NSCLC患者预后的常见临床因素建立一个评估NSCLC患者预后的列线图模型,为临床医生更好地作出医疗决策提供参考。
2. 研究对象与方法
2.1. 研究对象
回顾性收集2017年1月至2020年12月初次就诊于青岛市市立医院经病理组织学确诊为NSCLC患者,随访至2023年6月30日,中位随访时间为50.5个月,总生存期被定义为从患者确诊至死亡或最后一次随访的时间(月)。随访采用电话随访、查阅电子病例、门诊复诊等方式。纳入标准:① 初次就诊于我院,经组织病理学确诊为NSCLC;② 临床、影像学及病理学资料详细完整;③ 可随访到总生存期。排除标准:① 合并有支气管哮喘、慢性阻塞性肺病、肺间质纤维化等慢性呼吸系统疾病;② 合并有严重全身性疾病或严重肝、肾、心、血液系统、肺功能障碍;③ 合并有其他系统肿瘤病史;④ 确诊NSCLC前1个月急慢性感染或应用过抗生素;⑤ 随访过程中失访;⑥ 临床、影像学及病理学资料缺失。最终共纳入研究对象429例。本研究已获得青岛市市立医院伦理委员会审核通过(伦理号:KTLL202306117)。
2.2. 研究内容与研究方法
2.2.1. 研究内容
采用医院病案管理系统收集患者年龄、性别、吸烟史,肿瘤分期及是否手术治疗,患者初治前1周的血液学指标:癌胚抗原、可溶性细胞角蛋白19片段、神经元特异性烯醇化酶、中性粒细胞、淋巴细胞、血小板、C反应蛋白、白蛋白、前白蛋白、D-二聚体。
2.2.2. 定义
全身免疫炎症指数/血清白蛋白(Systemic Immune-inflammation Index/Albumin, SII/ALB) = 中性粒细胞 × 淋巴细胞/血小板/白蛋白,全身免疫炎症指数(Systemic Immune-Inflammation Index, SII) = 中性粒细胞 × 淋巴细胞/血小板,C反应蛋白/血清白蛋白比值(C-reactive protein/Albumin Ratio, CAR) = C反应蛋白/白蛋白,血小板与淋巴细胞比值(Platelet-to-Lymphocyte Ratio, PLR) = 血小板/淋巴细胞。
2.2.3. 统计学方法
采用SPSS 26.0、R4.3.1软件、X-tile 3.6.1软件进行数据分析。其中符合正态分布的计量资料以均数±标准差表示,组间比较采用两独立样本T检验;不符合正态分布的计量资料采用[M(Q1, Q3)]表示,组间比较采用Mann-Whitney U检验;计数资料采用例(%)表示,组间比较采用χ2检验,检验水准α设为0.05 (双侧检验);将单因素COX回归分析中有意义的影响因素纳入多因素COX回归分析中,采用向前LR法筛选出影响患者OS的独立预后因素;应用R软件建立预测NSCLC患者生存率的列线图模型;采用校准曲线评价列线图模型的校准能力,采用时间依赖性ROC曲线来评价模型判别区分能力,采用决策曲线分析评估预测模型的临床实用性。以上分别应用了R软件中的car包、survival包、ggplot2包、rms包、pROC包、timeROC包、rmda包;最后计算出所有患者的预后指数(PI)并应用X-tile软件分为高、低风险组,使用Kaplan-Meier生存分析绘制生存曲线,不同风险组间的生存分析采用Log-Rank检验,区分出高低风险人群。
3. 结果
3.1. 429例患者的临床基线特征
本研究共纳入429例NSCLC患者。其中生存171例(39.86%),死亡258例(60.14%);男性患者264例(61.5%),女性患者165例(38.5%);年龄 ≥ 60岁患者275例(64.1%),年龄 < 60岁患者154例(35.9%);TNM分期为I期~IIIA期患者156例(36.4%),IIIB期~IVB期患者273例(63.6%);病理分型为腺癌患者335例(78.1%),鳞癌患者94例(21.9%);手术治疗患者149例(34.7%),未手术患者280例(65.3%);有吸烟史患者209例(48.7%),无吸烟史患者220例(51.3%)。429例NSCLC患者临床基线特征见(表1)。

Table 1. Relationship between clinical baseline characteristics and survival status in 429 patients with NSCLC
表1. 429例NSCLC患者临床基线特征及与生存状态之间的关系
3.2. 影响NSCLC患者OS的单因素COX回归分析
以NSCLC患者的生存或死亡为状态变量(生存 = 0,死亡 = 1),以NSCLC患者的OS为时间变量,以患者性别、年龄、TNM分期、病理分型、手术治疗、吸烟史、癌胚抗原、可溶性细胞角蛋白19片段、NSE、PAB、D-二聚体、SII、SII/ALB、CAR、PLR为自变量建立COX比例风险模型,结果显示性别、年龄、TNM分期、病理分型、手术治疗、吸烟史、癌胚抗原、可溶性细胞角蛋白19片段、NSE、PAB、SII、SII/ALB、CAR、PLR与NSCLC患者OS存在显著相关性(P < 0.05) (表2)。

Table 2. Univariate COX regression analysis of OS in NSCLC patients
表2. 影响NSCLC患者OS的单因素COX回归分析
3.3. 影响NSCLC患者OS的多因素COX回归分析
将单因素COX回归分析中有统计学意义的指标纳入多因素COX回归分析(采用向前LR法)中。结果显示,TNM分期(HR = 3.171, 95% CI: 2.320~4.344)、病理分型(HR = 0.738, 95% CI: 0.544~1.000)、吸烟史(HR = 1.307, 95% CI: 1.007~1.695)、NSE (HR = 1.018, 95% CI: 1.004~1.032)、PAB (HR = 0.966, 95% CI: 0.933~0.998)、SII/ALB (HR = 1.009, 95% CI: 1.004~1.014)是NSCLC患者OS的独立预后因素(表3)。

Table 3. Multivariate COX regression analysis of OS in NSCLC patients
表3. 影响NSCLC患者OS的多因素COX回归分析
3.4. 预测NSCLC患者生存率的列线图的建立与验证
通过R软件将多因素COX回归分析中的独立预后因素(TNM分期、病理分型、吸烟史、NSE、PAB及SII/ALB)纳入得到NSCLC患者生存率的列线图(图1)。为验证该列线图模型的区分度及准确性,从429例NSCLC患者随机抽取128例为验证组,分别绘制了建模组及验证组的校准曲线及1年、3年及5年时间依赖性ROC曲线,结果表明,校准曲线与理想参考线具有较好的一致性(图2、图3)。建模组的1年、3年、5年生存率的ROC曲线下的面积分别为0.744、0.799、0.843 (图4),验证组的1年、3年、5年生存率的ROC曲线下的面积分别为0.843、0.794、0.871 (图5),均提示该模型具有较好的区分度。通过绘制建模组及验证组的决策曲线进一步评估该模型在临床中的实用性,结果显示该模型有较好的临床实用性(图6、图7)。

Figure 1. A nomogram for predicting survival in NSCLC patients
图1. 预测NSCLC患者生存率的列线图



Figure 2. Calibration curves for the prediction of 1-year, 3-year, 5-year survival of NSCLC patients by nomogram (modeling group)
图2. 列线图预测NSCLC患者1年、3年、5年生存率的校准曲线(建模组)
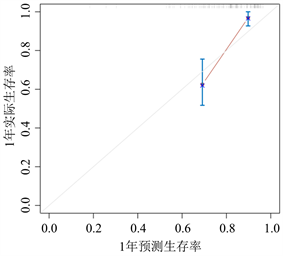
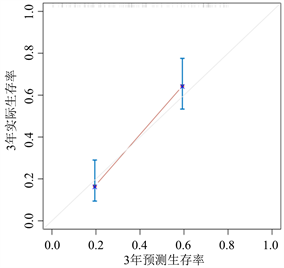
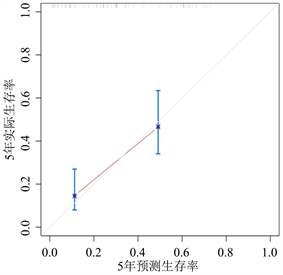
Figure 3. Calibration curves for the prediction of 1-year, 3-year, 5-year survival of NSCLC patients by nomogram (validation group)
图3. 列线图预测NSCLC患者1年、3年、5年生存率的校准曲线(验证组)
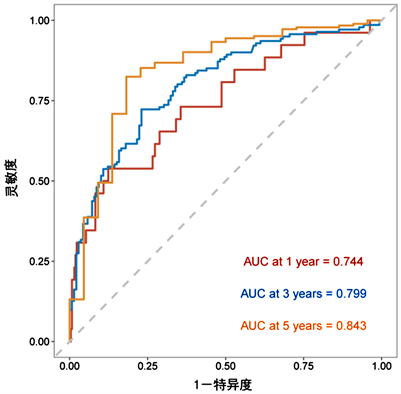
Figure 4. ROC curves for 1-year, 3-year, 5-year survival of NSCLC patients predicted by nomogram (modeling group)
图4. 列线图预测NSCLC患者1年、3年、5年生存率的ROC曲线(建模组)
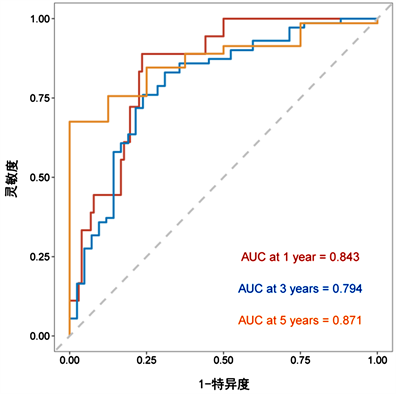
Figure 5. ROC curves for 1-year, 3-year, 5-year survival of NSCLC patients predicted by nomogram (validation group)
图5. 列线图预测NSCLC患者1年、3年、5年生存率的ROC曲线(验证组)
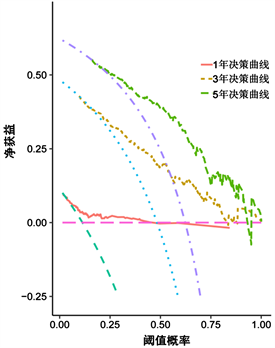
Figure 6. Modeling group 1-year, 3-year, 5-year decision curves
图6. 建模组1年、3年、5年决策曲线
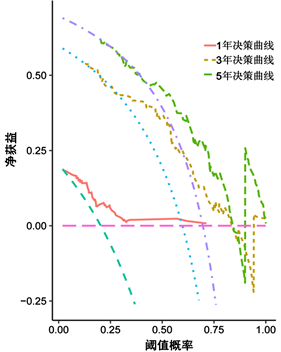
Figure 7. Validation group 1-year, 3-year, 5-year decision curves
图7. 验证组1年、3年、5年决策曲线
3.5. 区分高、低风险人群及Kaplan-Meier生存分析
依据列线图模型,进一步应用多因素COX回归分析计算出所有入组患者的预后指数(PI),通过X-tile软件计算出PI的最佳截断值为0.48,分为高风险组(PI > 0.48)及低风险组(PI ≤ 0.48),其中在整体组中,低风险组患者与高风险组患者的中位生存期分别为48个月(95% CI: 48.415~54.534)和16个月(95% CI: 14.465~17.535)如(图8),在建模组中分别为50个月(95% CI: 48.524~55.634)和20个月(95% CI: 17.587~22.413)如(图9),在验证组中分别为36个月(95% CI: 28.059~43.941)和13个月(95% CI: 10.352~15.648)如(图10)。Log-rank检验显示,以上P值均小于0.001。以上结果表明,通过计算患者的PI有助于区分出高低风险人群,从而为临床医疗决策提供较好的依据。
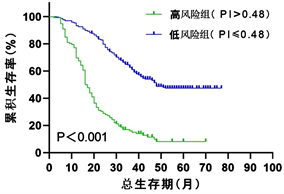
Figure 8. Kaplan-Meier survival curve for patients at high and low risk of NSCLC (overall group)
图8. NSCLC高低风险组患者的Kaplan-Meier生存曲线(整体组)
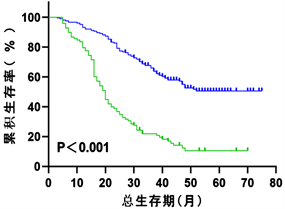
Figure 9. Kaplan-Meier survival curve for patients at high and low risk of NSCLC (modeling group)
图9. NSCLC高低风险组患者的Kaplan-Meier生存曲线(建模组)
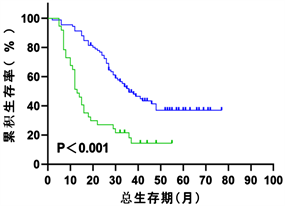
Figure 10. Kaplan-Meier survival curve for patients at high and low risk of NSCLC (validation group)
图10. NSCLC高低风险组患者的Kaplan-Meier生存曲线(验证组)
4. 讨论
在我国,肺癌仍是发病率和死亡率较高的癌症之一,其中非小细胞肺癌占比最多且大部分患者发现时已是晚期,错过最佳治疗时期。近年来,我国肺癌新增确诊病例仍在持续上升 [8] 。因此为改善非小细胞肺癌患者的生活质量及预后,临床医生及患者迫切需要一种综合性指标用于识别高风险人群及预测患者的预后,为癌症诊疗提供指导。
大量研究表明,肿瘤微环境中炎症因素在肿瘤发生发展中发挥着重要作用 [9] ,免疫系统在癌症监测和清除中的作用及人体的营养状况是影响癌症患者生存状况的重要因素 [10] 。因此,如血小板与淋巴细胞比值(PLR)、中性粒细胞与淋巴细胞比值(NLR) [11] 、C反应蛋白与白蛋白比值(CAR) [12] 等反应全身免疫、炎症、营养状况的血液学指标已被应用于预测癌症患者的预后。近年来,SII作为其中一种综合性指标,其对肺癌、结直肠癌、肝癌、淋巴瘤的预后都有显著影响 [13] 。SII/ALB与SII相比是一种将上述三种因素综合考虑的新的预测癌症预后的指标,其已被证实与肝细胞癌 [4] 、小细胞肺癌 [5] 等预后相关。本研究单因素分析显示PLR、CAR、SII、SII/ALB均具有统计学意义,而多因素分析显示仅SII/ALB是NSCLC患者预后的独立危险因素,此结果反映了SII/ALB作为一种综合了免疫、炎症及营养状况的指标在预测患者预后中更有价值,其值越高患者的预后越差,这与TIAN [4] 、姜 [5] 等人的研究结果是一致的。
本研究PAB在单因素及多因素分析结果均显示PAB (P < 0.001)与患者OS具有明显相关性。由于前白蛋白(PAB)的半衰期仅有1.9天,明显短于白蛋白,因而能够更敏感地反应出机体的营养状态,大量研究表明恶性肿瘤的预后与前白蛋白减少关系密切,如食管癌、结直肠癌、小细胞肺癌、非小细胞肺癌等 [14] [15] 。肿瘤是一种消耗性疾病,根据患者PAB水平,临床医生可为患者提早作出营养摄入方案。
本研究中,将癌胚抗原、可溶性细胞角蛋白19片段、神经元特异性烯醇化酶三种肿瘤标志物纳入多因素COX回归分析后,发现仅NSE (P = 0.013)是NSCLC患者预后的独立危险因素。NSE是一种酸性蛋白酶,参与糖酵解代谢过程,主要存在于神经元及神经内分泌细胞中,既往大量文献证实NSE是评估小细胞肺癌患者预后的最有价值的肿瘤标志物之一 [16] ,对患者的治疗监测和复发转移有重要意义,与小细胞肺癌患者的预后具有显著相关性,但在非小细胞癌患者的疾病监测 [17] 、预后 [18] 及淋巴结转移风险 [19] 中也得以证实。
此外,在既往研究中患者的性别、年龄、吸烟均是影响NSCLC预后的因素,而本项研究结果仅吸烟为NSCLC患者OS的独立预后因素。相关研究显示,环境因素及生活方式是患肺癌的危险因素,据统计吸烟占这些因素的85%~90%,且吸烟年限越长、每日吸烟量越大,肺癌发生风险越高 [20] [21] 。本研究多因素COX回归分析中TNM分期是NSCLC患者的独立预后因素,即患者TNM分期越晚,预后越差,这与既往研究结果是一致的。肺腺癌是肺癌中最常见的病理类型,虽然肺腺癌较容易发生转移,但由于部分患者存在突变基因,靶向治疗使得晚期肺腺癌病人生存时间明显延长 [22] 。本研究多因素COX回归分析发现肺腺癌患者预后较肺鳞癌好。Wu等 [23] 在一项奥西替尼治疗EGFR突变的非小细胞肺癌患者的研究中发现,相比于安慰剂治疗组的患者,接受靶向药物治疗患者的无病生存期明显延长。Zhong等 [24] 人发现,虽然吉非替尼在治疗早期EGFR突变患者中的总生存期相比无病生存期没有非常明显的改善,但与历史数据相比患者的OS最长。
本研究通过将患者的PAB、NSE、SII/ALB联合TNM分期、病理分型、吸烟史建立了列线图模型,可以低成本、快速的判断患者预后,从而加强对患者的随访和治疗,使患者获益。本研究同时进行了内部验证,时间依赖性ROC曲线下面积提示该模型具有较好的区分度,校准曲线与理想参考线具有较好的一致性,决策曲线也提示该模型在临床中具有较好的实用性。同时,在构建的列线图模型的基础上,计算出患者的预后指数,将患者分为高风险组与低风险组人群,这能够在极大程度上帮助临床医师针对非小细胞肺癌患者的个体化治疗作出科学合理的计划 [25] 。
本研究存在一定的局限性:第一,本研究仅采用了内部验证,未对该模型进行外部验证;第二,本研究是一项单中心研究且样本量较小,会产生统计学差异;第三,回顾性研究结果会有固有的偏倚和误差;最后,应用X-tile软件计算的SII/ALB最佳截断值在临床中的应用尚无明确共识,仍需要更多研究来证实。
综上所述,NSE、PAB、SII/ALB、TNM分期、病理类型、吸烟史是NSCLC患者OS的独立预后因素,基于以上因素建立的列线图模型对NSCLC患者的生存率有较好的临床预测价值。同时通过筛选NSCLC患者中高、低风险组人群,对患者作出科学合理的个体化治疗具有指导意义。
基金项目
国家呼吸系统疾病临床医学研究中心山东省分中心建设项目(21-1-2-3-zyyd-nsh)。
NOTES
*通讯作者。