1. 引言
野巴子(Elsholtzia rugulosa Hemsl.)是唇形科香薷属植物,又名野拔子、草芝麻蒿、细皱香薷等 [1] ,为一年生药食同源植物,主产于西南地区的山坡草地中,包括云贵高原以及四川等地,在云南分布尤为丰富 [2] 。野巴子性凉、略苦,具有疏风解表、消食化积的作用 [3] 。现代研究表明,野巴子含有黄酮类、挥发油类成分,有清除自由基、抑菌、降血糖活性 [4] [5] [6] 。目前有关野巴子多糖生物活性的研究报道得较少。
张玉婷等对云南楚雄野巴子中多糖含量进行了测定 [7] ,本论文对野巴子多糖的提取、理化性质及生物活性进行初步探究,为后续药用及保健功能产品开发提供一定的指导。
2. 材料与方法
2.1. 材料与试剂
本实验材料为唇形科香薷属的野巴子(Elsholtzia rugulosa Hemsl.)晒干后的叶片。本次研究所用的干燥野巴子叶于2016年采自云南省楚雄彝族自治州,经中央民族大学生命与环境科学学院刘博老师鉴定。
实验动物为SD大鼠E18孕鼠。实验老鼠购自北京维通利华实验动物技术有限公司,许可证号:SCXK (京) 2016-0011。
D-糖醛酸,北京拜尔迪生物公司产品;鼠李糖、木糖、葡萄糖、甘露糖、岩藻糖、阿拉伯糖、半乳糖sigma公司;水杨酸、无水碳酸钠、磷酸氢二钠、1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl radical 2,2-Diphenyl-1-(2,4,6-trinitrophenyl) hydrazyl, DPPH)、无水苯酚、二甲基亚砜(分析纯)国药集团产品;正丁醇、硫酸、三氯甲烷(分析纯)北京化工厂产品;4-硝基苯基-D-吡喃糖苷(p-Nitrophenyl-β-D-Galactopyranoside, PNPG)、对硝基苯酚、阿卡波糖、α-葡萄糖苷酶(纯度100 U/mg)、Dextran标准品(分子量5000、10,000、20,000、40,000、70,000、100,000、500,000)上海源叶生物科技有限公司产品;WST-1细胞增殖及细胞毒性检测试剂盒、LDH乳酸脱氢酶细胞毒性检测试剂盒碧云天生物技术有限公司。
2.2. 仪器与设备
KDY-9820型凯式定氮仪,北京瑞邦兴业;KQ-500DE型数控超声波清洗器,昆山市超声仪器有限公司;UV-Jasco53型紫外分光光度计、GC-2014型毛细管气相色谱仪,日本岛津;高效液相色谱仪(RI2041视差折光检测器)德国KNAUER;Benchmark plus酶标仪,美国伯乐公司。
2.3. 实验方法
2.3.1. 野巴子粗多糖(YBZc)的提取
野巴子叶粉碎→95%乙醇回流→脱脂野巴子叶→超声波辅助水提法提取 [8]
↓
野巴子粗多糖←3.5倍体积95%乙醇醇沉
2.3.2. YBZc提取率计算方法
采用超声波辅助水提醇沉法对野巴子多糖进行提取,按公式(1)计算多糖提取率 [9] :
(1)
2.3.3. YBZc的理化性质测定
对野巴子粗多糖溶液进行如下理化性质测定:
硫酸–咔唑反应:在浓硫酸的作用下,糖醛酸会水解成带有-COOH的糠醛衍生物或糠醛,能够继续与咔唑发生反应,生成紫红色的化合物 [10] 。
菲林试剂反应:菲林试剂与还原性糖(葡萄糖、果糖等)反应生成砖红色沉淀 [11] 。
苯酚–硫酸反应:在硫酸存在的条件下,五碳糖类和六碳糖类以及它们的双糖类能够被分解成羟甲基糠醛并与苯酚作用产生橘黄色缩合产物 [11] 。
碘–碘化钾反应:淀粉遇到碘–碘化钾溶液显示特征蓝色 [10] 。
多糖鉴定:向两只试管中各加入1 mL浓度为1 mg/mL的野巴子粗多糖溶液,其中一支试管中加1 mL浓硫酸进行加热酸水解,然后将两支试管进行斐林试剂反应 [11] 。
2.3.4. 硫酸-咔唑法测定YBZc糖醛酸含量和气相色谱分析
按文献中方法制作糖醛酸标准曲线,得回归方程 [10] 。取浓度为1 mg/mL的野巴子粗多糖溶液1 mL,进行上述反应,计算得糖醛酸含量。
YBZc的气相色谱(GC)分析:按文献中方法对各标准单糖和YBZc进行水解、还原、乙酰化 [12] ,之后进行GC分析。
条件:Rtx-225毛细管柱(30 m × 0.32 mm × 0.25 μm);程序升温条件:100℃→200℃,升温速度为5℃/min;载气:氢气;线速为48 cm/s;进样方式:分流;分流比为10:1;检测器:FID。
2.3.5. 凯氏定氮法测定野巴子粗多糖中蛋白质含量
本实验按照GB5009.5-2010中凯氏定氮法对YBZc中的蛋白质含量进行测定。
2.3.6. YBZc的相对分子质量测定
YBZc的高效液相色谱法(HPLC)检测
将不同相对分子质量的葡聚糖配成2 mg/ml的糖溶液,得到lgMp-RT校正曲线。将YBZc也配制成2 mg/ml的糖溶液,进行相同测定,代入线性方程,以测YBZc的相对分子质量。
条件:OHpak SB-805HQ series凝胶柱(分子量 < 4 × 106,8 × 300 mm);柱温,38℃;流动相,0.1 mol/L NaNO3;流速,0.8 mL/min;进样量,20 μL。
2.3.7. YBZc清除自由基活性测定
1) YBZc清除∙OH自由基活性的测定
按参考文献进行活性测定 [13] ,计算∙OH清除率公式如(2):
(2)
式中:Ax为510nm处测得的吸光度;Ao为空白组的吸光度。
2) YBZc清除DPPH∙自由基活性的测定
按参考文献进行活性测定 [13] ,计算DPPH∙清除率公式如(3):
(3)
式中:As为所测得的吸光度;Ar为空白组的吸光度;Ao为未加样液的DPPH溶液的吸光度。
2.3.8. α-葡萄糖苷酶法进行YBZc体外降血糖活性研究
按参考文献进行活性测定 [14] ,α-葡萄糖苷酶清除率计算公式如(4):
A1为405 nm下测定的吸光度值,A2为样品本底的吸光度值,A0则为不加样品测定酶的活力吸光度值。阿卡波糖作为阳性对照,
(4)
2.3.9. 野巴子多糖对STS介导的神经元损伤的保护作用
1) 乳鼠海马神经元的原代培养及分组处理
按照参考文献中方法培养乳鼠原代海马神经元 [15] ,实验随机分为4组:正常对照组、STS模型组、YBZc组和YBZc预处理组。对照组不加其他处理;模型组加终浓度为0.3 μmol/L的星形孢菌素(staurosporine, STS),使得细胞损伤程度为50%,建立STS介导神经元损伤细胞模型;YBZc组加入不同浓度的野巴子粗多糖溶液;YBZc预处理组加入0.3 μmol/L的STS和不同浓度的野巴子粗多糖溶液。24 h后使用WST-1法和LDH法检测细胞存活率和细胞毒性。
2) 细胞增殖率测定
细胞系与WST-1共培养于37℃下2 h,450 nm波长测定其吸光度。按公式(5)计算细胞增殖率:
(5)
3) LDH细胞毒性检测
将细胞培养于96孔板,进行处理后,吸取上清20 uL并加入20 μL LDH检测工作液。混匀,室温(约25℃)避光孵育30 min,然后在490 nm处测定吸光度。按公式(6)计算细胞毒性:
(6)
4) 统计分析
实验数据用x ± SE表示,应用GraphPad Prism7.00软件进行独立性t检验,以P < 0.05为差异有统计学意义。
3. 结果与分析
3.1. 野巴子粗多糖(YBZc)提取及理化性质
在料液比1:30 g/mL,提取温度70℃,提取时间2 h,超声功率300 W条件下,YBZc提取率为5.63%。YBZc为棕黄色粉末,易溶于水,不溶于有机溶剂。对YBZc定性检测,结果如表1所示。

Table 1. The qualitative test results of YBZc
表1. 野巴子粗多糖定性试验结果
3.2. YBZc中糖醛酸的含量测定及气相色谱分析
采用硫酸–咔唑法对YBZc中的糖醛酸含量进行测定 [10] ,制作糖醛酸标准曲线如图1:
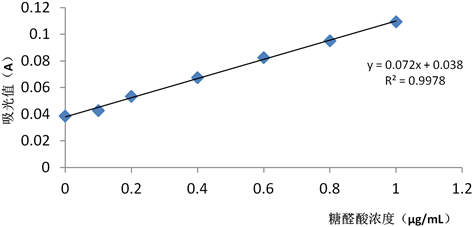
Figure 1. Standard curve of uronic acid content
图1. 糖醛酸含量的标准曲线
线性回归方程y = 0.072x + 0.038,R2 = 0.9978。将野巴子粗多糖溶液吸光度值代入,计算得YBZc中糖醛酸含量为32.2%,表明YBZc中含有糖醛酸。
YBZc进行GC单糖组成分析 [12] ,与标准单糖比较,结果显示YBZc的单糖组成为Rha、Ara、Man、Glc、Gal,相对摩尔比为1.000:0.793:0.440:0.557:0.994,其中Rha占比最高,Man占比最低,YBZc是含有糖醛酸的酸性粗多糖。
3.3. YBZc中的蛋白质含量测定
凯氏定氮法测得实验提取到的YBZc中,蛋白质含量为2.98%,可见粗提物中含有游离的蛋白质。
3.4. YBZc的相对分子质量测定
多糖的活性同分子量大小关系密切 [16] ,所以对YBZc分子量分布范围进行测定。采用HPLC和标准曲线法测YBZc的分子量(图2),得到标准葡聚糖的标准曲线,线性方程为y = −0.7956x + 14.654,R2 = 0.9935。
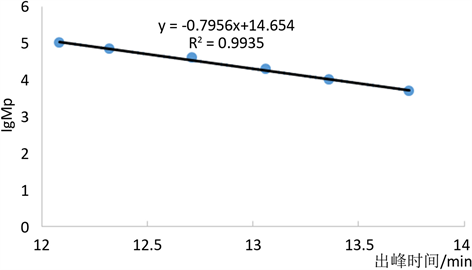
Figure 2. Calibration curve for molar mass of YBZc
图2. YBZc的分子量标准曲线图
YBZc的最高峰的保留时间为13.67 min,代入上述线性方程,计算得分子量为5901.84 u。
3.5. YBZc清除自由基活性测定
3.5.1. YBZc体外清除•OH自由基
在清除∙OH体系中加入YBZc,以抗坏血酸(Vitamin C,Vc)为阳性对照,酶标仪检测 [13] ,结果如图3。
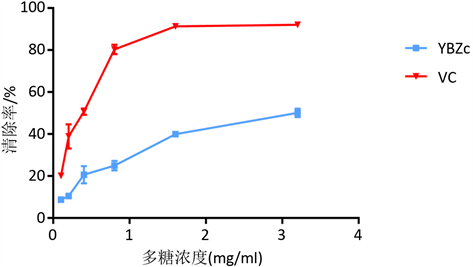
Figure 3. Scavenging effect of YBZc and Vc on •OH
图3. YBZc及Vc对•OH的清除作用
YBZc对∙OH清除作用存在一定的剂量关系;当野巴子粗多糖溶液浓度为0.1 mg/mL时,其对∙OH的清除率为8.7%;当野巴子粗多糖溶液浓度达到3.2 mg/mL时,其对∙OH的清除率达50.14%,剂量关系表明野巴子多糖在高浓度条件下具有良好的清除∙OH的活性。
3.5.2. 野巴子多糖体外清除DPPH自由基的活性
测定不同浓度多糖对DPPH∙的清除作用,以Vc为阳性对照,酶标仪检测 [13] ,结果见图4。
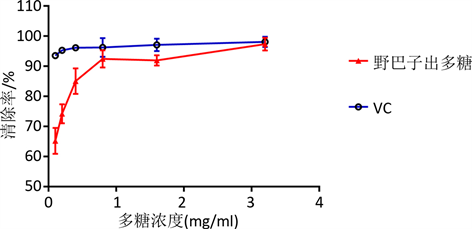
Figure 4. Scavenging effect of YBZc and Vc on DPPH•
图4. YBZc及Vc对DPPH•的清除作用
YBZc对DPPH∙清除作用存在一定的剂量关系;当野巴子粗多糖溶液浓度为0.1 mg/mL时,其对DPPH∙的清除率为65.22%;当野巴子粗多糖溶液浓度达到3.2 mg/mL时,其对DPPH∙的清除率达97.37%,与Vc清除率相当,表明野巴子多糖具有良好的清除DPPH∙的活性。而多糖具有毒副作用小、无抗药性等优点,为后续研发为清除自由基替代药物提供一定的依据。
3.6. 野巴子体外降血糖的活性
测定不同浓度多糖对α-葡萄糖苷酶的抑制率,以阿卡波糖为阳性对照,酶标仪进行检测 [14] 。如图5:
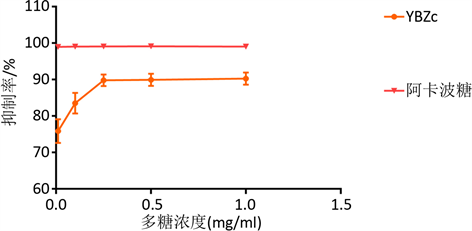
Figure 5. The inhibition rate of Alpha-glucosidase by the acarbose and YBZc
图5. 野巴子多糖及阿卡波糖对α-葡萄糖苷酶的抑制率
不同浓度的野巴子粗多糖对α-葡萄糖苷酶均有显著的抑制作用;随着浓度的增加,抑制作用显著升高,在浓度达到1 mg/mL时,多糖对α-葡萄糖苷酶抑制效果最佳,达到90.28%。表明野巴子粗多糖有一定的降血糖作用,且效果较好。
3.7. 野巴子多糖对STS介导的神经元损伤的保护作用
3.7.1. YBZc对乳鼠海马神经元细胞增殖率的影响
与对照组相比,STS模型组乳鼠海马神经元细胞的吸光值下降为0.174 (P < 0.001),表明损伤模型建立成功。不同浓度的YBZc + STS预处理组增殖率明显高于STS模型组(P < 0.001),且增殖率随YBZc浓度升高而升高;不同浓度的YBZc与正常处理组比较无显著性差异(表2)。说明YBZc能减弱STS介导的乳鼠海马神经元损伤。

Table 2. The cell viability of each group with the treatment of different YBZc (n = 6)
表2. 不同浓度的YBZc对各组细胞存活率的影响(n = 6)
(注:*与对照组比,#与STS模型组比较;##或**P < 0. 01,###或***P < 0. 001)。
3.7.2. YBZc对STS介导的乳鼠海马神经元LDH释放率的影响
STS模型组的细胞毒性损伤程度明显大于对照组(P < 0.001);不同浓度的YBZc + STS预处理组的神经细胞毒性损伤程度明显低于STS模型组(P < 0.01)。结果表明,YBZc能减弱STS介导的乳鼠海马神经元损伤(表3)。

Table 3. Comparison of the degree of cell toxicity damage of each group analyzed by LDH release rate (n = 6)
表3. 各组LDH释放率及细胞毒性损伤程度比较(n = 6)
(注:*与对照组比,#与STS模型组比较;##或**P < 0. 01,###或***P < 0. 001)。
4. 结论
采用超声波辅助水提醇沉法从野巴子叶中提取野巴子粗多糖(YBZc),野巴子多糖的提取率为5.63%,糖醛酸含量为32.2%,蛋白质含量为2.98%。气相色谱分析结果表明YBZc的单糖组成为Rha、Ara、Man、Glc、Gal,相对摩尔比为1.000:0.793:0.440:0.557:0.994。YBZc的活性实验表明,在浓度达到3.2 mg/mL时,YBZc对∙OH、DPPH∙的清除率最大分别为50.14%、97.37%,且在一定的范围内存在量效关系;在浓度达到1.0 mg/mL时,YBZc对α-葡萄糖苷酶抑制效果最佳,为90.28%,且在一定的范围内存在量效关系。表明YBZc具有一定的清除∙OH和DPPH∙的活性以及降血糖效果。YBZc能减弱STS介导的乳鼠海马神经元损伤,具有对海马神经细胞的保护作用。
野巴子有多种生物活性,是新药物开发的优良材料。本实验研究显示,野巴子多糖具有较好的清除自由基、降血糖效果及神经保护作用,对于抗衰老、降血糖和神经保护的药物研发提供了依据,有利于对其属植物资源更好的开发与利用。本实验对野巴子多糖进行初步研究,对野巴子多糖的研究还有很多后续工作,包括野巴子多糖的分离纯化、一级结构及动物体内清除自由基活性的测定、神经保护作用机制的探究等,本实验室还会继续开展这些方面的研究工作。
基金项目
中央民族大学一流大学一流学科建设项目(YLDX01013);中央民族大学硕士研究生自主科研项目资助(182113)。