1. 引言
类胡萝卜素是一类8个类异戊二烯基本单位构成的碳氢化合物及其氧化衍生的脂溶性萜烯类化合物,呈现黄色、橙红色或红色,已被广泛应用于食品、保健品和医药等领域 [1] [2]。类胡萝卜素的多烯链赋予其抗氧化的特性,能够氧化单线态氧从而保护机体免受氧化损伤,具有抗氧化和防癌等生物学功效。大部分动物和人类不能自行合成类胡萝卜素,因此需要从食物中摄取类胡萝卜素,类胡萝卜素的来源多为植物和微生物 [3]。微生物生产类胡萝卜素与从富含类胡萝卜素的植物中提取相比,不受季节和生物量限制,且植物水含量较高导致类胡萝卜素提取效率较低 [4] [5],因此微生物已成为类胡萝卜素的主要资源来源。过去的几十年中,人们开发了物理或化学方法进行类胡萝卜素提取工艺,以期提高类胡萝卜素的提取效率,但是类胡萝卜素的抗氧化特性限制了其长时间暴露于热、光、酸等条件,类胡萝卜素的提取效率依旧较低,例如从红酵母中提取类胡萝卜素的提取率为50~350 μg/g CDW。从微生物中提取类胡萝卜素的限制因素主要为类胡萝卜素从细胞/细胞壁中释放及有机溶剂的萃取,酶解细胞为一种新型的细胞破壁可提高类胡萝卜素释放的方法,且酶的作用条件相对温和,对类胡萝卜素破坏作用较小。甘露聚糖是一种无色无味的以α-1,6糖苷键为主链α-1,2或α-1,3糖苷键为支链的高度分支的功能性多糖 [6],可免受肠道消化酶的水解 [7];甘露聚糖主要存在于酵母细胞壁外层,与膜蛋白共价结合,约占细胞壁干重的40%,具有抗肿瘤、抗辐射和抗氧化等功能,能够显著增强机体免疫力,刺激肠道益生菌生长及功效发挥;此外,甘露聚糖可作为天然的防腐剂,可在果蔬表面形成薄膜有效隔绝氧气和减少水分蒸发,并抑制果蔬表面微生物的生长繁殖从而保障果蔬保鲜。甘露聚糖主要来源于植物和酵母细胞壁,开发酵母源甘露聚糖可综合性利用酵母资源提高其附加值同时可解决工业废酵母的无害化处理问题。植物源甘露聚糖的提取多采取酸碱法,对环境有一定的污染,酵母源甘露聚糖的提取目前尚处于实验室阶段,并未形成成型的工艺,张澎湃等采用自溶法破碎啤酒废酵母细胞并通过热水浸提酵母甘露聚糖 [8]。红酵母是一类广泛分布于水域、细胞呈现红色或黄色的微生物,细胞富含类胡萝卜素和甘露聚糖,培养过程营养要求简单,因此红酵母成为了联合提取类胡萝卜素和甘露聚糖的重要微生物资源。甘露聚糖位于细胞外壁,类胡萝卜素为红酵母的胞内色素,因此,破碎细胞成为从红酵母中提取类胡萝卜素和甘露聚糖的障碍,本文以从渤海湾水域分离得到的一株海洋红酵母为研究材料,对其进行菌株的鉴定,并开展酶法破壁提取类胡萝卜素和甘露聚糖的研究。
2. 材料与方法
2.1. 菌株及主要试剂
海洋红酵母ZOR1:从渤海湾水域分离,光学显微镜下直径为4~5 μm酵母,菌落为橘红色,保存于本实验室。蜗牛酶(Ruibio)与胰蛋白酶(Phygene)为生物纯级;酵母菌基因组提取试剂盒(DP6201)购自BioTeke,酵母菌IST序列扩增引物和IST序列测序由北京三博远志生物技术有限责任公司完成。
2.2. 试验方法
2.2.1. 海洋红酵母鉴定
挑取斜面培养的海洋红酵母接入到改良LB培养基中(g/L:酵母浸膏粉 5,蛋白胨 10,NaCl 30, pH自然,121℃灭菌20 min),30℃、180 rpm摇床振荡培养24 h。取1 ml培养液于10,000 g室温下离心1 min,弃上清收集海洋红酵母菌体;采用酵母DNA提取试剂盒提取海洋红酵母总DNA,利用酵母IST引物(primer: 1 5’-TCCGTAGGTGAACCTGCGG-3’;primer: 2 5’-TCCTCCGCTTATTGATATGC-3’)和提取的ZOR1总DNA扩增酵母IST序列,PCR产物测序后,将测序拼接的序列进行BLAST比对并利用GEGA6.0软件建立菌株系统发育进化树。
2.2.2. 生物酶破壁并提取甘露聚糖和类胡萝卜素及测定
1) 甘露聚糖的提取
挑取活化好的海洋红酵母单菌落于改良的LB液体培养基中,180 rpm 30℃培养48 h,10,000 g离心3 min收集海洋红酵母菌体ZOR1,向海洋红酵母ZOR1菌体中加入山梨醇缓冲液配置的3%蜗牛酶溶液(1:2,m/v),37℃水浴处理1 h;酶作用结束后,10,000 g离心3 min,弃去上清并收集细胞碎片;向细胞碎片中加入等质量的蒸馏水,30℃水浴处理30 min,10,000 g离心3 min取上清,获得富集于水相的甘露聚糖溶液,在收集的水相中加入无水乙醇(1:5, v/v)4℃醇沉25 h,10,000 g离心3 min获得甘露聚糖沉淀粗品;向甘露聚糖沉淀中加入5倍质量的蒸馏水溶解,加入三氯乙酸至终浓度10% (m/v),置于冰上30 min,然后于4℃ 10,000 g 离心3 min,上清为含有甘露聚糖的溶液。
2) 甘露聚糖的测定
取提取的甘露聚糖溶液1 ml,加入57 μl硫酸并于100℃水浴水解7 h然后定容至100 ml;取两支试管A和B,在A试管中加入0.2 ml样品,0.2 ml NaCl-H3BO3溶液(12 g NaCl + 2 g H3BO3定容至100 ml)和0.1 ml蒸馏水;在B试管中加0.2 ml甘露糖溶液(样品)和0.3 ml蒸馏水。然后各加入浓H2SO4 4.5 ml轻轻摇匀,立刻置入70℃水浴中,准确计时25 min,取出用自来水冷却至室温。以蒸馏水为空白,在280 nm处测得吸光值ODA、ODB,二者之差为△OD [9] (计算公式中的x),甘露聚糖提取量可通过公式(1)计算得到:
甘露聚糖含量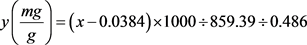 (1)
(1)
3) 类胡萝卜素的提取及测定
向提取甘露聚糖离心得到的细胞碎片中加入丙酮1:20 (m/v),35℃下浸提30 min,重复三次,10,000 g离心10 min获得提取液并将三次提取液合并得到类胡萝卜素提取液,测定合并液在470 nm的吸光值并通过(2)计算类胡萝卜提取量。
类胡萝卜素含量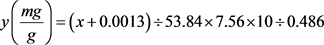 (2)
(2)
两阶段酶解破壁时,向提取甘露聚糖后的细胞碎片中加入0.6%的蛋白酶,37℃水浴30 min后再加入丙酮1:20 (v/v),35℃下浸提30 min,重复三次,10,000 g离心10 min获得提取液并将三次提取液合并得到类胡萝卜素提取液进行测定和计算。
3. 结果与讨论
3.1. 海洋红酵母ZOR1的鉴定
提取的海洋红酵母ZOR1总DNA作模板PCR扩增其IST序列,电泳结果表明扩增的IST序列约为700 bp (图1)。
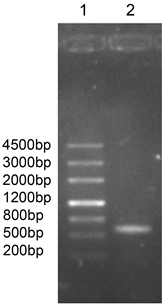
Figure 1. Amplified IST sequence of ZOR1
图1. ZOR1菌株IST序列PCR扩增图
将PCR产物进行测序并将测序得到的序列拼接,对拼接后序列进行BLAST比对,并采用邻接法建立其系统发育进化树(图2),该海洋红酵母菌株鉴定为海洋胶红酵母,并将其命名为Rhodotorula mucilaginosa ZOR1,该菌株保存于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC18364。
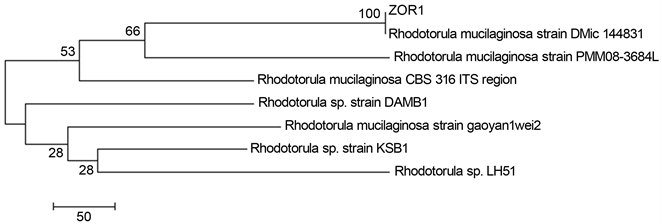
Figure 2. Phylogenetic tree of R. mucilaginosa ZOR1
图2. R. mucilaginosa ZOR1系统发育进化树
3.2. 生物酶破壁提取甘露聚糖和类胡萝卜素
甘露聚糖位于酵母细胞外壁,与蛋白结合在一起,因此细胞壁破碎有助于甘露聚糖的释放;同时细胞壁阻碍有机溶剂进入细胞溶解类胡萝卜素,因此从微生物细胞中提取甘露聚糖类胡萝卜素通常会对细胞进行物理或化学的预处理以消除细胞壁的物理障碍 [10]。甘露聚糖水溶性较高尤其是热水中,孔凌云等采用热水浸提法进行甘露聚糖的提取 [11]。Michelon等人的研究结果表明细胞壁的有效破坏将使类胡萝卜素的提取率提高8~10倍 [12] [13]。酶法破壁反应条件温和,操作简单易行且不易破坏提取的目标产物,是目前从微生物细胞内提取目标产物常用的破壁方法 [14]。蜗牛酶是来自于蜗牛消化道的混合酶,富含纤维素酶、果胶酶和蛋白酶等二十多种酶,可用于酵母细胞壁的破碎;酵母细胞壁中的多糖多数都是与蛋白结合形成糖蛋白结构,因此本研究采用蜗牛酶对R. mucilaginosa ZOR1细胞壁进行酶解处理,同时辅以蛋白酶共同作用。类胡萝卜素提取的溶剂选择多种多样,通常丙酮、二氯甲烷、乙醇和正己烷等分别用于提取极性和非极性类胡萝卜素,但是工业过程中考虑有机溶剂对人和环境的影响,则大多选择丙酮和乙醇作为类胡萝卜素提取溶剂而非选择正己烷和二氯甲烷等有机溶剂 [15] [16]。本研究选择使用蜗牛酶和蛋白酶进行细胞破壁后,先水提甘露聚糖然后丙酮提取类胡萝卜素,结果表明当蜗牛酶浓度为3%、蛋白酶浓度为0.2%作用R. mucilaginosa ZOR1细胞破壁时,甘露聚糖提取量可达到183 μg/g CDW,是无酶作用的对照甘露聚糖的提取量的10.36倍,是3%蜗牛酶作用甘露聚糖提取率的1.84倍(图3);随着蛋白酶浓度的继续增加则甘露聚糖的提取率呈现下降的趋势,分析原因可能为蛋白酶浓度增加对蜗牛酶有水解作用导致酵母菌细胞破壁效率下降从而导致甘露聚糖提取率下降。
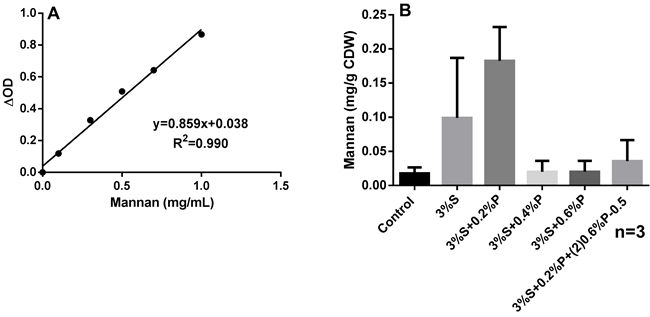
Figure 3. Effect of enzyme concentration on mannan extraction from R. mucilaginosa ZOR1. A: Standard curve of mannan, B: Effect of enzyme on mannan extraction (S and P indicated snailase and proteinase, respectively), 3%S + 0.2%P + (2) 0.6%P indicated that R. mucilaginosa ZOR1 lysis occurred with 3% snailase and 0.2% proteinase for 60 min and then with 0.6% proteinase for another 30 min
图3. 酶浓度对R. mucilaginosa ZOR1甘露聚糖提取的影响。A:甘露聚糖标准曲线,B:酶作用对R. mucilaginosa ZOR1甘露聚糖提取的影响(S和P分别表示蜗牛酶和蛋白酶),3%S + 0.2%P + (2) 0.6% P表示3%蜗牛酶 + 0.2%蛋白酶先作用海洋胶红酵母R. mucilaginosa ZOR1细胞破壁,提取甘露聚糖后的细胞碎片在此用0.6%的蛋白酶作用30 min
结果表明加入生物酶破壁后类胡萝卜素提取率都有不同程度的提高,3%蜗牛酶作用破壁后的类胡萝卜素提取率是对照的5.07倍,双酶作用随着蛋白酶浓度的增加类胡萝卜素的提取率增加,当3%蜗牛酶和0.6%蛋白酶作用R. mucilaginosa ZOR1时,类胡萝卜素提取率最高,为对照的7.53倍。此外,3%蜗牛酶 + 0.2%蛋白酶作用提取甘露聚糖后的细胞继续使用0.6%蛋白酶作用30 min,类胡萝卜素的提取率继续增加,为对照类胡萝卜素提取率的10.76倍,表明两阶段酶处理R. mucilaginosa ZOR1细胞有助于类胡萝卜素的提取(图4)。
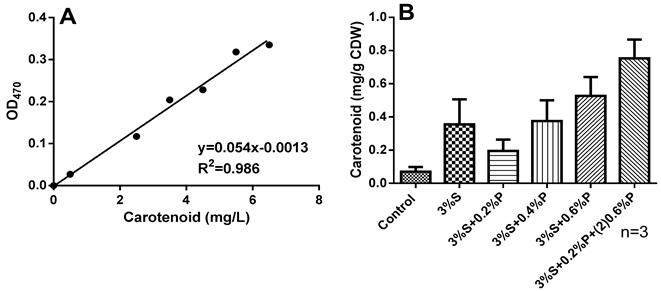
Figure 4. Effect of enzyme concentration on carotenoid extraction from R. mucilaginosa ZOR1. A: Standard curve of carotenoid, B: Effect of enzyme on carotenoid extraction (S and P indicated snailase and proteinase, respectively), 3%S + 0.2%P + (2)0.6%P indicated that R. mucilaginosa ZOR1 lysis occurred with 3% snailase and 0.2% proteinase for 60 min and then with 0.6% proteinase for another 30 min
图4. 酶作用对R. mucilaginosa ZOR1类胡萝卜素提取的影响。A:类胡萝卜素标准曲线,B:酶浓度对R. mucilaginosa ZOR1类胡萝卜素提取的影响(S和P分别表示蜗牛酶和蛋白酶),3% S + 0.2% P + (2) 0.6% P表示3%蜗牛酶 + 0.2%蛋白酶先作用海洋胶红酵母R. mucilaginosa ZOR1细胞破壁,提取甘露聚糖后的细胞碎片在此用0.6%的蛋白酶作用30 min
4. 结论
本文对从渤海海域筛选得到的一株海洋红酵母ZOR1的IST序列扩增测序和进化树建立,鉴定ZOR1为海洋胶红酵母,命名为Rhodotorula mucilaginosa ZOR1;3%蜗牛酶和0.2%~0.6%不同浓度蛋白酶作用R. mucilaginosa ZOR1后水提甘露聚糖和丙酮提取类胡萝卜素结果表明:3%蜗牛酶 + 0.2%蛋白酶作用R. mucilaginosa ZOR1后甘露聚糖提取率最高为对照的10.36倍,此条件下类胡萝卜素的提取率为对照的2.79倍;提取甘露糖后的细胞进一步使用0.6%蛋白酶作用,类胡萝卜素提取率达到最高,为对照的10.76倍。
基金项目
本项目由大学生创新训练计划项目资助(项目编号:CXXL2018397)。