1. 引言
多原发癌(Multiple Primary Carcinoma, MPC)又称重复癌,是指一个患者同时或先后发生两个或两个以上彼此无关的原发性癌。本文分析总结了同时性结肠多原发癌一例并文献学习,提示广大临床医师应提高对MPC的认识与重视,注意鉴别诊断,以免漏诊、误诊。
2. 病例资料
患者陈XX,男,83岁,因“反复便秘五年余”于2021年05月30日入院,平素无恶心、呕吐,无腹痛、腹胀,胃纳可,大便干结,量少,每周2~3次,无黑便。既往有“高血压”病史20余年,血压最高达254/139 mm Hg (1 mm Hg = 0.133 kPa),规律服“厄贝沙坦”控制血压;“2型糖尿病”病史6年余,规律服“阿卡波糖”控制血糖;“慢性肾功能不全”病史1年;吸烟史58年,30支/日;无结肠癌家族史。入院后心肺腹查体无异常。查肿瘤指标提示:癌胚抗原7.60 μg/L (吸烟人群0.00~6.30 μg/L;不吸烟人群0.00~4.30 μg/L)、肺非小细胞癌原6.5 ng/ml (正常值0.0~3.3 ng/ml),糖类抗原72-4、糖类抗原125、糖类抗原19-9、糖类抗原15-3水平均在正常范围内。患者完善腹部平扫 + 增强CT结果回报结肠肝曲肠壁局限增厚,增强扫描中度强化,相应肠腔狭窄,浆膜面欠光整,提示肝曲结肠癌侵犯浆膜。为进一步明确诊断,予完善结肠镜检查,镜下可见升结肠近肝曲处可见一菜花状环形肿物,触之质脆,易出血;距肛门约30 cm可见一大小约1.5 cm宽基息肉;提示升结肠癌、乙状结肠癌(见图1),分别将上述两处病灶分别取活检。结肠镜病理活检结果回报(升结肠)粘膜中–低分化管状腺癌、(乙状结肠)粘膜高级别上皮内瘤癌变(见图2),升结肠腺癌免疫组化:PMS2 (+),MSH6 (+),MSH2 (+),MLH1 (+)。初步诊断:1) 升结肠癌;2) 乙状结肠息肉恶变。
完善相关术前检查,排除手术禁忌证后,于2021-06-24全麻下行手术治疗,术中发现小肠肠管扩张明显,升结肠可见一癌肿,肿瘤侵透肠壁全层,质硬,难推动,其所在部位肠腔缩窄形成梗阻,符合术前诊断,行“腹腔镜右半结肠癌姑息切除术 + 回肠–横结肠侧侧吻合术”。术后病理诊断:(升结肠)溃疡型中分化管状腺癌,多发性结肠管状腺瘤(图3)。免疫组化:P53 (+),BRAF (−),Ki-67 (98%),MLH1 (+),PMS2 (+),MSH6 (+),MSH2 (+),最后诊断:1) 升结肠溃疡型中分化管状腺癌;2) 乙状结肠息肉恶变(同时性多原发癌)。术后予预防感染等对症支持治疗,患者恢复良好。术后2周患者病情稳定,予出院。随访一年患者复查胸部CT发现肺占位性病变,但未行经皮肺穿刺活检术,未明确肺部占位性质,后患者因呼吸衰竭死亡。
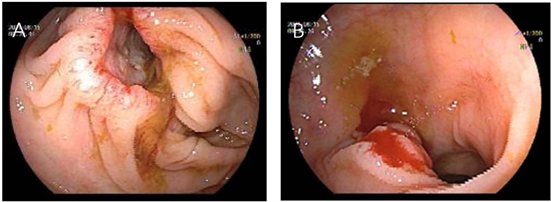
Figure 1. A colonoscopic view of ascending colon in patients with multiple primary sigmoid colon carcinoma. (A) Cauliflower-like annular mass of ascending colon; (B) Broad basal polyp of sigmoid colon
图1. 一例升结肠乙状结肠多原发癌患者结肠镜检图。(A) 升结肠菜花状环周形肿物;(B) 乙状结肠宽基息肉

Figure 2. Preoperative pathological biopsy. (A) (Ascending colonic mass) medium-poorly differentiated tubular adenocarcinoma; (B) (Sigmoid colon) high-grade intraepithelial tumor carcinoma of mucous membrane
图2. 术前病理组织活检。(A) (升结肠肿物)粘膜中–低分化管状腺癌;(B) (乙状结肠)粘膜高级别上皮内瘤癌变
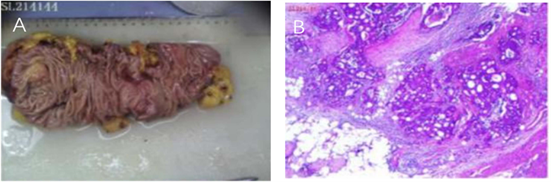
Figure 3. Postoperative pathological tissue. (A) Intraoperative resection of the right half colon gross view; (B) Moderately differentiated tubular adenocarcinoma of the ascending colon
图3. 术后病理组织。(A) 术中切除右半结肠大体观;(B) 升结肠溃疡型中分化管状腺癌
3. 讨论
MPC被定义为同一病人发生多个原发肿瘤,可分为同时性MPC和异时性MPC,所有癌肿在同时或6个月内获得诊断的称为同时性MPC,发现首发癌后超过6个月获得诊断的称为异时性MPC [1] 。根据Waren & Gate提出的诊断标准:1) 每个肿瘤经病理证实均为恶性;2) 肿瘤位于不同部位且癌灶间有正常组织分隔开;3) 排除转移癌的可能性。本病例同时发现升结肠管状腺癌、乙状结肠粘膜高级别上皮内瘤癌变,符合同时性MPC的诊断标准,诊断同时性结肠MPC明确。
近年来,随着诊疗技术进步、人口老龄化以及癌症患者生存率提高,多原发癌的检出率高达5%~10% [1] [2] 。MPC的发病病因复杂,根据病因相关,MPC可大致分为三类,第一类是与肿瘤治疗因素相关,比如经过放射治疗后在放射区域内或边缘产生的MPC。第二类是综合征相关,比如林奇综合征、家族性腺瘤性息肉病等。第三类是与遗传易感性或环境因素相关,有研究表明吸烟、酗酒、亚硝胺类食物、免疫力下降等因素均可诱发MPC [3] 。根据“区域癌化”理论,结肠MPC的发生可以理解为结肠全程是一个处于癌化不同阶段的区域组织,当各种致病因素积累到一定程度,结肠的不同部位便会先后或同时出现一个或多个癌灶 [4] 。目前下一代测序技术发展日渐成熟,与传统的组织病理学评估相比,基因测序技术可能是一种更准确的诊断和预后工具,可以更好地指导治疗和预测结果。有报道认为MPC患者相比单发癌症患者更容易存在致病性基因突变,建议MPC患者应进行基因检测和遗传咨询 [5] 。MPC的发生可能与MLH1/MSH2、MMR、EGFR、PTEN、BRCA1/2、CHEK2和TP53等基因突变有关 [6] 。其中MMR突变已被证实与结直肠多原发癌密切相关。MMR是DNA错配修复基因,能够准确地识别及修复在DNA复制或重组过程中产生的碱基错配,维持基因组稳定 [7] 。而MMR突变使DNA错配没有充分修复,导致基因组不稳定,使整个基因组中短而简单的重复DNA序列极具可变性,这被称为微卫星不稳定性(Microsatellite Instability, MSI),MSI增加了MPC发生的风险 [8] 。TP53基因是一个重要的肿瘤抑制靶点,在细胞检查和周期调节中发挥重要作用,当其突变时可产生突变的P53蛋白。不同于正常的P53蛋白的是,突变的P53蛋白会促进肿瘤细胞的增殖与存活,为癌细胞提供免疫逃逸的能力。大部分的肿瘤可存在P53突变,其中亦包括多原发肿瘤 [9] 。在一例病例报告中,研究人员对一名罹患三重癌的患者进行了三处癌组织基因测序,结果显示这三处癌灶分别具有5个不同的TP53基因突变 [10] 。综合来说,我们可以认为MPC的发生是修复缺陷和遗传不稳定多因素共同作用所致。本例患者为老年男性,有长期吸烟史,无结肠癌家族史,既往无放、化疗治疗史,升结肠免疫组化结果显示错配修复基因稳定,PMS2,MSH6,MSH2,MLH1均表达,病因可排除肿瘤治疗相关与林奇综合征。因此我们推测该患者可能具有肿瘤多中心发生的易感性,建议患者完善基因检测,但由于基因检测成本较高,本例患者因经济原因未进行基因检测。
多原发癌与单发病灶肿瘤学特征相似,提示多原发癌可能与单发癌恶性程度相当 [11] 。本例患者两处癌灶分别位于乙状结肠、升结肠,这与单发结肠癌的好发部位相一致,且术后病理结果提示升结肠溃疡型中分化管状腺癌以及乙状结肠粘膜高级别上皮内瘤癌变,与单发结肠癌的好发部位及病理特征相一致,亦符合上述肿瘤学特征。MPC治疗原则不同于复发、转移肿瘤,MPC患者根治性手术切除后生存率与单发恶性肿瘤患者相近,应采取与单发恶性肿瘤一致的治疗原则 [12] 。但对于基础疾病较多的老年人,如本例患者,既往有高血压、糖尿病以及慢性肾功能不全病史,应综合心内科、内分泌科以及肾内科等多学科讨论基础上,制定个体化治疗方案。异时性结肠MPC患者第一原发癌与第二次原发癌的发生密切相关,本例患者随访1年发现肺占位性病变,但因患者及患者家属拒绝行经皮肺穿刺病理活检,无法明确该处占位为转移或第三原发癌。故对于初诊单发肿瘤的患者应进行严密随访,有助于及时发现新的原发肿瘤以及注意与转移瘤鉴别。
综上所述,在临床诊疗过程中,临床医师对不典型症状应予以重视,详细询问病史,尽可能完善全方面的检查;对有结肠癌可疑症状的患者进行结肠镜检查时,应仔细观察,特别是结肠癌好发肠段,不应只满足于单一病灶的发现,以免延误诊治。另外,老年人也应定期进行健康查体,对早期诊治以及改善预后有重要意义。