1. 引言
甘油脱氢酶是甘油代谢途径中的关键酶。在甘油氧化途径中,甘油脱氢酶氧化甘油获得二羟基丙酮(dihydroxyacetone,DHA),进一步代谢生成细胞生长所需的中间产物。这一代谢过程是以甘油为底物生长的微生物的共同代谢途径,进入糖酵解途径,作为碳源为微生物生长提供ATP和NADH [1] 。甘油脱氢酶可应用于酒类中甘油浓度监测与人体血脂浓度检测等,其主要产物二羟基丙酮是一个重要的化学中间体,可广泛用做医药、农药的中间原料,以及化妆品和食品添加剂等 [2] ,因此,甘油脱氢酶的研究受到广泛关注。
根据催化反应中产物和电子受体的不同,GDH可分为三种类型 [3] 。第一种为依赖NAD+的GDH。这种GDH主要存在于各种细菌中,如Aerobacter aerogenes、Escherichia coli、Bacillus substilis和cellulomonas sp.等。第二种为依赖NADP+的GDH (EC1.1.1.72 和EC1.1.1.56),将甘油氧化为DHA或甘油醛,这类GDH大多存在于霉菌和动物组织中 [4] 。第三种为不依赖辅酶位于细胞膜上的GDH,也可将甘油转化为DHA,在醋酸菌中发现存在这类GDH [5] 。能将甘油转化为1,3-PD的主要微生物(如克雷伯杆菌属、柠檬菌属及梭状芽孢杆菌属)普遍含有第一种GDH,它与GDHt、PDOR构成合成1,3-PD的关键酶系。
Sergey N. Ruzheinikov [6] 等在2001年测得B. stearothermophilus甘油脱氢酶晶体结构,该酶有370个氨基酸残基,分子量为39.5 kDa。分析游离酶和与甘油及NAD+复合物的结构,表明GDH的活性位点位于酶的两个结构域的裂缝之间,Zn2+离子负责稳定催化反应的醇盐中间体。由于甘油所有羟基的配体都指向连接在活性中心的锌原子上,因此该酶对一系列二醇具有催化专一性。结构的分析表明在N端和C端结构域中间有一个含有Greek key螺旋簇的深沟,N端结构域是背向着这个裂缝的,而α6-α8簇则形成了这个裂缝的底部。而Zn2+离子结合在这个裂缝的底部,并通过离子偶极作用分别和173位的天冬氨酸、256位的组氨酸和274位的组氨酸以及一个水分子相互作用。对于III家族酶的保守序列分析表明虽然在侧面序列上有所不同,这三个酶-锌离子之间的连接在这个锌依赖家族中是保守的。
酶催化的多功能性(Catalytic promiscuity)是指酶的活性位点可以催化除了天然反应外第二种反应或更多种反应的能力 [7] 。近年来研究发现越来越多的酶具有多功能性,受到广泛关注。研究表明,大部分的酶是由具有较广范围的底物的原始酶进化而来,分化与进化过程中,酶的专一性和选择性逐渐提升 [8] 。在催化天然底物的过程中,往往酶的多功能性被掩盖;在非天然底物或反应条件下,酶的多功能性显现 [9] [10] 。研究酶的多功能性不仅有利于研究酶的构效关系以及次级代谢产物的合成代谢途径,并且能拓展生物催化剂的适应范围,丰富生物催化与转换的途径。酶催化多功能性对于酶的结构、功能进化研究也具有极其重要的意义 [11] 。
本文研究甘油脱氢酶这一广泛存在的酶的催化多功能性。以来源于Bacillus stearothermophilus的甘油脱氢酶为模型酶,首先以生物信息学的方法,挖掘已经报道的甘油脱氢酶的底物谱;其次在底物谱中筛选目标底物分子,基于分子对接技术研究底物分子与酶活性中心的相互作用,考察甘油脱氢酶活性中心结构与催化多功能性之间的关系。为今后甘油脱氢酶的结构改造以及用途拓展奠定基础。
2. 材料与方法
2.1. 材料来源与工具
酶的序列及结构信息来源于网上共享的生物信息学数据库,如NCBI,PDB,SWISS-MODEL,ExPASy等。对接分析软件为Autodock 4.0。底物谱数据来源于Brenda。
2.2. 方法
2.2.1. 蛋白质立体结构分析
本次研究利用PyMOL 1.0和Vision 1.54这两种软件打开从PDB下载的蛋白质空间立体结构文件,实现辅基选择,活性位点结构观察等作用。以来源于Bacillus stearothermophilus的甘油脱氢酶(PDB ID 1JQ5)与小分子进行对接。
2.2.2. 分子对接
使用Autodock 4.0作为对接软件,设定柔性可旋转键为ASP173,HIS256,HIS274。Grid Box参数为X 50,Y 50,Z 50,X center 20.597,Y center 29.369,Z center 19.783,精度为0.375。
3. 结果与分析
3.1. 甘油脱氢酶底物谱分析
通过Brenda数据库搜索获得甘油脱氢酶的底物谱。甘油脱氢酶的底物谱较为宽泛,其中部分底物列出如表1所示 [12] 。除了天然底物甘油外,还包括文献报道的多种短链多羟基醇、氨基醇等。我们选取与天然底物甘油结构相近,具较高工业应用价值的重要手性医药中间体,含氨基、羟基双功能基团的手性对映体R-1-氨基-2-丙醇(R-1-amino-2-propanol)和S-1-氨基-2-丙醇(S-1-amino-2-propanol)作为模型底物对接配体 [13] 探寻甘油脱氢酶的催化多功能性。
3.2. 甘油脱氢酶与底物的对接
分子对接是依据底物与酶作用的“锁-钥原理”模拟配体小分子与受体生物大分子的非共价相互作用的计算机模拟技术。分子对接程序Autodock可以预测小分子与已知蛋白的结合,广泛应用于药物筛选和酶的底物谱研究。AutoDock采用半柔性对接方法(允许小分子构像发生变化)以结合自由能评价对接结果。用于能量优化的拉马克遗传算法(LAG)是遗传算法与局部搜索方法的结合(以遗传算法迅速搜索势能面,用局部搜索方法对势能面进行精细的优化) [14] 。
用Autodock 4.0对甘油脱氢酶和R-1-氨基-2-丙醇对接结果进行分析,共运行100次,得到100个对接结果。由于结合能量越低,小分子与酶的状态越稳定,在真实情况中发生的可能性也越高。选取前十

Table 1. Substrates specificity of glycerol dehydrogenase (section) [12]
表1. 甘油脱氢酶(EC1.1.1.6)的底物谱(部分) [12]
个能量最低的结果进行分析发现参与形成氢键的氨基酸残基集中在ASP123,THR177,SER243,GLU180上。从出现频率分析,ASP123最多,其次是THR177和SER243,可知ASP123,THR177,SER243是参与形成氢键的主要残基。其位置如图1中标注所示。
利用同样的方法对甘油脱氢酶和R-1-氨基-2-丙醇对接结果进行分析。甘油脱氢酶与S-1-氨基-2-丙醇结合,形成氢键的蛋白质残基主要集中在GLU180,ASP123,SER243上,THR177,SER121,ASP173,THR122等残基也有参与氢键的形成(图2)。相比R-1-氨基-2-丙醇的对接结果,参与氢键形成的残基增加了SER121和THR122。并且上述残基出现的频率也与R-1-氨基-2-丙醇的不同。其中ASP123依然是最多的,其次是SER243和GLU180。由图1和图2可知,SER243,ASP123,THR122,SER121和THR177,GLU180,ASP173分居活性反应部位裂缝两侧,形成口袋状包裹态,锌离子位于中心部位。
3.3. 结合自由能计算
图3为R-1-氨基-2-丙醇与甘油脱氢酶活性中心在对接过程中出现概率较高的常见结合构型,结合能为−5.11 kcal/mol,共有三个氢键形成。R-1-氨基-2-丙醇的羟基与甘油脱氢酶的ASP123形成一个氢键,氨基分别与甘油脱氢酶的ASP123和另一个残基SER243或THR177各形成一个氢键。
图4为S-1-氨基-2-丙醇与甘油脱氢酶结合出现概率较高的常见结合构型图。结合能量为−5.01 kcal/mol,共共有两个氢键,有一个是配体上羟基的H9原子与GLU180形成的氢键,一个是配体氨基上氢原子H7与ASP123形成的氢键。由图3,图4可知,甘油脱氢酶的活性中心更容易与R-1-氨基-2-丙醇结合。酶对手性底物的选择性由酶活性中心的口袋形状决定,根据底物的与活性中心部位的契合程度和形成的氢键数目,可以推测酶对底物的催化活性。
3.4. R-1-氨基-2-丙醇、S-1-氨基-2-丙醇的对接结果分析对比
对R-1-氨基-2-丙醇与S-1-氨基-2-丙醇这一对手性对映体与甘油脱氢酶的对接结果进行比较(表2)。

Figure 1. Binding profile of R-1-amino-2-propanol and glycerol dehydrogenase
图1. 甘油脱氢酶与R-1-氨基-2-丙醇的结合示意图
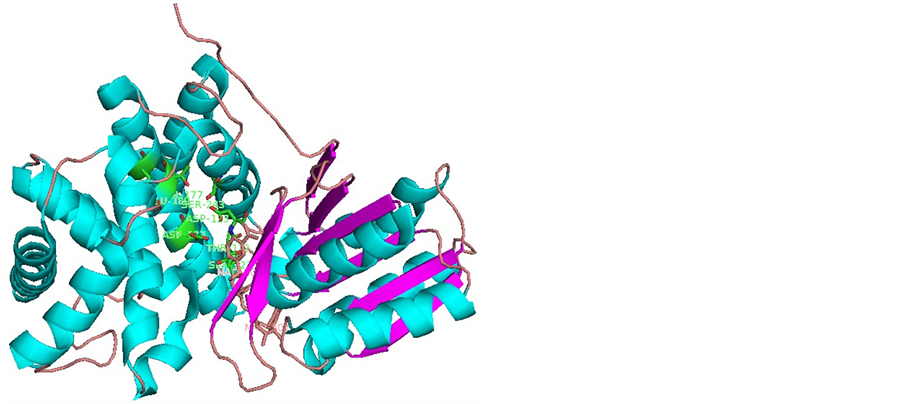
Figure 2. Binding profile of S-1-amino-2-propanol and glycerol dehydrogenase
图2. 甘油脱氢酶与S-1-氨基-2-丙醇的结合示意图
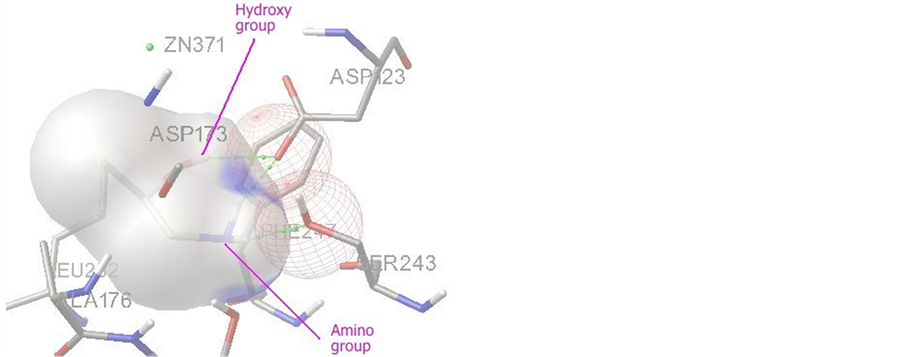
Figure 3. Interaction mode of R-1-amino-2-propanol with the active site of glycerol dehydrogenase
图3. R-1-氨基-2-丙醇与甘油脱氢酶活性中心的结合模式
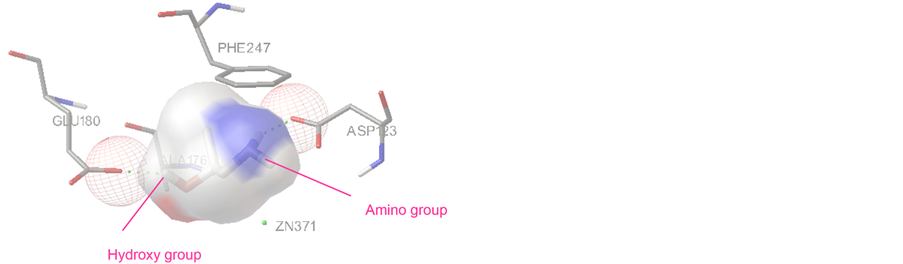
Figure 4. Interaction mode of S-1-amino-2-propanol with the active site of glycerol dehydrogenase
图4. S-1-氨基-2-丙醇与甘油脱氢酶活性中心的结合模式

Table 2. Comparison of docking results of R-1-amino-2-propanol and S-1-amino-2-propanol
表2. R-1-氨基-2-丙醇与S-1-氨基-2-丙醇对接结果比较
分子对接同时考虑了分子间的几何构型和能量的匹配与识别能力。手性对映体由于其几何构型不同,与酶结合时匹配性质和结合能力存在差异,从而使对接结果中的结合能有一定的差异。R-1-氨基-2-丙醇的最低结合能量比S-1-氨基-2-丙醇的低,在一定程度上验证了文献 [13] 关于甘油脱氢酶对R-1-氨基-2-丙醇的催化活性高于S-1-氨基-2-丙醇的实验结果。
通过比较底物和酶的最高结合能量和最低结合能量可知,R-1-氨基-2-丙醇与酶的最高结合能和最低结合能均低于S-1-氨基-2-丙醇,说明前者更容易与甘油脱氢酶结合。甘油脱氢酶与R-1-氨基-2-丙醇结合比S-1-氨基-2-丙醇结合紧密。酶活性部位的关键氨基酸残基对酶的手性立体选择性有重要作用。甘油脱氢酶与底物结合的关键氨基酸残基位点,包括ASP123,THR177,SER243和GLU180,主要作用在于与底物结合时形成氢键。这可能就是甘油脱氢酶优先选择催化R-1-氨基-2-丙醇的原因。
4. 结论
基于甘油脱氢酶和手性小分子底物的分子对接,初步探索了甘油脱氢酶与手性对映体R-1-氨基-2-丙醇,S-1-氨基-2-丙醇结合。获得了甘油脱氢酶与底物结合的关键氨基酸残基位点ASP123,THR177,SER243和GLU180。通过比较手性底物与酶对接,结合文献报道的实验数据的差异,阐明甘油脱氢酶对R-1-氨基-2-丙醇,S-1-氨基-2-丙醇选择性的来源。
结果表明分子对接可以反映甘油脱氢酶对手性化合物的识别能力,可用作甘油脱氢酶的手性底物谱的初步筛选手段,节省研究时间和成本。为进一步研究甘油脱氢酶的催化多功能性,拓宽甘油脱氢酶的应用打下基础。
致谢
感谢国家自然科学基金面上项目(No. 41176111),国家自然科学基金青年项目(No.41306124),国家自然基金重点项目(No. 21336009)和中央高校基本科研业务费(No. 2013121029)的支持。