1. 引言
黑米是禾本植物稻经长期培育形成的一类特色品种,是我国一种药、食兼用的大米 [1] 。黑米本身具有很高的药用和营养价值,不仅含有人体所必需的丰富的蛋白质、不饱和脂肪酸和维生素等营养元素,更含有普通大米所缺乏的胡萝卜素、叶绿素及花青素等特殊成分 [2] 。黑米花青素的含量高,且其主要单体是C3G [3] 。如何有效地提取纯化出C3G是目前研究的焦点之一。传统的花青素提取方法主要有:水浸提法和有机溶剂提取法等,而酶法提取是一种简单迅速、创新的提取方法,利用相关的酶破坏植物细胞,促使有效物质快速溶出。目前,已广泛应用于生物活性物质提取领域 [4] 。
花青素是一种安全性高、无毒、纯天然的植物色素,可被添加到食物中,但易受光照、温度、pH等因素的影响而氧化及分解 [5] 。如何提高花青素的稳定性成为亟待解决的问题。咖啡酸、阿魏酸和香豆酸等有机酸可作为辅色剂,提高花青素颜色稳定性 [6] [7] 。本试验采用酶法提取黑米中的花青素,并采用响应面分析优化提取工艺,考察酶添加量、温度、时间及液料比对花青素得率的影响,得到最佳工艺条件 [8] 。利用树脂纯化及半制备液相色谱得到C3G,进而研究氨基酸对C3G的辅色作用。
2. 材料与方法
2.1. 材料与试剂
黑米(Oryza sativa L.):市售,产自黑龙江省五常市,购于安徽燕之坊食品有限公司;甲醇(色谱级)、甲酸(分析纯):国药集团化学试剂有限公司;乙腈(色谱级):美国Tedia公司;氨基酸(Leu,Cys,Trp及Met):上海阿拉丁生化科技股份有限公司;α-淀粉酶(100 U/mg)、纤维素酶(50 U/mg)和酸性蛋白酶(100 U/mg)、AB-8大孔树脂和30~60目聚酰胺树脂:上海源叶生物科技有限公司;柠檬酸、柠檬酸钠等试剂为分析纯。
2.2. 仪器与设备
CP214先行者分析天平:奥豪斯国际贸易(上海)有限公司;HX-300型高速中药粉碎机:浙江省永康市溪岸五金药具厂;TG16G高速离心机:盐城市凯特实验仪器有限公司;KRT-NT-2-1多功能膜设备:合肥科锐特环保工程有限公司;LGJ-12冷冻干燥机:北京松源华兴科技发展有限公司;4802 UV/VIS双光束分光光度计:尤尼柯(上海)仪器有限公司;E2695高效液相色谱仪:美国Waters公司;HP PLUS 100D半制备型液相色谱仪:利穗科技(苏州)有限公司等。
2.3. 方法
2.3.1. 黑米花青素提取工艺流程 [9] [10]
黑米→粉碎→过筛→细磨→水浴浸提→滤袋过滤→滤液→超滤→渗出液→大孔树脂吸附→乙醇洗脱→洗脱液→减压浓缩→聚酰胺树脂吸附→乙醇洗脱→洗脱液→减压浓缩→冷冻干燥→花青素
人工去除黑米中的杂质,称取适量黑米,用高速中药粉碎机粉碎25 s,过60目筛,收集过筛物,将渣子再粉碎1~2次,重复之前的步骤,将两次得到的黑米皮混合均匀备用。按液料比5:1加3.5%柠檬酸水溶液,用胶体磨细磨使物料粒度在5~25 mm。控制α-淀粉酶添加量,在一定温度下水浴浸提一段时间后使用滤袋过滤,取滤液备用。将滤液进行超滤,除去蛋白质、多糖等大分子物质,收集流出液备用。经AB-8大孔树脂和30~60目聚酰胺树脂分离纯化后,收集洗脱液减压浓缩,经过真空冷冻干燥得到紫红色的花青素粉末即为花青素纯品。
2.3.2. pH示差法测定花青素含量
花青素的得率采用pH示差法 [11] 。
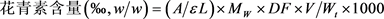 (1)
(1)
式中:A——
;ε——C3G的消光系数,26900;L——光程,0.5 cm;DF——稀释因子;MW——C3G分子量,449.2;V——最终体积,mL;Wt——产品重量,mg。注:蒸馏水作参比(A700nm)消除样液混浊的影响。
2.3.3. 单因素及响应面试验设计
以花青素得率为指标,以柠檬酸浓度(1.5%、2%、2.5%、3%、3.5%、4%、4.5%和5%)、酶的添加量(20 U/mL、40 U/mL、60 U/mL、80 U/mL、100 U/mL、120 U/mL、140 U/mL和160 U/mL)、温度(30℃、35℃、40℃、45℃、50℃、55℃、60℃和65℃)、时间(20 min、40 min、60 min、80 min、120 min、140 min和160 min)及液料比(4:1 mL/g、6:1 mL/g、8:1 mL/g、10:1 mL/g、12:1 mL/g、14:1 mL/g、16:1 mL/g和18:1 mL/g)为因素,其余条件保持相同,分别进行单因素试验 [12] [13] ,考察各因素对酶法提取黑米花青素得率的影响
响应面法试验设计采用Box-Behnken模型,在单因素试验基础上,利用Design-Expert 8.0软件对黑米花青素提取条件进行Box-Behnken试验优化,柠檬酸浓度影响体系的pH值,仅需保证体系的pH能维持花青素的稳定性,及酶的作用即可,对提取率影响不大。故选择酶添加量(A)、温度(B)、时间(C)及液料比(D)为响应因素,设计4因素3水平试验见表1,以得出黑米花青素最佳提取条件 [14] 。

Table 1. Experimental variables and levels for Box-Behnken design
表1. 响应面试验因素水平及编码
2.3.4. 高效液相色谱法(HPLC)测定花青素的纯度及C3G的制备
按最优工艺条件提取花青素,树脂纯化后,得到黑米花青素粉末。采用高效液相色谱法测定花青素的纯度,色谱条件:流动相A为5%甲酸水溶液,B为乙腈。色谱柱类型:UItimate XB-C18,梯度洗脱:0~5 min,5~10 % B;5~10 min,10 % B;10~17 min,10~24 % B;17~27 min,24~90 % B;27~30 min,90 % B;30~35 min,90~5 % B;35~45 min,5 % B。进样量:10 µL;流速:1 mL/min;柱温40℃;检测波长:280 nm、520 nm。半制备液相色谱制备C3G,色谱条件:同HPLC法,收集波长:520 nm、检测波长280 nm,进样量:5.0 mL和流速:8 mL/min。
2.3.5. 氨基酸对C3G的辅色作用
分别配制0.5%氨基酸(Leu、Cys、Trp及Met)水溶液,用1 mol/L柠檬酸调pH至3.0;称取0.05%矢车菊素-3-O-葡萄糖苷溶于20 mmol/L柠檬酸缓冲溶液(柠檬酸、柠檬酸钠和苯甲酸钠,pH 3.0),添加200 mM氯化钙溶液,使溶液的Ca2+离子强度为0.02%。将氨基酸溶液和花青素溶液以体积比1:1混合,再加入0.1%L-抗坏血酸,充分搅拌至溶解,调节pH至3.0。体系成分为0.25%氨基酸、0.025%花青素、0.05%抗坏血酸和0.01%钙盐,以不添加氨基酸的体系为对照 [15] 。
样品在40℃自然光条件下贮存5天,分别测定0 d、1 d、2 d、3 d、4 d和5 d的吸光值(A520 nm),测量体系在0和5 d的L、a及b值,根据公式: ,其中ΔL*、Δa*、及Δb*贮藏5天后L、a及b值与初始值的差距,得到ΔE*;根据每天的A520 nm进行花青素的降解动力学计算,确定是否符合零级或一级反应,确定反应速率常数(k)和平均半衰期(t1/2) [16] 。
,其中ΔL*、Δa*、及Δb*贮藏5天后L、a及b值与初始值的差距,得到ΔE*;根据每天的A520 nm进行花青素的降解动力学计算,确定是否符合零级或一级反应,确定反应速率常数(k)和平均半衰期(t1/2) [16] 。
2.3.6. 统计学分析方法
采用SPSS 20.0统计软件进行分析,数据以均数 ± 标准差(x ± s)表示。多组间比较采用方差分析,均数间两两比较采用LSD-t检验。
3. 结果与分析
3.1. 单因素试验结果
3.1.1. 酶的种类对花青素得率的影响
由图1可得,与空白组(未添加酶)相比,α-淀粉酶的添加显著提高了花青素的得率,而纤维素酶和酸性蛋白酶提高不明显。当α-淀粉酶添加量为100 U/mL时,得率最大是1.4526‰。这是因为黑米中主要成分是淀粉,纤维素和蛋白质含量少,采用α-淀粉酶将淀粉大分子物质水解成小分子物质,使花青素暴露出来,更易被提取,故选择α-淀粉酶作为花青素提取酶。
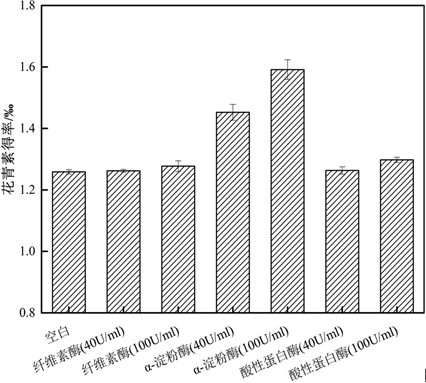
Figure 1. Effect of enzyme types on anthocyanin yield
图1. 酶的种类对花青素得率的影响
3.1.2. 柠檬酸浓度对花青素得率的影响
由图2可得,当柠檬酸浓度为0%~3.5%时,花青素得率呈上升趋势;之后再增加柠檬酸浓度,花青素得率反而缓慢下降。因为花青素是一种多酚类物质,含有很多的酚羟基,在较温和的酸性条件下容易与水分子形成分子间氢键,从而增加花青素的溶解性,酸性过强时容易造成氢键断裂,降低花青素溶解度,故选择柠檬酸浓度为3.5%,即pH为3左右。
Figure 2. Effect of citric acid concentration on anthocyanin yield
图2. 柠檬酸浓度对花青素得率的影响
3.1.3. 酶的添加量对花青素得率的影响
由图3可得,当酶的添加量在20~100 U/mL时,随着酶添加量的增加,花青素的得率不断上升。当酶添加量为100 U/mL时,得率最高为1.5926‰。当添加量继续增加,得率反而有下降趋势。由于在低的酶添加量下,酶与底物尚可充分的结合;但底物是一定的,随着酶添加量的增加,其不能使酶达到饱和,导致了酶的作用受到了抑制 [17] ,故选择酶的添加量为100 U/mL。

Figure 3. Effect of enzyme addition on anthocyanin yield
图3. 酶的添加量对花青素得率的影响
3.1.4. 温度对花青素得率的影响
由图4可知,当温度在30℃~50℃时,花青素得率随温度的升高而迅速增加,当温度达到50℃时,得率最大为1.6301‰;但随着温度的进一步升高,得率随之下降。因为花青素的稳定性和α-淀粉酶的活性受到温度的影响,花青素在高温时不稳定易分解;适当地升高温度增加了溶液的热能,进而增强了酶的作用,但温度过高会导致酶蛋白的变性及花青素的氧化分解,因此,选择温度为50℃。

Figure 4. Effect of temperature on anthocyanin yield
图4. 温度对花青素得率的影响
3.1.5. 时间对花青素得率的影响
由图5可知,当时间在0~120 min内,花青素的得率随着时间的增加迅速提高,并在120 min达到最大为1.6823‰;之后,基本保持不变。因为在0~120 min内,黑米中的淀粉被α-淀粉酶水解,使被淀粉包裹的花青素释放出来,随着时间的增加得率逐渐提高,当反应达到一定阶段,淀粉已被充分水解,花青素完全溶解在溶剂中,继续增加酶解时间,得率基本不变,所以选择提取时间为120 min。

Figure 5. Effect of extraction time on anthocyanin yield
图5. 时间对花青素得率的影响
3.1.6. 液料比对花青素得率的影响
由图6可知,当液料比在4:1~16:1内,花青素得率随提取剂体积的增加而提高,当液料比为16:1时,花青素得率达到最大为2.1808‰,之后随着提取剂体积的增加,得率缓慢下降。表明液料比在16:1时,花青素大量溶解在提取剂中,再增加提取剂体积,花青素不会继续溶出,得率反而有所下降,选择液料比为16:1 mL/g。
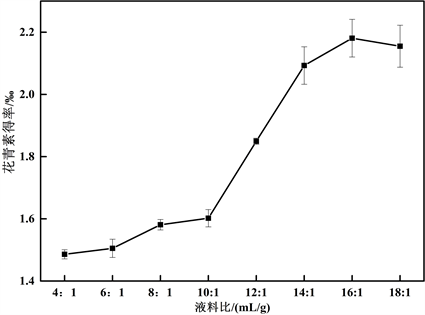
Figure 6. Effect of liquid to solid ratio on anthocyanin yield
图6. 液料比对花青素得率的影响
3.2. 响应曲面分析结果
3.2.1. 响应曲面试验设计方案及结果
通过单因素试验,确定最佳单因素试验条件范围,以此为基础,为获得最佳的提取工艺条件,研究酶添加量、温度、时间及液料比对花青素提取效果的影响,结果如表2所示。经过多元回归拟合,获得拟合方程为:

Table 2. Experimental design for response surface analysis and corresponding results of anthocyanin extraction
表2. 黑米花青素提取试验设计及结果
3.2.2. 回归模型的方差分析
回归模型的方差分析如表3所示。试验选用的模型极显著P < 0.01,失拟项不显著P = 0.7152 > 0.05,说明模型是有效的;模型的校正决定系数
,说明该模型能解释90.37%响应值的变化,有总变异大约9.63%不能用该模型来解释;相关系数R2 = 0.9468,说明该模型拟合程度良好,预测值与实测值之间有较好的相关性,试验误差小,可以用该模型来分析和预测黑米花青素的提取率。

Table 3. Variance analysis and significance test of regression model for anthocyanin extraction
表3. 回归模型的方差分析及显著性检验结果
Continued
注:N表示没有显著性,P > 0.05,*差异显著,P < 0.05;**差异极显著,P < 0.01。
在设定的29组试验中最小的响应值为1.079‰,最大值为1.724‰。由表3回归方程系数显著性检验可知,在此试验设计中,一次项X1显著(P < 0.05),X3极显著(P < 0.01),二次项X2X3显著,X1X3极显著,X12、X22、X32、X42极显著,其余项均不显著。影响花青素提取得率的各因素主次顺序为:时间 > 酶的添加量 > 液料比 > 温度。
3.2.3. 响应面交互作用分析
回归模型的响应曲面及等高线如图7所示。花青素的得率均随着提取条件值的增加呈现先增加后减少的趋势,并且响应曲面的坡度越陡峭,说明交互效应越显著。可以看出,图7 B的曲线较为陡峭,而图7 A的曲线次之,故酶添加量和时间的交互作用极显著(P < 0.01),而酶添加量和温度的交互作用显著(P < 0.05)。随着酶添加量的增加得率呈增加趋势,随后略微下降。这表明通过增加酶分子活性位点数目可使更多底物分子转化成产物,但是过高的酶量可能造成扩散限制和传质限制 [18] 。在一定范围内,提高温度可促进底物分子和酶之间的碰撞,得率明显增加。随着时间的增加,得率呈增加趋势,随后保持稳定。酶促反应需要一定的时间,达到饱和状态后,得率不再受时间影响。
 固定水平:时间153.51 min、液料比14.59 mL/g A:酶添加量(X1)与温度(X2)
固定水平:时间153.51 min、液料比14.59 mL/g A:酶添加量(X1)与温度(X2)
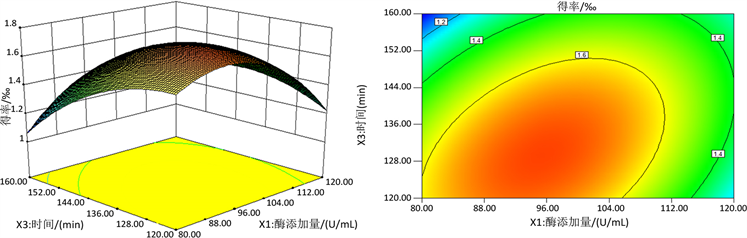 固定水平:温度50.68℃、液料比15.14 mL/g B:酶添加量(X1)与时间(X3)
固定水平:温度50.68℃、液料比15.14 mL/g B:酶添加量(X1)与时间(X3)
Figure 7. Response surface and contour map of pairwise interactive effects of various factors
图7. 各因素交互作用的响应面与等高线图
3.2.4. 最优提取条件及模型验证
确定花青素提取的最佳工艺参数为:酶添加量94.05 U/mL、温度48.74℃、时间126.42 min和液料比13.86:1 mL/g。在此工艺条件下,花青素的预测得率最大为1.7734‰。为了检测响应面法所得结果的可靠性,采用上述最佳工艺条件对黑米花青素进行提取,考虑到实际可操作性,将酶的添加量调整为95 U/mL,温度50℃、时间125 min和液料比14:1 mL/g,得到实际提取率为1.725‰ ± 0.041‰,与理论值非常接近,说明模型较好地反映出花青素提取的条件,也说明了用响应面法优化是可行的。
3.3. HPLC测定花青素的纯度及C3G的制备
黑米花青素经提取纯化后,每一步均使C3G含量得到提高,提取物经过AB-8大孔树脂纯化后,纯度为47.33%;经聚酰胺树脂纯化后,纯度为71.27%,这说明聚酰胺对黑米花青素纯化效果是较好的。如图8所示,聚酰胺纯化前样品在280 nm检测波长下,即黄酮类化合物常用检测波长下杂峰较多,经聚酰
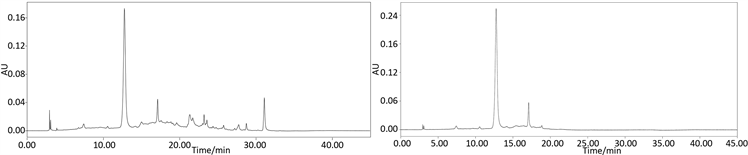 (a) AB-8大孔树脂纯化
(a) AB-8大孔树脂纯化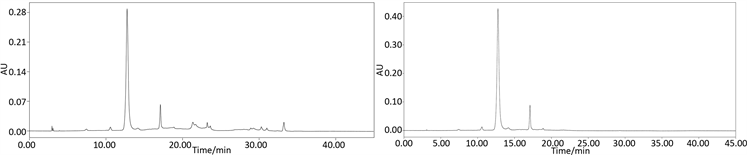 (b) AB-8大孔树脂 + 聚酰胺树脂纯化
(b) AB-8大孔树脂 + 聚酰胺树脂纯化
Figure 8. HPLC chromatogram before and after purification
图8. 纯化前后的HPLC色谱图
胺处理后,杂峰峰面积明显减少,可见大多黄酮类杂质已被除去。
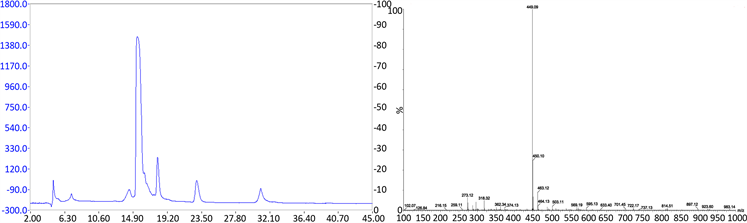
Figure 9. Semi-preparative liquid chromatography and C3G mass spectrometry
图9. 半制备液相色谱图及C3G质谱图
利用半制备液相色谱分离纯化出黑米花青素主要单体矢车菊素-3-O-葡萄糖苷(C3G),结果如图9所示。收集18 min左右的物质,即为C3G,其峰面积最大。对收集的组分进行质谱检测,得到主要成分是分子量449的物质,即验证该组份为C3G。
3.4. 氨基酸对黑米花青素的辅色作用研究
3.4.1. L-抗坏血酸对C3G颜色稳定性的影响
L-抗坏血酸对C3G颜色稳定性的影响如图5所示。在40℃自然光光照下贮存5天后,仅含C3G的体系表现出良好的稳定性,其颜色和吸光值的变化较小。由表4可得,仅含C3G的体系的降解反应动力学符合零级反应和一级反应,经计算得半衰期t1/2为5.63或6.30天。L-抗坏血酸的添加导致体系中花青素颜色迅速的衰退(t1/2 = 2.61天),伴随着吸光值的变化和红色褪去。含L-抗坏血酸的体系中,花青素的降解符合一级反应动力,揭示了抗坏血酸的浓度对降解速率有线性影响。L-抗坏血酸降解花青素的作用主要有以下2种机制:1) L-抗坏血酸和花青素间存在缩合作用,从而破坏花青素;2) 抗坏血酸的自氧化作用产生自由基,进而分裂花青素的黄烊盐离子核心 [19] 。
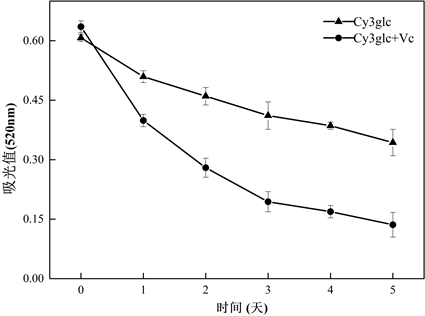
Figure 10. Absorbance stability of system in light for 5 days at 40˚C
图10. 体系的吸光值稳定性(在40 ℃自然光光照下)
3.4.2. 氨基酸对C3G颜色稳定性的影响
四种不同的氨基酸(Leu、Cys、Trp及Met)对含C3G的体系中颜色稳定性影响如图11所示。添加0.25%氨基酸增强了体系中C3G的稳定性,与未添加氨基酸的体系相比,贮藏过程中花青素的褪色率较小,添加了半胱氨酸的体系的颜色稳定性提高最明显。花青素在半胱氨酸存在下颜色稳定性提高的原因可能是它们之间通过氢键或疏水作用的发生了相互作用 [20] 。
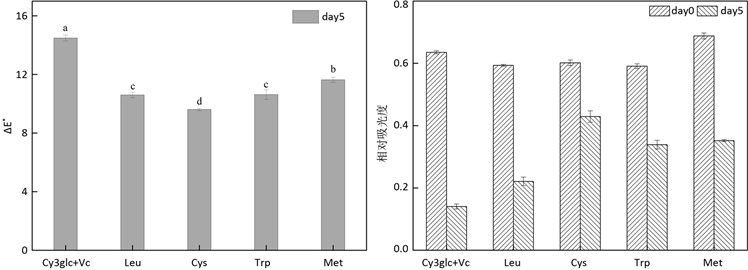
Figure 11. Relative absorbance and ΔE* of system with 0.25% amino acid in light for 5 days at 40℃
图11. 体系的相对吸光度和色差变化(在40℃光照5d下,0.25%氨基酸,显著性以字母a-e表示,a:影响最显著)
体系中花青素颜色稳定性的动力反应顺序如表4所示。在氨基酸存在时,花青素颜色的降解符合一级反应。结果表明:花青素降解受氨基酸浓度的线性影响,但需进一步研究。添加氨基酸后,含L-抗坏血酸的模型饮料体系的半衰期有一定程度的延长(Leu:2.61至3.81 d,Cys:2.61至11.95 d,Trp:2.61至6.08 d及Met:2.61至4.99 d)。因此,半胱氨酸抑制花青素降解的作用最强。

Table 4. Kinetic reaction order for anthocyanin stability in model beverage systems stored at 40˚C for 5 days
表4. 模型饮料系统的花青素稳定性的动力反应参数(在40℃储存5天下)
注:粗体表示R2大于0.95。
4. 结论
本文采用Box-Behnken的中心组合设计及响应面(RSM)分析,优化了酶法提取黑米中花青素的工艺参数,得到最佳工艺条件为:酶的添加量95 U/mL,温度50℃、时间125 min和液料比14:1 mL/g。以此条件得到花青素的得率为(1.725 ± 0.041) ‰,经过AB-8大孔树脂和聚酰胺树脂纯化后,纯度为71.24%。辅色作用研究表明,L-抗坏血酸的添加加速了体系中花青素的降解,而氨基酸的加入能抑制其降解作用,从而提高体系的颜色稳定性,半胱氨酸辅色效果最好,是一种极具开发潜力的辅色剂。
基金项目
国家自然科学基金项目“基于分子修饰的黑米花青素对肠道益生菌的增殖作用及构效关系研究”,项目编号:31771974;2016年度省科技重大专项项目“豆粕酶法制备美拉德风味肽及其在复合调味盐中的产业化应用”,项目编号:16030701081。