1. 引言
糖尿病作为第三大非传染性疾病,发病率逐年增加 [1]。引发糖尿病的原因有很多:过度饮食、肥胖、酗酒 [2]、抑郁和吸烟 [3]。糖尿病在临床上可分为I型、II型和妊娠糖尿病 [4],I型糖尿病的典型临床表现是烦渴、多尿、多食和体重减轻,II型糖尿病在发生之前通常会有肥胖。因此在制定适合中国国情的糖尿病防控对策的同时,寻找能够有效的降低血糖的食品也成为当今的热度话题。
黑木耳是中国的传统食用菌。在我国一直有清肺抗尘的功效,由于其降低血糖、预防和治疗动脉粥样硬化、对抗肿瘤的能力,它被称为“食品阿司匹林” [5] [6] [7]。多糖作为黑木耳重要的营养成分有许多独特的生理活性,如降血糖血脂、抗肿瘤和抗氧化能力、促进机体胰岛β细胞再生、改善胰岛素分泌等 [8]。
硒是作为人体内必需的微量元素 [9],对抗氧化、预防心脏病、糖尿病、大骨节病、克山病、维持甲状腺的正常功能,甚至延长寿命都是非常有帮助的 [10]。经实验证明,硒在食用菌中主要以多糖硒的形式存在 [11]。最近几年的研究中,证明了食用菌有很好的富硒能力,多糖与硒结合成为多糖有机硒化合物,更易被人体吸收,富硒食用菌的栽培研究也受到了大家的推广 [12]。因此对富硒黑木耳多糖的研究很有意义,而且可研究的方面很广。本实验通过给患I型糖尿病小鼠灌喂富硒黑木耳多糖和普通黑木耳多糖进行比对测定葡萄糖耐量、糖化血红蛋白、总胆固醇、甘油三酯和脏器系数,未来研究富硒黑木耳多糖对降血糖的功效,为降糖新药的开发和对富硒黑木耳的研究提供新思路。
2. 材料与方法
2.1. 试剂和试剂盒
乙醇:分析纯,天津市科密欧化学试剂有限公司
苯酚:分析纯,天津永晟化工厂
浓硫酸:分析纯,北京化工厂
葡萄糖:药用级,潍坊盛泰药业有限公司
柠檬酸、柠檬酸钠:分析纯,天津华东试剂厂
链脲佐菌素:1 g,美国SIGMA公司
盐酸二甲双胍:药用级,山东明仁福瑞达制药有限公司
TC、TG、GHb测试盒:南京建成生物工程研究所
2.2. 动物
选取雄性KM种小鼠40只,体重18 ± 2 g左右,由长春动物实验中心提供。在延边大学食品研究中心动物室内适应性喂养7 d,期间自由摄食和饮水,多笼饲养。基础饲料和垫料由延边大学实验动物中心提供。
2.3. 仪器
分析天平:上海卓精电子科技有限公司;离心机:上海卢湘仪器有限公司;旋蒸冷凝器:东京理化器械株式会社;真空泵:日本ULUAC KIKO公司;冷冻干燥机:西班牙Telstar集团公司;血糖仪:天津九安医疗电子股份有限公司。
2.4. 木耳多糖的提取
2.4.1. 材料预处理
将富硒和普通黑木耳经粉碎机过(40~60)目筛,粉碎得到木耳粉。
2.4.2. 提取方法
木耳粉→热水浴浸提3.5 h (料液比1:40 (m/V)、提取温度90℃)→离心10 min (3500 r/min)→上清液抽滤→浓缩→Sevag法除蛋白3次→95%醇沉3 h→离心10 min (3500 r/min)→冻干→黑木耳多糖。
2.4.3. Sevage法脱蛋白
取浓缩后的多糖溶液按4:1的比例与Sevage溶液(正丁醇: 氯仿为1:4)混合,置于具塞试管中,充分振摇30 min后,以3500 r/min的转速经离心机离心10 min,然后将水相与氯仿相分开。
2.5. 实验方法
2.5.1. 多糖含量的测定
称取两种木耳多糖各1 mg加入蒸馏水定容至1 mL,加入质量分数为6%苯酚1 mL和浓硫酸5 mL,通过沸水浴20 min进行显色,冷却至室温后于490 nm波长下测定吸光度OD值。
2.5.2. 标准曲线的测定方法
用分析天平秤取葡萄糖5 mg,加入蒸馏水定容至50 mL配置成浓度为0.1 mg/mL的葡萄糖溶液。取6个试管分别吸取0、0.2、0.4、0.6、0.8、1.0 mL的葡萄糖母液,然后每一个试管均进行如下操作:加入蒸馏水补至1.0 mL后,加入质量分数为6%苯酚1 mL和浓硫酸5 mL,摇匀,通过沸水浴20 min进行显色,冷却至室温后于490 nm波长下以空白试剂为参比,测定吸光度OD值。X轴为浓度Y轴为吸光度得到标准曲线。
2.5.3. 小鼠造模和测血糖方法
1) 糖尿病模型建立方法
更换小鼠垫料,同时12 h内只喂水禁食,12 h剪尾测量小鼠空腹血糖值并记录当时血糖值和体重。按照体重给小鼠腹腔注射剂量为120 mg/kg·BW的STZ溶液,注射结束后1 h恢复进食。造模后正常喂养一周,第7天禁食不禁水测其体重和血糖值,当血糖值高于11.1 mmol/mL时确定I型糖尿病小鼠造模成功,同时剔除血糖值低于11.1 mmol/mL的小鼠。
2) 小鼠血糖值和糖耐量测定
血糖值:小鼠隔夜禁食12 h后,剪尾取血测量其空腹血糖值并记录,弃第一滴血以第二滴血液为准。
糖耐量:最后一次灌胃后隔夜禁食12 h,经口按照剂量为2 g/kg·BW一次性灌胃大剂量葡萄糖溶液后,每30 min测量一次血糖值持续观察2 h,并记录。
3) I型糖尿病小鼠分组
将适应性喂养7 d后的小鼠40只,隔夜禁食不禁水12 h,随机选取5只作为空白对照组,剩余的35只按照体重腹腔注射STZ建立I型糖尿病模型,其中造模成功35只小鼠。随后按表1所示对小鼠进行分组,并灌胃如表所示剂量的多糖溶液和盐酸二甲双胍溶液,连续灌胃4周。同时试验过程中需要每天观察并记录小鼠的体重、进食量、饮水量、每隔7天测定一次小鼠的空腹血糖值(禁食12 h),最后一次灌胃结束后隔夜禁食12 h测量小鼠葡萄糖耐量并记录数据。

Table 1. Groups and drug dosage (n = 7)
表1. 分组及灌胃剂量(n = 7)
2.5.5. 指标测定
1) 脏器系数测定
灌胃30天后将小鼠眼球取血,脱颈处死,取其肾、脾、肝、心脏用生理盐水清洗然后用滤纸吸干水分并测出上述器官的湿重。
2) TC、TG、GHb测定
将取好的脏器和血液分别保存,按照试剂盒说明书的步骤,取相对应的脏器或血液按步骤操作来测定总胆固醇(TC)、甘油三酯(TG)、糖化血红蛋白(GHb)的含量。
2.5.6. 统计方法
本实验使用SPSS 17.0软件对实验数据进行统计学分析,所得数据以图表和均值 ± 标准偏差(
)的形式表示。P < 0.05表示有显著性差异,P < 0.01表示具有极显著性差异,P > 0.05表示无显著性差异即无统计学意义。
3. 结果与分析
3.1. 标准曲线
经酶标仪测定用Excel对数据进行进一步的整理与分析得到标准曲线为
3.2. 富硒黑木耳多糖对小鼠体重、 食物和水的摄入量影响
由表2可以看出,未造模前小鼠初始体重差别不大,造模成功后,空白组小鼠体重显著高于患病组体重小鼠,而进食量和饮水量明显低于患病组。随着给药天数的增加,患病组小鼠体重呈增加趋势,阳性对照组小鼠体重增长最快,阴性对照组小鼠体重增长最慢且二者均与其他组有显著性差异(p < 0.05)。在患病组中阴性对照组小鼠的进食量和饮水量均最多,阳性对照组则最少,随着木耳多糖的给药浓度增加进食量和饮水量明显下降且富硒高剂量组最少。

Table 2. Body weight, food consumption and water consumption
表2. 体重、摄食量、饮水量
注:同行数据之间有不同字母的表示其差异显著(p < 0.05)。
经过30天的灌胃对比造模前后的小鼠状态可得:空白组小鼠进食量饮水量排尿量均正常,健康活泼,毛色柔顺,体重增长较快;患病组小鼠整体进食、饮水及排尿量明显增加且垫料浸湿严重,同时精神状态较差,毛色枯黄,体型瘦小,但随着给药天数和给药浓度的增加小鼠的毛发逐渐柔顺,精神状态逐渐转好。由此可得富硒黑木耳多糖在减缓糖尿病小鼠三多一少的症状方面有一定影响。
3.3. 富硒黑木耳多糖对小鼠血糖指标的影响
图1为小鼠4周内血糖值的变化曲线。将适应性喂养7 d后的小鼠,更换垫料12 h内只喂水禁食后测定其空腹血糖值,可以看出造模前各小鼠血糖值相近均小于11.1 mmol/L,造模成功后,患病组小鼠血糖值显著高于空白组小鼠(p < 0.05)且血糖值均高于11.1 mmol/L。按照分组剂量给小鼠灌胃30天,每7天测一次空腹血糖发现,空白组小鼠血糖值呈稳定趋势并小于11.1 mmol/L,患病组中阴性对照组小鼠血糖值持续上升无下降趋势,血糖值显著高于其他组(p < 0.05),阳性对照组小鼠血糖值迅速下降且显著低于其他组(p < 0.05),其他组小鼠血糖值随着给药天数和给药浓度的增加下降趋势也有所增加。富硒高剂量组和普通高剂量组在前三次的血糖测试中差异不显著(p > 0.05),血糖下降速度比其他组快,并且在一定程度上与阳性对照组(二甲双胍组)降糖效果相似,但在最后一次血糖测试中,富硒高剂量组降糖效果比普通高剂量组降糖效果更好。综上可以得出高剂量的富硒黑木耳多糖对降血糖的效果比其他组要好,这也证明了黑木耳多糖对降低血糖值确实有一定的效果,同时根据宗灿华等 [13] 的实验结果也再次证明这一结论。

Figure 1. Changes of blood glucose in mice of each group
图1. 各组小鼠血糖变化
3.4. 富硒黑木耳多糖小鼠糖耐量的影响
口服葡萄糖耐量是对糖尿病防治药物进行评价的一个方面。图2是小鼠最后一次灌胃后,隔夜禁食12 h,经口按照剂量为2 g/kg·BW一次性灌胃大剂量葡萄糖溶液,每30 min测量一次血糖值持续观察2 h得到的小鼠糖耐量。由图可得0~30 min各组小鼠血糖值明显提升,但空白组血糖提升速度缓慢,患病组提升速度较快。60 min时各组小鼠血糖值显著增加并达到最高值,包括空白组在内的所有小鼠血糖值均高于11.1 mmol/L。60~120 min各组小鼠血糖值逐渐降低。患病组中阳性对照血糖值下降趋势显著高于其他组(p < 0.05)。与阴性对照组相比多糖组下降趋势比较明显。其中富硒高剂量组血糖下降趋势显著高于其他多糖组(p < 0.05)且与阳性对照组下降趋势相似,可以说明富硒黑木耳多糖在一定程度上可以修复由STZ导致的小鼠糖耐量的损伤,并且富硒高剂量对改善小鼠糖耐量效果较好,说明富硒黑木耳多糖对提高I型糖尿病小鼠抗高血糖能力有一定帮助。
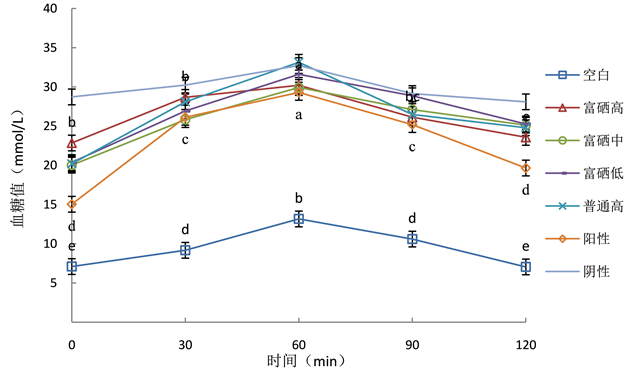
Figure 2. Changes of oral glucose tolerance in mice of each group
图2. 各组小鼠葡萄糖耐量的变化
3.5. 富硒黑木耳多糖对小鼠糖化血红蛋白、总胆固醇、甘油三酯的影响
TC、TG、GHb是现今用来衡量血糖控制的三个重要标准,通过三个指标的变化也可以作为检测降糖药物的手段。胰岛素的耐受在很大程度上可以影响TG在机体内的代谢强度,一旦胰岛素的作用变弱,那么就会减慢含有TG的颗粒的水解速度,TG含量因此增加 [14]。GHb是血红蛋白与血清中的糖类进行非酶促蛋白糖化反应的产物,两者的结合很难因外界因素作用而分离,血液中GHb的水平与血糖的升高成正比,因此GHb可以将一些有关于治疗糖尿病的问题反映出来,为后续的治疗提供有效参考 [15]。
由表3可得空白组小鼠TC、TG、GHb值显著低于其他组(p < 0.05),而阴性对照组三个指标均显著高与其他组(p < 0.05)。患病组小鼠的各个指标随着给药量的增加逐渐降低,其中阳性对照组数值显著低于富硒中剂量组和富硒低剂量组(p < 0.05)。两种高剂量组的GHb值均与阳性对照组无显著性差异(p > 0.05),

Table 3. Effects of Polysaccharide on TC, TG and GHb in mice
表3. 多糖对小鼠TC、TG、GHb的影响
注:同行数据之间有不同字母的表示其差异显著(p < 0.05)。
富硒高剂量组和富硒中剂量组的TG值与阳性对照组无显著性差异(p > 0.05)。综合来看富硒高剂量组与其他组相比作用效果与阳性对照组最接近。尹凡等 [16] 实验证明多糖可以通过促进胰岛素的分泌从而降低血糖,因此可以得出富硒黑木耳多糖对提升患病小鼠体内胰岛素同样有帮助,且高剂量的富硒黑木耳多糖对修复胰岛素帮助效果更好。
3.6. 富硒黑木耳多糖对小鼠脏器系数的影响
糖尿病患者的糖代谢水平与其他人相比处于亢奋状态,因此作为糖代谢重要器官的肝脏、肾脏就比正常水平肿大。而由于糖尿病会伤害机体的免疫功能因此作为免疫器官的脾脏则会发生一定程度的萎缩。因此脏器系数的测定,可以作为检验机体被糖尿病所损伤的程度,也可用来检验糖尿病药物的治疗效果。
由表4可得,无论患病还是健康的小鼠心脏脏器系数都没有显著差异(p > 0.05)。空白组小鼠的肝肾脏器系数显著低于患病组小鼠(p < 0.05),阴性对照组的肝肾脏器系数显著高于其他组(p < 0.05),富硒高剂量组和富硒低剂量组的肝肾脏器系数与阳性对照组均没有显著性差异(p > 0.05)。阳性对照组脾的脏器系数最大,阴性对照组最小(p < 0.05),随着给药剂量的增加患病小鼠肝肾脏器系数逐渐降低,脾的脏器系数逐渐升高,说明多糖对缓解肝肾肿大修复免疫功能有一定作用。且高剂量组的脏器系数与阳性对照组最接近,可以得出富硒高剂量组对缓解糖尿病引起的肝肾肿大脾脏萎缩的作用性最强。同时汤陈鹏等 [17] 实验也可证明多糖能修复脏器损伤,抑制肝脏肿大。
Table4. Numerical value of organ coefficient on mice in each group (%)
表4. 各组小鼠脏器系数数值(%)
注:同行数据之间有不同字母的表示其差异显著(p < 0.05)。
4. 结论
实验证明一定剂量的富硒黑木耳多糖,确实可以使患病小鼠体重增长,进食量、饮水量及尿量减少,能够在一定程度上缓解糖尿病所引起的“三高一少”的症状。并且能使患病小鼠的血糖值、TC、TG、GHb显著降低(p < 0.05),对修复患病小鼠体内胰岛素有很大帮助。实验可得小鼠的心脏系数较正常,而肝脏和肾脏由于患病出现的肿大现象和脾脏出现的萎缩现象也随着灌喂高剂量富硒黑木耳多糖而有所缓解。对比王晶晶 [18] 的实验可以得出富硒黑木耳多糖能改善小鼠胰岛素的分泌,修复小鼠因糖尿病引起的肾脏损伤。综上所示,富硒黑木耳多糖对比普通黑木耳多糖降血糖效果更好,说明硒确实可以提升木耳多糖的降血糖能力。这为后续对富硒产品的研究提供思路,且随着研究的深入以富硒黑木耳多糖为原料开发的一系列降血糖产品的市场前景将会非常广阔。
NOTES
*通讯作者。