1. 引言
儿童肝移植是治疗儿童终末期肝病唯一有效方法,适用于胆管闭锁、肝硬化、爆发性肝衰、肝糖原累积症、肝豆状核变性等小儿先天性疾病。以往儿童肝移植供体的来源,大多为亲属供肝或成人供肝行劈离式肝移植。这种供肝来源手术技术难度大、风险高、术后并发症发生率高,严重影响儿童肝移植的成功率和术后生存质量。儿童心脏死亡器官捐赠(DCD)的供肝避免了肝断面带来的技术难度和术后相关并发症,而且儿童间供受体肝移植,更符合儿童生理生长发育需要,是儿童肝移植的理想供体来源。2011年7月我院完成1例儿童DCD供肝移植,报告如下。
2. 资料与方法
供者:男性,年龄3岁8个月,体重16 kg,ABO血型:O型(Rh+)。因严重病毒性脑炎致脑死亡,无自主呼吸,继发心脏死亡后进行DCD。依据《中国心脏死亡器官捐献工作指南》,并经红十字会成功开展劝捐工作,患儿的亲属均同意捐献器官,并签署了《心脏死亡自愿无偿器官捐献知情同意书》及相关文件[1] 。于2011年7月2日2时40分实行可控型心脏死亡器官获取。获取的供肝质软,重约582 g,可见肝动脉变异,肝右后动脉发自肠系膜上动脉,门静脉、胆管、肝静脉解剖结构正常。供肝修整完后至于4℃ UW液环境中保存。受者:男性,年龄4岁2个月,体重15 kg,身高95 cm,ABO血型:A型,因“反复乏力、低血糖、生长迟缓3年”入院,查体:消瘦,身高比同龄儿童明显矮小,腹部膨隆,肝脏重度增大,下缘达右髂前上棘。血糖1.7 mmol/L,肝功能:丙氨酸转氨酶112 u/L,谷草转氨酶237 u/L,总胆红素6.4 mmol/L,白蛋白47 g/L,肝穿病理:50%肝细胞弥漫糖原沉积,50%肝细胞呈大泡脂肪变性,肝小叶间纤维间隔形成。诊断为肝糖原累积症。
手术:病肝切除:术中见肝脏明显增大,占据腹腔3/4空间,呈重度脂肪肝,肠道被挤向左下腹。分离肝动脉发现,肝动脉存在变异,其肝右后动脉来源于肠系肠上动脉,分离肝动脉至胃十二指肠分叉处下方,紧贴肝门处切断肝左、肝右动脉及变异肝右后动脉;解剖游离门静脉及胆总管,切断胆囊管,并于胆囊管上方离断肝总管;游离肝上、肝下下腔静脉。移植手术:采用经典原位肝移植术式,肝上下腔、肝下下腔用5-0Prolene线行端端吻合,供、受体门静脉用5-0Prolene线行端端吻合,肝动脉吻合用8-0Prolene在2.5倍放大镜下进行,采用供体腹腔动脉干与受体肝动脉与胃十二指肠动脉汇合处吻合,供、受体变异肝右后动脉用9-0Prolene线行端端间断吻合。供、受体胆总管用6-0PDS线行端端吻合,后壁采用连续缝合,前壁间断缝合,留置胆汁引流管;同时留置经胃空肠造瘘管。
术后监护:术后转入重症监护病房,监测患儿的生命体征,肝肾功能,尿量及出凝血情况。1周内每天床边彩超监测移植肝血流情况,三代头孢抗感染,前列地尔 + 低分子右旋糖酐抗凝治疗;维持水电解质酸碱平衡及营养支持,术后第2天经胃空肠造瘘管行肠内营养及给药,术后第5天过度为经口饮食,采用普乐可复 + 甲泼尼龙二联免疫抑制方案预防排斥反应。
3. 结果
供肝热缺血时间6 min,冷缺血时间约180 min。受者总手术时间约420 min,其中无肝期约55 min,术中出血量约400 ml。术后2 h血糖恢复正常,术后6 h清醒并拔除气管插管,术后7天下床,移植肝功能恢复正常,术后18天痊愈出院。术后1个月后出现明显生长追赶,术后4个月拔除胆汁引流管和胃空肠造瘘管,术后6个月开始参加幼儿园学习,至今已健康生活18个月,身高增长22 cm,体重增加7 kg。术后6个月停用激素,FK506浓度控制于3~5 ug/L,随访期间血糖、移植肝功能均正常(图1~8)。
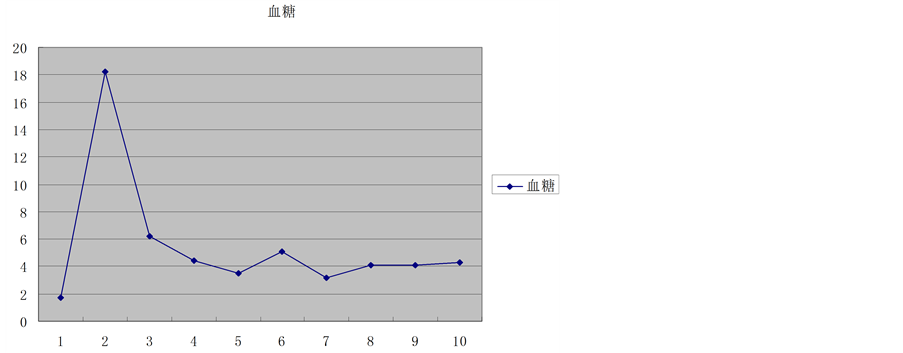
Figure 1. Glucose trends
图1. 血糖变化趋势
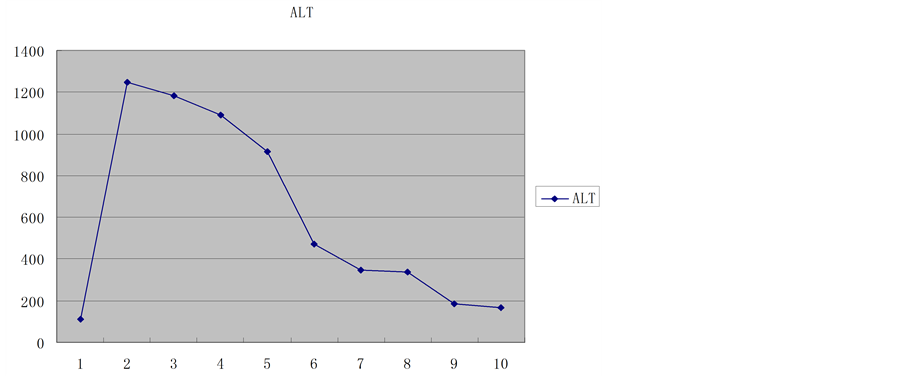
Figure 2. Aminotransferase trends
图2. 转氨酶变化趋势
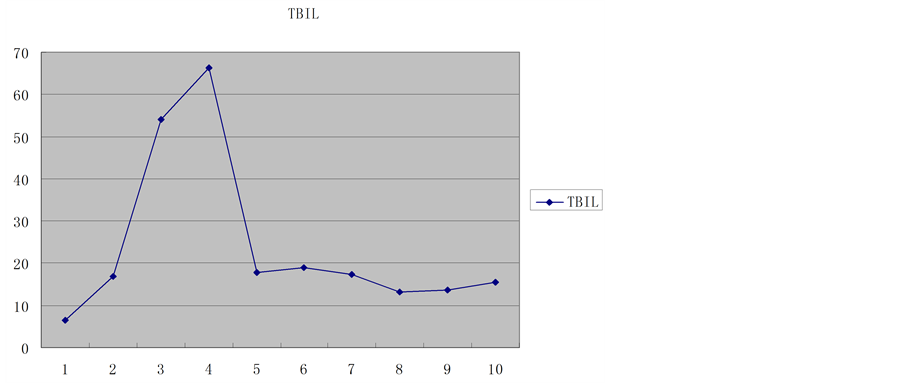
Figure 3. Total bilirubin trends
图3. 总胆红素变化趋势
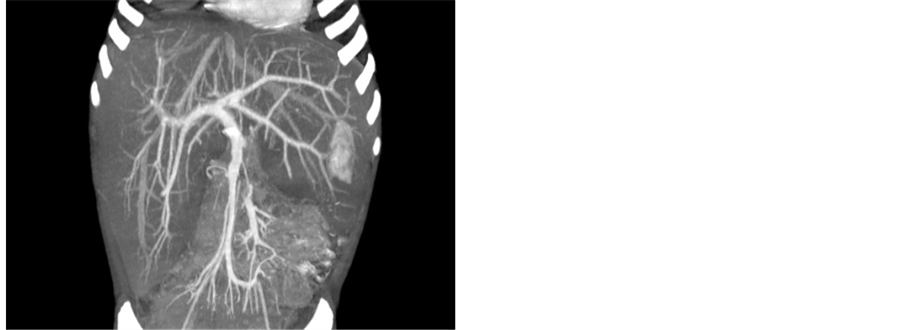
Figure 4. CT: Liver density decreased and severe swelling
图4. CT:肝脏密度降低,重度肿大
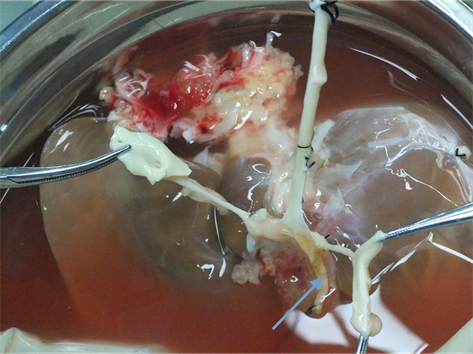
Figure 5. Arrow to the right hepatic artery with anatomical variation
图5. 箭头为变异的肝右动脉
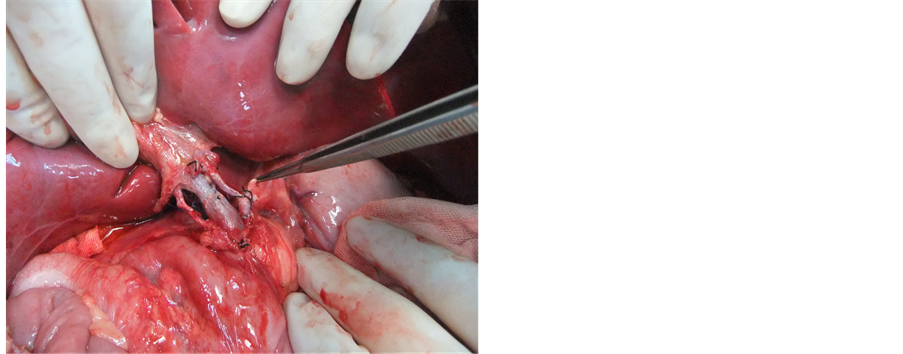
Figure 6. Artery Pollex well after open
图6. 动脉开放后博动良好
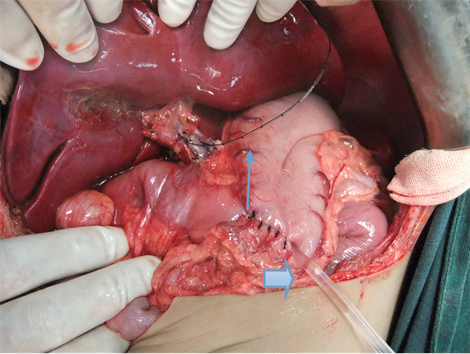
Figure 7. Thin arrow to bile drainage tube, thick arrows to fistula of gastrojejunostomy
图7. 细箭头为胆汁引流管,粗箭头为经胃空肠造瘘管
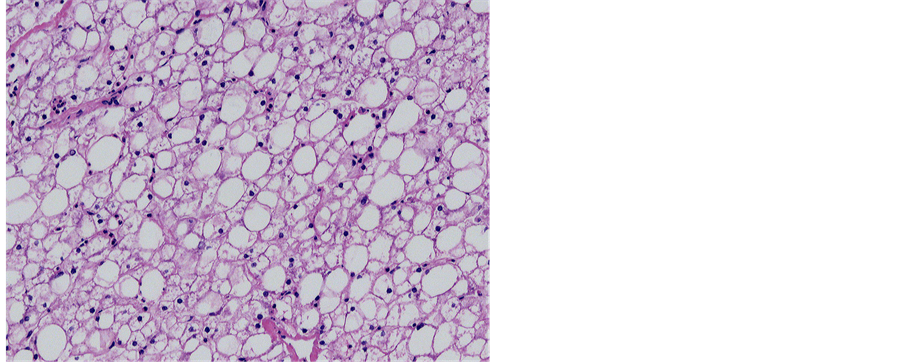
Figure 8. Pathology: severe steatosis and glycogen storage
图8. 病理:重度脂肪变性,糖原累积
4. 讨论
肝糖原累积症为一种较少见婴幼儿先天性隐形遗传性糖原代谢紊乱性疾病,发病率约为1/4万,主要病因为肝内葡萄糖-6-磷酸酶缺乏,导致糖原分解或合成障碍,从而产生肝脏内糖原或异型糖原的过多累积。临床主要表现为严重低血糖,患儿生长迟缓、腹部膨胀等,肝脏重度肿大,重症者将发展为肝功能失代偿。治疗上一般采用高蛋白、高葡萄糖,多餐饮食,主要控制血糖于正常水平[2] 。文献报告[3] 肝移植可以从病因上完全治愈肝糖原累积症,尤其对于重症肝功能失代偿患者,肝移植是唯一有效治疗办法。本例患儿经肝移植治疗后第1天血糖即恢复为正常,并出现生长发育追赶,短期内即达到同龄儿童的生长发育水平,恢复正常学习生活,生活质量明显提高,随访期间血糖、肝功能良好。
儿童肝移植由于儿童解剖结构的特殊性,很难找到合适年龄段的供肝。目前儿童肝移植供肝主要来自成年人的活体肝移植及成人尸体供肝的劈离式肝移植。成年人活体肝移植需要通过切除健康成年人的部份肝脏作为供体,具有技术难度高,供者冒有巨大手术风险和术后可能出现的严重并发症,甚至死亡等问题,且活体肝移植受到伦理委员会值疑,部份国家已有法律规定禁止行活体肝移植。劈离式肝移植同样存在技术难度高,供肝经过修整后可能损害供肝重要的解剖结构而影响供肝质量,以及肝断面的处理增加了受者术后出血、胆瘘等严重并发症的风险,从而影响儿童肝移植术后的生存率。因此有必要寻找更合适的儿童肝移植供肝来源。DCD是指公民在心脏死亡后进行的器官捐赠。儿童有许多疾病如外伤、脑瘤、严重脑炎、缺血缺氧性脑病等导致脑死亡及心脏死亡。在严格控制热、冷缺血时间情况下,这些儿童DCD可以成为儿童肝移植供肝的来源。这种供肝来源具有肝脏体积匹配合理、避免成人活体肝移植及劈离式肝移植中对肝断面处理可能带来的严重并发症等问题。儿童正处于生长发育的重要阶段,包括免疫系统,儿童间肝移植更符合儿童生长发育需要,同时由于供肝及受体的免疫系统均处于未成熟阶段,随着移植后时间延长,供受体有可能发展为嵌合状态。受体只需较小剂量免疫抑制剂即可以有效的控制排斥反应,甚至部份患儿后期可以考虑停用免疫抑制剂[3] 。本例患儿移植6个月后,单用普乐可复,且在较低浓度水平(3~5 ug/L)即可有效的控制排斥反应,随着随访时间延长,后期我们可以考虑对此例患儿停用免疫抑制剂。
儿童生理解剖结构细小,壁薄,血管吻合时容易造成组织撕裂及管腔狭窄,尤其存在血管变异时,术后血栓形成发生率高[4] [5] 。对显微外科技术及围手术期管理有较高的要求。本例患儿供、受体均存在肝动脉变异,血管纤细,变异肝右后动脉管径只有2 mm,我们通过专门肝动脉重建医生在2.5倍放大镜下行间断缝合,术后加强床边彩超监测移植肝血流,加强抗凝治疗,患儿术后恢复良好,无动脉及静脉狭窄或血栓形成等问题。由于小儿依从性差,术后难以有效表达主诉及正常服药,我们在术中放置胆汁引流管和经胃空肠造瘘管,一方面通过观察每天胆汁情况,一定程度上可以有效判断移植肝功能;另一方面,通过胃空肠造瘘管可以早期进行肠内营养,有利于保护肠粘膜屏障功能,同时可以从胃空肠造瘘管给药,有效的解决了小儿依从性差等问题。另外,本例DCD儿童年龄3岁8个月,供肝重量约为582 g,根据肝移植供肝/受体 ≥1%即可满足受体需要,可用于约58 kg体重的成人,因此提示我们,儿童DCD供肝在一定条件下可以用于较小体重的成人受体,从而扩宽儿童DCD供肝的使用率。
基金项目
本课题受福建省自然科学基金重点项目资助,(资金编号:2011Y0046)。

NOTES
*通讯作者。