1. 引言
银纳米复合材料由于其独特的结构和物理化学性质,吸引了大量的学者对其进行研究,使其成为最具商业价值的纳米材料之一[1] 。这些银纳米复合材料呈现出的独特的结构使它们在生物学和生物化学领域也具有潜在的应用价值[2] 。在最近几十年的研究中,报道了大量的关于含银纳米复合粒子的研究。张亮[3] 等人报道出将纳米银粒子包覆在改性的二氧化硅球形颗粒表面来提升该复合材料的抑菌性能。T. Ivanova[4] 等人采用溶胶–凝胶法制备出表面吸附有纳米银颗粒的纳米氧化钛膜。其他大量的材料,如碳纳米管[5] [6] ,聚合纳米纤维[7] [8] 和氧化石墨烯[9] [10] 都被报道出可以作为模板来合成银纳米复合材料。
在这些模板中,二氧化硅具有不可争议的优势,因为纳米银粒子不仅可以负载在二氧化硅内层还可以粘附在二氧化硅表面,或者两者兼具。此外,二氧化硅还可以运用到电沉积[11] ,播种镀[12] ,表面官能化[13] ,或者层层沉积工艺[14] 中。另一方面,纳米银以高效、广谱杀菌性越来越多的出现在人们的日常生活中。将二氧化硅和纳米银颗粒结合起来制备的二氧化硅–纳米银复合粒子将具有协同效应。然而,将纳米银内嵌在二氧化硅内或者将纳米银粘附在二氧化硅外,将得到两种结构截然不同的纳米银复合粒子。前者的好处在于纳米银和银离子都可以对细菌生长起到抑制作用,但是这种结构的粒子纳米银释放速度比较快。后者虽然可以有效的减缓纳米银释放过快的问题,但是这种结构的复合粒子的抑菌作用只能通过释放银离子来实现。因此,我们制备了一种能结合上述两种粒子的优点的复合粒子,并测试了它的抑菌性能。
本文描述了三种不同结构的纳米银–二氧化硅复合粒子。首先将银离子还原成纳米银粒子,然后将其包覆在二氧化硅–聚多巴胺球形粒子表面,形成SiO2/PD/Ag粒子;其次将纳米银粒子内嵌在介孔二氧化硅里形成核壳结构的Ag@MSN粒子;最后将纳米银既封装在介孔二氧化硅内又粘附在二氧化硅–聚多巴胺外层形成独特夹心层结构的Ag@MSN/PD-Ag粒子。通过细菌的生长曲线来测试它们的抑菌性。令人惊讶的是,这些粒子的抑菌效果都有一定的延长,但是抑菌的作用效果却出现在不同的阶段。
2. 实验
2.1. SiO2/PD/Ag粒子制备
采用改进的stober方法制备粒径分布在200 nm的二氧化硅球形颗粒。将0.06 g的多巴胺加入30 mL,pH = 8.5的三羟甲基氨基甲烷(Tris)溶液中,然后向混合溶液中加入0.05 g的二氧化硅颗粒,在室温下混合搅拌一晚。去离子水清洗后,分散于20 mL的1.5 mg/mL的AgNO3溶液中,在氮气保护,加热到80℃,反应30分钟,去离子水清洗后,50℃真空干燥箱中干燥,待用。
2.2. Ag@MSN粒子制备
将0.2 g的十六烷基三甲基溴化铵(CTAB),96 mL的去离子水和2.8 mL的NH3混合在150 mL的三口烧瓶中加热至80℃反应30分钟,然后向烧瓶中加入1.0 mL,浓度为0.1 M的硝酸银和0.6 mL浓度为1.0 M的甲醛溶液。5分钟后,再向混合溶液中逐滴加入1 mL的正硅酸乙酯。反应2小时后,用无水乙醇和去离子水清洗,并用0.1 M的盐酸/乙醇溶液来提取表面活性剂,将得到的粒子在50℃的真空干燥箱中干燥,待用。
2.3. Ag@MSN/PD-Ag粒子制备
2 mg/mL的多巴胺盐酸盐溶解于10 mL的Tri-Hcl (pH = 8.5)中,0.05 g的Ag@MSN颗粒加入30 mL的多巴胺溶液,在25℃下振荡一晚,去离子水清洗,分散于20 mL的1.5 mg∙mL-1的AgNO3溶液中,在氮气保护,加热到80℃,反应30分钟,去离子水清洗后,50℃真空干燥箱中干燥,待用。
2.4. 抑菌测试
测量需钠弧菌的最小抑菌浓度(MIC)来衡量这些粒子的抑菌性能。在含有8 mL培养基的试管中,分别加入0.18,0.23,0.28,0.33,0.38,0.43 mg∙mL-1对应质量的粉体,超声均匀后,取4 mL测得OD值(600 nm),然后向试管中各加入100 ul的细菌培养液,培养24小时后再测量每个试管的OD值(600 nm)。此外,测量添加和没添加三种粉体的情况下,需钠弧菌连续10天的生长曲线。整个实验过程重复进行3次。
3. 结果与讨论
如图1a所示,本实验采用层层自组装法制备SiO2/PD/Ag颗粒。将200 nm的二氧化硅颗粒分散在多巴胺溶液里(pH = 8.5),在碱性环境中,多巴胺会自发的聚合成为聚多巴胺,并在球形二氧化硅表面形成一层薄膜,随后还原硝酸银生成的粒径分布在35 nm的纳米银颗粒包覆在聚多巴胺薄膜外面。形成这种特殊结构的关键在于聚多巴胺,因为它具有极强的粘附性和还原性,可以作为二次反应的平台。实验中多巴胺聚合为聚多巴胺的机理包括儿茶酚氧化为醌,分子间的交联反应,如芳基-芳基欧联和迈克尔加成反应[15] [16] 。
如图1b所示,Ag@MSN具有核壳结构,粒径分布大概150 nm,其中纳米银的粒径大约30 nm(亮点)。在该反应系统中,甲醛作为还原剂还原硝酸银,CTAB作为表面活性剂,正硅酸乙酯作为硅源,氢氧化钠作为碱性催化剂。最后,采用盐酸/乙醇溶液回流去除CTAB。
如图1c所示,Ag@MSN/PD-Ag具有独特的夹心层结构,其中在二氧化硅内层和表面都存在纳米银颗粒。这里聚多巴胺有两方面的作用,其一作为反应平台还原生成纳米银并将纳米银粘附在二氧化硅表面。其二,可以有效的减缓纳米银颗粒的释放速度。
采用测量细菌的生长曲线,来测试该三种不同结构的粉体对细菌生长的抑制作用。本实验中采用革兰氏阴性菌–需钠弧菌作为实验菌种,是因为该类细菌的细胞膜比较薄,便于粉体渗透到细菌内。在测试细菌的生长曲线之前,我们先测量细菌对粉体的最小抑菌浓度(MIC)。如图2a所示,当粉体的浓度较低(0.18 mg mL-1, 0.23 mg mL-1)时,OD值的增幅变化很大,意味着该浓度的粉体对细菌生长的抑制效果很弱。随着粉体的浓度的增加,OD值的增幅变化越来越小,当粉体的浓度为0.43 mg∙mL-1时,OD值增

Figure 1. TEM images of (a) SiO2/PD/Ag, (b) Ag@MSN, and (c) Ag@MSN/PD-Ag NPs (Corresponding 3-D images are embedded in each figures)
图1. SiO2/PD/Ag (a)粒子、Ag@MSN (b)粒子和Ag@MSN/PD-Ag (c)粒子的透射电镜图片(嵌入各自的3D效果图)
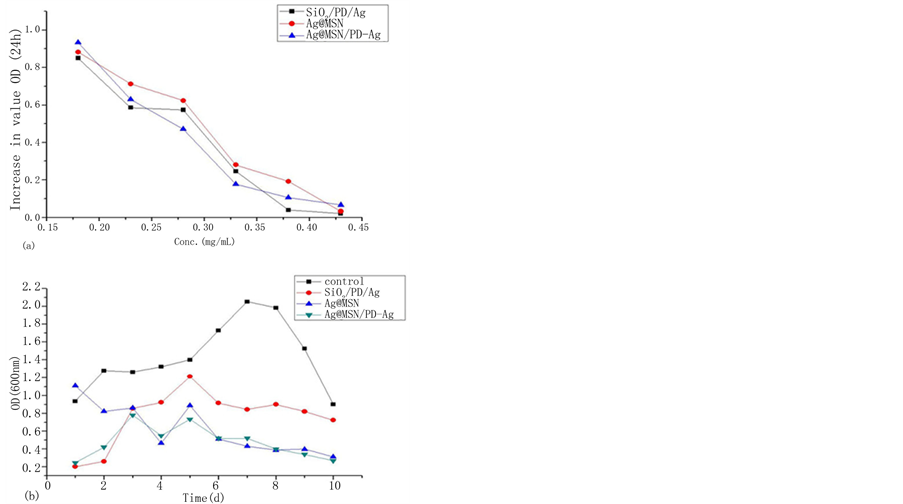
Figure 2. Determination of (a) MIC, (b) Bacterial Growth curves (Optical density) of V. natriegens for 10 days
图2. 测试需钠弧菌的最小抑菌浓度和连续10天的生长曲线(OD值)
长几乎为零,说明这些粉体的MIC趋于0.43 mg∙mL-1。
向培养基中添加粉体,并连续10天测量细菌OD值(600 nm)的变化,对照组不添加粉体。如图2b所示,与对照组相比,三种粉体均表现出了一定的抑菌性能。在最初的三天,SiO2/PD/Ag较Ag@MSN对需钠弧菌生长的抑制作用更为明显,因为SiO2/PD/Ag通过释放纳米银和银离子来抑制细菌的生长,但是Ag@MSN的介孔结构阻止了内层的纳米银快速地与细菌接触。然而,接下来的七天,Ag@MSN对需钠弧菌生长的抑制效果更明显了,这是因为一方面内嵌的纳米银逐渐氧化成为银离子并释放出来,另一方面包覆在二氧化硅表面的纳米银颗粒逐渐流失。这两种粉体的OD值的显著不同,是由它们结构的不同导致的。更重要的是,在整个抑菌过程中,Ag@MSN/PD-Ag测试出来的OD值一直都是最小的。这是因为在与细菌的接触过程中,首先最外层的纳米银和银离子流失,然后聚多巴胺膜被水解破坏,最后内嵌的纳米银氧化为银离子释放出来,整个抑菌过程结合了SiO2/PD/Ag粒子和Ag@MSN粒子的特性。
为了进一步探讨三种粉体的抑菌性能,我们准备了经过粉体处理和未经过粉体处理的抑菌实验的透射电镜样本。如图3b所示,经过SiO2/PD/Ag处理的细菌,细胞膜完全破碎并在需钠弧菌的细胞质里发现纳米银颗粒,而图3a所示的对照组中需钠弧菌保持完整的棒状结构。此外,在图3c中只发现Ag@MSN粘附在细菌细胞膜表面却并没有发现明显的细胞膜破坏。这种显著的不同可能是因为介孔二氧化硅层阻止了Ag@MSN中纳米银在最初几天里与细菌的接触,而SiO2/PD/Ag中包覆的纳米银却比较容易释放。对于Ag@MSN/PD-Ag,如图3d所示,在细菌内部发现有纳米银,同时还发现有大量粉体粘附在细胞膜上。该实验结果进一步表明,Ag@MSN/PD-Ag粒子具有SiO2/PD/Ag粒子和Ag@MSN粒子的特性。
4. 结论
本文证实了纳米颗粒的结构对抑菌性能确实存在影响效果。其中SiO2/PD/Ag和Ag@MSN的抑菌性能都增强了,但是作用的阶段不一样,这是因为两者的结构不同,导致对纳米银的释放速度不同。同时,

Figure 3. TEM photographs of (a) V. natriegens control sample; (b), (c) and (d) V. natriegens treated with SiO2/PD/Ag, Ag@MSN and Ag@MSN/PD-Ag NPs, respectively.
图3. 需钠弧菌对照组样本(a)需钠弧菌分别与SiO2/PD/Ag (b), Ag@MSN (c) 和 Ag@MSN/PD-Ag (d)处理后的透射电镜图片。
Ag@MSN/PD-Ag表现出SiO2/PD/Ag和Ag@MSN的协同效应,首先外层的纳米银进入细胞质并氧化成银离子,随后聚多巴胺膜水解,内嵌的纳米银氧化释放出银离子,致使细胞膜的完全破坏。因此,这些纳米银复合粒子都可以作为一种潜在的长效杀菌剂。
致 谢
该项目得到国家自然基金(编号:51003056),国家重点基础研究发展计划(编号:2014CB643306),上海教委科研创新重点项目(编号:12YZ121),上海市科技创新项目(编号:12231204102)等资助,在此表示感谢!

NOTES
*通讯作者。