1. 引言
厚朴(Magnolia officinalis cortex)为木兰科植物厚朴或凹叶厚朴的干燥干皮、根皮及枝皮[1] ,属重庆道地药材。在《神农本草经》中被列为中品,可见其药用价值颇高。据《本草纲目》记载,厚朴味苦辛、性温,具有行气化湿、温中止痛、降逆平喘的功效,主治湿滞伤中、脘痞吐泻、食积气滞、痰饮喘咳。近年来,在现代中药研究中,人们不断发现厚朴的新功效,如抗菌[2] 、抗炎[3] 、抗肿瘤[4] 、抗氧化[5] -[8] 等药理作用,其应用广泛。现代研究表明厚朴的主要化学成分包含木脂素类、挥发油类、生物碱类、多糖类、微量元素等多种生理活性物质,不同成分具有各自特有的生物活性,但同时彼此之间也可能存在协同或拮抗作用,而抗氧化活性又在不同程度上影响着其他生物活性如抗炎、心血管保护作用、大脑缺血性损伤修复等。因此,厚朴抗氧化活性有效组分成为我们重点关注的研究对象。
微流控芯片技术以其微型化、集成化的独有优势在天然产物活性成分研究中备受瞩目,将其与灵敏度高、检测快速的化学发光光分析法相结合,成为天然产物活性成分检测的有效手段。Maliwan [9] 等通过在聚二甲基硅氧烷(PDMS)上构建通道来制作单通道微流控芯片,采用9,10-二(苯乙炔基)蒽(BPEA)为荧光探针进行标记,以过氧草酸酯-H2O2为化学发光体系对生育酚、槲皮素和胡萝卜素三种天然产物活性成分进行抗氧化性测试,结果表明胡萝卜素对H2O2清除效果最好(SAHP值为3.27 × 10−3 μmol∙L−1)。Wang [10] 等构建了一种用于检测天然产物活性成分抗氧化活性的微流控装置,实验采用过氧草酸酯类化合物为化学发光剂,待测组分抗氧化能力与通入待测组分后体系化学发光减小值成正比,通过计算样本IC50评价样本抗氧化能力,但相关研究仍处于探索阶段,在微流控芯片的流路设计、在线检测模式、测试效率和测试稳定性等方面尚需深入研究,尤其是将微流控芯片分析技术应用于中药活性成分的检测和筛选,仍有较大的研究空间,而采用微流控化学发光芯片对厚朴药材中抗氧化活性组分测试尚未见报道。
本文将基于微流控芯片分析技术,结合化学发光检测技术的高灵敏度特性,针对厚朴药材中抗氧化活性组分的测试需求,设计一种用于在分子水平上针对厚朴药材的抗氧化活性检测的微流控CL芯片,并构建微流控芯片-CL检测系统。采用Luminol-H2O2-Cu2+化学发光体系,对厚朴酚、和厚朴酚标品和系列厚朴提取物进行CL检测,并对系列厚朴提取物的抗氧化活性进行比较和评价。所建立的基于微流控化学发光芯片分析方法具有高灵敏度、低背景信号和良好稳定性等特性,可望为中药活性成分的检测和筛选提供技术途径。
2. 实验方法
2.1. 试剂与药品
所有试剂均为分析纯,实验用水均为去离子水。Luminol (AR, ≥97%)购买于sigma公司;无水乙醇、二甲基亚砜、氢氧化钠、无水碳酸钠、碳酸氢钠、H2O2 (30%)、五水硫酸铜均购买于成都科龙化工试剂厂。所有实验器皿使用之前用无水乙醇和去离子水超声洗净并干燥。
溶液配制如下:
Luminol储备液(0.10 mmol∙L−1):称取Luminol粉末0.0886 g,用0.10 mol∙L−1 NaOH溶液溶解并定容于50 mL容量瓶中,避光冷藏24 h后使用。
Luminol溶液(0.50 mmol∙L−1):用移液枪取250 μL 10.00 mol∙L−1 Luminol储备液,用pH = 10.47碳酸盐缓冲液稀释定容至50 mL。
H2O2储备液(0.10 mol∙L−1):用移液管准确量取30%H2O2 1.25 mL置于100 mL容量瓶中并定容。
H2O2溶液(1.00 mmol∙L−1):用移液枪取0.50 mL 0.100 mmo l∙L−1 H2O2储备液,用去离子水稀释至定容至50 mL
Cu2+溶液(0.50 mmol∙L−1):称取0.125 g五水硫酸铜,并用去离子水定容至1000 mL。
厚朴药材购买于重庆武隆药材种植基地,40℃烘干48 h后粉碎,过40目筛。
厚朴酚、和厚朴酚标准品(C18H18O2,AR,≥98%购买于四川维克奇生物技术有限公司。
2.2. 仪器和设备
MPI-A型多功能化学发光检测仪西安瑞迈电子科技有限公司
MCDR-A型多功能化学分析数据处理系统西安瑞迈电子科技有限公司
TG328B型光电分析天平上海精密仪器仪表公司
PB10型pH酸度计德国赛多利斯科学仪器有限公司
流动注射泵美国HARWARD公司
CKQ-50E型超声波清洗器昆山市超声仪器有限公司
RE-2000A型旋转蒸发仪上海嘉鹏科技有限公司
TS-NS型多功能提取罐上海顺仪实验设备有限公司
76-1型恒温水浴搅拌锅常州国华电器有限公司
2.3. 微流控CL芯片的加工制作
微流控CL芯片采用光刻和湿法化学蚀刻技术在钠钙玻璃上制作腔体和微管道,所用的掩膜采用CorelDRAW16.0软件设计,用高分辨率激光照排机在照相底片上制得光刻掩膜,用光刻机将掩膜上的图形转移到SG2506铬板基片的光胶层后,用0.50%NaOH除去铬层,在40℃恒温水浴锅中,用玻璃刻蚀液刻出微通道,用丙酮除净表面所有光胶,用铬液将所有的铬层完全除去,依次用去离子水、氢氧化钠和超纯水将玻璃基片测底洗净、待用。将PDMS预聚体与固化剂(质量比为10:1)混合均匀,脱气后浇注于载玻片上,放置在烘箱中加热固化形成PDMS盖片。基片与盖片采用自然封接方法进行封接。用去离子水和无水乙醇对玻璃基片和PDMS盖片反复清洗,在洁净室内用吹风机进行干燥,并趁热键合。将微流控CL芯片放入烘箱中在75℃条件下放置10 min。基于物理作用基片与盖片实现可逆键合,该芯片结合较为牢固,在较高流速下不会漏液。具体制作过程如图1所示。
2.4. 微流控CL芯片对厚朴酚及和厚朴酚CL的检测
2.4.1. 微流控芯片-CL检测系统操作过程及测试条件优化
微流控化学发光芯片分析检测单元如图2(b)所示。所有溶液均有精密注射泵从芯片溶液进口注入。发光试剂进口B、E分别通入H2O2和Luminol溶液,A、C为样本和缓冲液进样口。废液出口处W利用硅胶管连接并将废液导出暗盒之外。芯片放入暗盒之前放在无水乙醇中超声清洗并干燥,盖上PDMS盖片,用玻璃压紧,每个进口均与内径1 mm外径2 mm的硅胶管的一端相连,硅胶管另一端与1 mm注射器相连,芯片安装好之后将其放在暗盒中,在PMT窗口上固定有黑色挡板,上面设置有3 mm × 2 mm大小的空隙窗口,将其与芯片检测区域对准。关闭暗盒,将注射器中注入相应试剂或样本,并安装在注射泵中,然后开启流动注射泵,启动软件程序,记录发光强度曲线直至发光曲线趋于平稳。
具体样本测试过程中,缓冲液通入15 s后停止通入,并取而代之立即通入样本溶液10 s,之后停止通入样本溶液并再次通入缓冲溶液5 s,单个样本测试总时间为30 s。当测定完一个样本后立即移动芯片使另一个结构单元的检测窗口对准PMT进行平行检测。
微流控CL测试条件的优化:实验采用单一因素变量法对试剂流速、试剂浓度进行优化。测试步骤如上述。
2.4.2. 厚朴酚及和厚朴酚清除H2O2能力的标准曲线制作
实验采用Origin8.5Version软件绘制化学发光曲线图,将化学发光曲线的基线强度记为I0,加入不同浓度的厚朴酚及和厚朴酚后才产生的发光峰(倒峰)的峰值记为发I。根据公式1计算H2O2的抑制率。所

Figure 1. Production process of microfluidic CL chip
图1. 微流控CL芯片制作过程

Figure 2. Chip structure diagram (in mm). The total length of the chip size is 56.64 mm, width 30.86 mm; (b) the chip unit structure diagram. A, B, C, E is the sample or reagents imported, a diameter of 0.80 mm; W is the waste outlet, having a diameter of 1.00 mm; D is oval type detection cell, the long axis of 2.00 mm, minor 1.20 mm; (c) an enlarged view of a hybrid structure, the great-circle diameter of 0.68 mm, small round diameter of 0.28 mm; (d) mixed structure microscopic physical map
图2. (a)芯片结构示意图(单位:mm),芯片总尺寸为长56.64 mm、宽30.86 mm;(b) 芯片单元结构示意图,A、B、C、E为样本或试剂进口,直径均为0.80 mm;W为废液出口,直径为1.00 mm;D为椭圆型检测池,长轴2.00 mm、短轴1.20 mm;(c) 混合结构放大图,大圆直径为0.68 mm、小圆直径为0.28 mm;(d)混合结构显微实物图
有试验均重复3次。
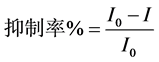 (1)
(1)
式中:
I0——空白基线发光强度;
I——通入抗氧化剂后最小发光强度(峰值);
测量条件:T: 16℃,Hi-V:-800 V。
以不同浓度样本对H2O2的抑制率(%)为纵坐标,样本浓度C (mg·mL−1)为横坐标,做出发光抑制率标准曲线,采用SPSS19.0统计软件计算出对自由基抑制率为50%时的待测样本的浓度IC50值。
2.5. 厚朴系列提取物对H2O2清除能力的微流控CL芯片测试
将实验制备得到的系列提取物浸膏分别溶解到100 mL容量瓶中,用50%乙醇–去离子水溶液溶解进行定容,记浓度均为1.00 g∙ml−1,将样本溶液配制成一系列浓度,按2.4.1所述方法进行化学发光测试(实验前依次用0.10 mol∙L−1 NaOH、无水乙醇、去离子水清洗微流控芯片,以保证实验结果的重复性和稳定性,所有溶液进入微流控CL芯片前均用0.22 μm微孔滤膜进行过滤以防堵塞微流控通道,实验过程中定期用无水乙醇清洗微流控CL芯片,每个样本重复测试三次,记录其化学发光图谱,并记录峰高I。
3. 结果与讨论
3.1. 微流控CL芯片的设计和表征
基于MEMS技术和化学发光原理,以快速检测抗氧化活性物质为研究目标,设计了集成混合、氧化还原反应和化学发光检测功能区的微流控芯片。如图2所示。
所设计的芯片包含四个结构单元,每个结构单元含一个蛇形通道、一个高效混合通道、一个椭圆形检测区D、一个废液出口W以及A、B、C、E四个进液口。其中A、C分别用于待测样本和缓冲液的进液口,B、E分别用于H2O2溶液和发光试剂Luminol (含Cu2+)的进液口。芯片前端的蛇形混合通道用于样本或缓冲液与H2O2两者的预混合,后端的高效混合区用于待测样本及H2O2与化学发光试剂Luminol的快速混合反应区,混合区之后的椭圆形区域作为化学发光的检测窗口。所有通道深80.00 μm,宽200.00 μm,进液口直径为1.00 mm。椭圆形检测窗口体积约为0.60 μL。除椭圆形检测区,芯片其余部分均用黑胶布贴住,保证了光电倍增管接受的光信号全部来自检测区域。这种设计的优势在于:多流道可将空白、对照和样本同步分析测试;流道上的蛇型混合通道与环型混合器组合具有更为良好的混合效率,以保障化学发光试剂和样本的充分混合,提高检测结构的稳定性;采用中心废液出口,方便整个测试系统采用负压输液,并保证4条通路在测试过程中的一致性。
3.2. 微流控芯片CL测试条件的优化
3.2.1. 溶剂流速对发光强度的影响
为获得更多的发光信号,使得待测试样与化学发光试剂混合物通过检测口时,发出的最大强度的光恰好被光电倍增管(PMT)采集到,因此,控制好进液流速非常重要。如果流速过快,还没等到大部分光信号发射,混合溶液可能已经流入废液池了,相反,如果流速过慢,溶液在经过检测池之前已经在混合通道出现最大发射信号,那么检测池所检测到的信号会降低,这样都不利于提高化学发光的灵敏度。本实验采用微泵精确控制试剂的流速,检测流速在2.0~14.0 µL∙min−1范围内与化学发光强度的关系,变化曲线如图2(a)所示。结果表明随着流速的增加CL信号强度也随之增加,当流速为10 µL∙min−1时信号强度达到最大值,再进一步增加进液流速到14 µL∙min−1时,CL信号强度逐渐减。当溶剂流速在2.0到10.0 µL∙min−1范围内逐渐增加时,反应物的混合效率也逐渐增加,反应信号强度也随之增加;当流速由10.0 µL∙min−1继续增加到14.0 µL∙min−1时,反应物在反应、检测通道内的保留时间会降低,在有限的保留时间内最大发射光不会出现,从而导致发光信号强度降低。因此实验中采用10.0 µL∙min−1的溶剂流速进行实验。
3.2.2. 试剂浓度对化学发光强度的影响
化学发光试剂对发光强度有直接的影响,有必要对二者的浓度进行优化。Luminol化学发光反应体系的最理想的pH范围是10.00~11.00,发光体系中碳酸盐缓冲液的存在能提高化学发光强度,实验所采用的缓冲液浓度为0.25 mol∙L−1,pH10.47。
实验对Luminol和H2O2的浓度对发光强度的影响进行了考察,Cu2+浓度固定0.50 × 10−3 mol∙L−1 H2O2浓度固定在1.00 mmol∙L−1,Luminol浓度在1.00 × 10−5 mol∙L−1 到1.00 × 10−3 mol∙L−1之间变化,当Luminol浓度为0.50 mmol∙L−1时发光信号强度达到最大值,增大浓度,化学发光强度基本不再增加,因此,采用0.50 mmol∙L−1 Luminol进行实验。
将Luminol浓度固定在0.50 mmol∙L−1,将H2O2浓度在1.00 × 10−4 mol∙L−1到0.01 mol∙L−1之间进行变化,化学发光强度随H2O2浓度增大而增大,但是H2O2浓度过高,溶液易产生气泡,化学发光信号不稳定,因此,采用1 mmol∙L−1浓度的H2O2进行实验。
实验对催化剂Cu2+浓度对化学发光强度的影响进行了考察,随着Cu2+浓度的增大,化学发光信号强度亦随之增大,当Cu2+铜离子浓度与Luminol浓度一致后,化学发光信号强度趋于平稳,因此选择Cu2+浓度为0.50 mmol∙L−1。具体情况如图3(b)~图3(d)所示。
3.3. 厚朴酚、和厚朴酚标品标准曲线制作
Luminol-H202-Cu2+化学发光体系首次有K.M. Kim [11] 等人提出,该体系在425 nm波长下产生蓝色荧光。体系中H2O2作为氧化剂而存在,当检测体系中有抗氧化剂存在时,抗氧化剂能够清除H2O2,从而
 (a) 流速(μL∙min−1) (b) Cu2+浓度(mol∙L−1)
(a) 流速(μL∙min−1) (b) Cu2+浓度(mol∙L−1) (c) H2O2浓度(mol∙L−1) (d) Luminol浓度(mol∙L−1)
(c) H2O2浓度(mol∙L−1) (d) Luminol浓度(mol∙L−1)
Figure 3. The effect of microfluidic flow rate on CL chip (a), luminol concentration (b), H2O2 concentration (c) and Cu2+ concentration (d) to the CL signal strength (Magnolol concentration 0.2 mg∙mL−1, honokiol concentration of 0.02 mg∙mL−1)
图3. 微流控CL芯片上流速(a)、luminol浓度(b)、H2O2浓度(c)和Cu2+浓度(d)对CL信号强度的影响(厚朴酚浓度0.20 mg∙mL−1,和厚朴酚浓度0.02 mg∙mL−1)
使化学发光强度减弱。实验中固定H2O2和Luminol化学发光试剂的量,并通过化学发光强度的减小量与抗氧化剂浓度之间建立定量关系。
采用DMSO溶剂将厚朴酚标品配成0.004 mg∙mL−1、0.020 mg∙mL−1、0.100 mg∙mL−1、0.200 mg∙mL−1、0.500 mg∙mL−1五个浓度的标品溶液,将和厚朴酚标品配成0.001 mg∙mL−1、0.005 mg∙mL−1、0.010 mg∙mL−1、0.050 mg∙mL−1、0.100 mg∙mL−1五个浓度的标品溶液,按2.4所述微流控芯片操作方法进行测试,测试结果如图4所示。
以标品对H2O2的清除率为纵坐标,标品浓度为横坐标,制作发光抑制标准曲线。在最优条件下,得到的厚朴酚、和厚朴酚回归方程如表1所示,厚朴酚、和厚朴酚相关系数均大于0.970,和厚朴酚检测限为0.300 μg∙ml−1,浓度为0.010 mg∙mL−1和厚朴酚标品测试的相对标准偏差为3.46%,样本耗样量仅为1.67 µl,测试时间为30 s,显示所设计的微流控CL芯片具有良好的可行性和低耗样量的优点。
采用SPSS17.0软件进行分析,计算出标品对H2O2清除率为50%时所需标品浓度为IC50,IC50值用来衡量厚朴酚与和厚朴酚的抗氧化能力。IC50越小,表明样本抗氧化能力越强。
厚朴酚清除H2O2的IC50为0.166 ± 0.040 mg∙mL−1,和厚朴酚清除H2O2的IC50为0.038 ± 0.005 mg∙mL−1,二者均有较好的抗氧化活性,和厚朴酚IC50比厚朴酚低一个数量级,因此,选用和厚朴酚作为实际样本厚朴药材系列提取物的当量转化对象。
3.4. 厚朴系列提取物样本的CL芯片测试和分析
将2.5方法所得的5种样本浸膏分别配制成一不同浓度的溶液且一式两份,其中第二份加入和厚朴酚标品,这两份均采用2.6所叙述的方法进行检测,每个浓度的样品测定三次,并计算样本对H2O2的清除率,根据表1的回归方程计算样本的当量含量(表2),表3为8%乙醇提取物的加标实验情况。当量抗氧化活性浓度计算公式如下:
 (a) (b)
(a) (b)
Figure 4. Different concentrations Magnolol (a), and magnolol (b) standard products chemiluminescence test pattern. Test conditions: luminol concentration was 0.50 mmol·L-1; H2O2 concentration is 1.00 mmol∙L−1; Cu2+ concentration was 0.50 mmol∙L−1; T: 16˚C, Hi-V: −800 V
图4. 不同浓度厚朴酚(a)、和厚朴酚(b)标品化学发光测试图谱。测试条件:Luminol浓度为0.50 mmol∙L−1;H2O2浓度为1.00 mmol∙L−1;Cu2+浓度为0.50 mmol∙L−1;T:16℃,Hi-V:−800 V

Table 1. The regression equation of Magnolol and honokiol antioxidant activity. Test conditions: luminol concentration was 0.50 mmol∙L−1; H2O2 concentration is 1.00 mmol∙L−1; Cu2+ concentration was 0.50 mmol∙L−1, Buffer pH = 10.47, flow rate: 10.00 μL∙min−1)
表1. 厚朴酚和厚朴酚抗氧化活性回归方程(测试条件:0.50 mmol∙L−1 Luminol,1.00 mmol∙L−1 H2O2,0.50 mmol∙L−1 Cu2+,缓冲液pH=10.47,流速:10.00 µL∙min−1)
备注:x:标品浓度(mg∙ml−1);y:抑制率(%)

Table 2. CL series chip test results of Magnolia extract samples. Test conditions: luminol concentration was 0.50 mmol∙L−1; hydrogen peroxide concentration is 1.00 mmol∙L−1; Cu2+ concentration was 0.50 mmol∙L−1, Buffer pH = 10.47, flow rate: 10.00 µL∙min−1)
表2. 厚朴系列提取物样本的CL芯片测试结果(测试条件:0.50 mmol∙L−1 Luminol,1.00 mmol∙L−1 H2O2,0.50 mmol∙L−1 Cu2+,缓冲液pH=10.47,流速:10.00 µL∙min−1)
备注:和厚朴酚IC50 = 0.038 ± 0.005 mg∙mL−1。

Table 3. The spiked recovery rate determination results of 80% ethanol extract samples (n = 3); Test conditions: luminol concentration was 0.50 mmol∙L−1; hydrogen peroxide concentration is 1.00 mmol∙L−1; Cu2+ concentration was 0.50 mmol∙L−1, Buffer pH = 10.47, flow rate: 10.00µL∙min−1)
表3. 80%乙醇提取物样本加标回收率测定结果(n = 3);(测试条件:0.50 mmol∙L−1 Luminol,1.00 mmol∙L−1 H2O2,0.50 mmol∙L−1 Cu2+,缓冲液pH = 10.47,流速:10.00 µL∙min−1)

80%乙醇提取物所含当量抗氧化物较高,因此可以推断80%提取物中厚朴酚、和厚朴酚含量较高,因此厚朴80%乙醇提取物可作为中成药作进一步研究应用。加标实验回收率均大于百分之九十,表明所设计的微流控CL芯片在实际样本应用中具有较高的稳定性,可望进一步为中药活性成分的检测和筛选提供技术途径。
4. 结论
本文设计并制作了集进样、反应和CL检测等功能结合于一体的微流控CL芯片,用以进行中药厚朴中抗氧化剂的测试研究。实验中,将芯片与CL测试方法相结合,利用实验室自行搭建的微流控分析测试平台,优化并建立了测试中药材厚朴中厚朴酚与和厚朴酚对H2O2的清除能力的方法,其线性范围分别为0.004~0.500 mg∙mL−1、0.001~0.100 mg∙mL−1,相关系数R2分别为0.984、0.973,该微流控CL芯片上可同时完成单一样本的多浓度测试,且测试所需时间为30 s,消耗样本仅为1.67 μL,大大提高了测试效率和通量,表明所构建的用于天然产物的抗氧化活性评价的微流控化学发光芯片分析系统具有很好的可行性。进而采用该芯片对五种厚朴提取物进行了活性评价,结果显示80%乙醇提取物所含当量抗氧化物最高,为82.4 mg和厚朴酚/g wt,可作为中成药作进一步研究应用。加标实验平均回收率均大于百分之九十,表明设计的微流控CL芯片在实际样本的测试中具有良好的实用性,因此有望为中药活性成分的检测和筛选提供技术途径。
基金项目
本文获得重庆市科技攻关项目(cstc2015jcsf8001)和(cstc2015jcyBX0010)资助,以及中央高校基本科研业务费专项重点项目(106112015CDJZR225512)资助。