1. 引言
水解金属离子溶液中的游离酸度定义为水解金属离子被分离或掩蔽后不再干扰测量过程的溶液酸度 [1] [2] 。对于简单的溶液,测量溶液游离酸度的方法很多,主要有:指示剂碱量滴定法、电位滴定法、电导测量法、库仑碱量滴定法、测温碱量滴定法、高频碱量滴定法、非水滴定法等,但是在存在水解离子的多金属溶液体系中,溶液中离子状态复杂,首先必须消除妨碍游离酸度测量的干扰离子。排除水解离子干扰的方法有:离子交换、沉淀分离、溶剂萃取、中性盐提高质子活度和配位剂掩蔽等,在这些方法中,配位掩蔽法操作简单、快速、效率高、准确度好,是快速化学分析抑制水解离子干扰的主要方法。近年来,应用配位掩蔽法研究游离酸度的测定得到了快速发展,也发表了相关文献 [1] [3] [4] ,但文献分散且很少有综述性文章发表。本文综述了过去几十年文献中报道测定游离酸度时抑制水解离子干扰的配位剂的种类和应用,以及配位剂在酸度测定中的重要性。
2. 配位掩蔽法测定游离酸度的基本原理
配位掩蔽法是向溶液中加入配位剂,利用配位反应与干扰离子形成足够稳定的配合物,使干扰组份在选定的操作条件下不再干扰分析反应的进行。配位掩蔽法不需分离干扰离子就能直接准确地对溶液酸度进行分析测定,它既克服了干扰组分的影响,也避免了繁冗的物理分离,是化学分析中经常使用的消除干扰的有效手段。
配位剂常含有孤对电子,容易提供电子对与价数高、半径小的阳离子形成稳定的配离子,抑制金属水解离子的干扰,避免氢氧化钠溶液的过量消耗,使游离酸浓度的测定能够准确地进行。
水解离子M在配位剂溶液中的平衡关系可表示如下:

为简单起见,式中:M表示中心离子,L表示配体,金属离子和配体以及由它形成的配离子所带电荷省去不写(除要说明的离子价态外)。
对于主反应,在水溶液中M与L形成各级单核配离子 ,那么,建立平衡后,体系中平衡常数表达式为:
,那么,建立平衡后,体系中平衡常数表达式为:
 (1)
(1)
其中 为第i级配离子MLi的积累稳定常数,[M]、[L]和[MLi]分别是游离金属离子M、配体L和配合物MLi的浓度。
为第i级配离子MLi的积累稳定常数,[M]、[L]和[MLi]分别是游离金属离子M、配体L和配合物MLi的浓度。
假定配体L及配合物均不发生副反应,只考虑金属离子的水解反应,则对金属离子引入水解效应系数( ),也就是金属离子在未沉淀成氢氧化物以前会形成一系列不同的羟基配合物,从而使游离的金属离子浓度降低,则离子水解带来的影响为:
),也就是金属离子在未沉淀成氢氧化物以前会形成一系列不同的羟基配合物,从而使游离的金属离子浓度降低,则离子水解带来的影响为:
 (2)
(2)
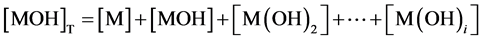

 (3)
(3)
[MOH]、[M(OH)2]、[M(OH)i]和[MOH]T分别是各级离子羟基配合物和发生水解离子的总浓度, 为条件稳定常数。
为条件稳定常数。
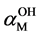 越大,表示水解副反应程度越大,
越大,表示水解副反应程度越大, ,表示没有水解副反应发生。
,表示没有水解副反应发生。
酸度愈低,水解效应愈大; 最小时,
最小时, 值最大,这时配位剂的掩蔽效果最好。当溶液中配体与金属离子形成配合物的稳定常数足够高时,可以认为金属离子不水解,
值最大,这时配位剂的掩蔽效果最好。当溶液中配体与金属离子形成配合物的稳定常数足够高时,可以认为金属离子不水解, ,
, ,由此可方便看出配合物稳定常数对金属离子水解的影响。在一定酸度下,如果[M]和[L]是已知的,溶液中游离金属离子浓度大小主要取决于配合物稳定常数的大小,稳定常数愈大,配合物愈稳定,游离的金属离子浓度愈小,掩蔽的愈完全。而配位剂掩蔽的目的是把干扰的金属离子游离浓度减小到足够低,使它不足以影响游离酸度的测定,最有效的掩蔽剂是选用使溶液中游离金属离子浓度最小的那种掩蔽剂。
,由此可方便看出配合物稳定常数对金属离子水解的影响。在一定酸度下,如果[M]和[L]是已知的,溶液中游离金属离子浓度大小主要取决于配合物稳定常数的大小,稳定常数愈大,配合物愈稳定,游离的金属离子浓度愈小,掩蔽的愈完全。而配位剂掩蔽的目的是把干扰的金属离子游离浓度减小到足够低,使它不足以影响游离酸度的测定,最有效的掩蔽剂是选用使溶液中游离金属离子浓度最小的那种掩蔽剂。
3. 配位剂在测定游离酸度时的应用
在含多种金属离子的酸性溶液中,游离酸测定常用配位掩蔽剂主要有:硫酸盐、氟化物、草酸盐、草酸盐-氟化物、EDTA、硫氰酸盐、酒石酸盐、柠檬酸盐、吡啶-2,6-二甲酸、DTPA、TTHA,现分别简述如下。
3.1. 硫酸盐
Ahrland [5] 利用饱和硫酸铵与 形成稳定配合物后,用两种方法测定了铀酰溶液中的游离酸。对于酸度在0.3~7.2 mol/L的溶液,铀离子浓度分别为200 g/L和400 g/L时,用电位碱量滴定法测量结果误差分别为2%~3%和2%~5%;当溶液中酸度小于0.3 mol/L时,用pH测量法,溶液酸度为250 mmol/L,结果误差是5%~7%;当溶液酸度为25 mmol/L,误差增加到20%。Ahrland的pH测量法对铀浓度<100 g/L的体系是适用的,对于铀浓度更大的样品将产生较大的偏差。谢永怀等人 [6] 改进了Ahrland的pH测量法,考虑了饱和硫酸铵溶液中原有酸量后,能适用于测定更高酸度和更高铀酸比溶液中的游离酸,测定误差明显比Ahrland小,相对误差不超过±5%。
形成稳定配合物后,用两种方法测定了铀酰溶液中的游离酸。对于酸度在0.3~7.2 mol/L的溶液,铀离子浓度分别为200 g/L和400 g/L时,用电位碱量滴定法测量结果误差分别为2%~3%和2%~5%;当溶液中酸度小于0.3 mol/L时,用pH测量法,溶液酸度为250 mmol/L,结果误差是5%~7%;当溶液酸度为25 mmol/L,误差增加到20%。Ahrland的pH测量法对铀浓度<100 g/L的体系是适用的,对于铀浓度更大的样品将产生较大的偏差。谢永怀等人 [6] 改进了Ahrland的pH测量法,考虑了饱和硫酸铵溶液中原有酸量后,能适用于测定更高酸度和更高铀酸比溶液中的游离酸,测定误差明显比Ahrland小,相对误差不超过±5%。
Anwar等 [7] 分别以Na2SO4和(NH4)2SO4作配位剂,NaOH和Na2CO3作滴定剂,用电位滴定法测量硝酸铀溶液中的硝酸回收结果偏差是−5%~+74%。
Chwasowska等人 [8] 在有硫酸铵存在时用NaOH溶液电位滴定铀、铝和镁硝酸盐溶液中的游离酸度,结果相对偏差为0%~8.0%,样品中硝酸含量下降,偏差增加。加入25%的草酸钾(其摩尔数是Al的3~10倍),会抑制铝的干扰。
3.2. 氟化物
氟化物是游离酸测定中应用最多的配位掩蔽剂。
戎关镛 [9] 采用NH4F掩蔽酸性镀铜液中Fe(III),7次测量其中的游离H2SO4的标准偏差为±0.08 g/L,硫酸加标回收率是95.9%。李升章等人 [10] 用NH4F作配位剂,避免了Fe3+、Al3+、Ti4+等离子由于水解反应对游离酸浓度测定的干扰。8次测量钛精矿稀盐酸分解母液的游离酸结果是57.64 g/L,偏差0.39 g/L,相对偏差0.68%;盐酸回收率均在98%以上。8次测定钨锡矿中盐酸分解母液的游离酸结果是69.95 g/L,偏差0.16 g/L,相对误差0.23%;盐酸回收率约95%。涂文志 [11] 在高冰镍生产电解铜和镍及铜锰联产湿法冶炼试验样品分析实践中,结合K4Fe(CN)6沉淀多种金属离子和用NH4F掩蔽残留Fe3+离子的方法,在试样溶液中各种金属离子总含量达160 g/L左右时,得到H2SO4标准加入回收结果绝对偏差为−1.24~0.86 g/L,相对偏差均小于5%。
陈培军等人 [12] 以KF溶液(中性)掩蔽硫脲浸金液中铁离子,用标准NaOH溶液滴定游离硫酸结果偏差是−0.008%~0.21%,标准加入回收率为101%~102%。
Munemori [13] 以NaF作掩蔽剂、用高频滴定方法测定了含铁、铝等水解离子溶液中的游离酸。在0.01 mol/LFe3+溶液中,加入0.134~0.256毫摩尔硫酸,用0.1 mol/LNaOH滴定结果偏差是±0.003毫摩尔;在含Al(III) 0.01 mol/L溶液中加入0.078~0.130毫摩尔硫酸,滴定结果偏差是−0.003~0.001毫摩尔。Umamaheshwari等人 [14] 用NaF作水解离子的配位剂,应用容量滴定法快速测定了硝酸锆溶液中游离酸浓度以及氧化锆的含量,测定精度分别是±0.02 mol/L和±0.5 g/L。
应该指出的是,在酸性溶液中加入KF或NH4F配位剂,容易生成HF混合物,HF会与玻璃器皿反应消耗质子,产生负偏差。Sahara等人 [15] 用聚丙烯材料作容器,避免了HF与玻璃容器接触。Menis等人 [16] 用铂-铑合金作指示电极,避免使用玻璃电极受到HF的影响,用氟化物与铀形成配合物消除了铀离子水解的干扰,当硫酸铀溶液中[U/H+]比值在0.5~16之间,测定结果相对标准偏差(RSD)是±1.5%~±3%。
3.3. 草酸盐
20世纪50年代早期,草酸盐配位和碱量滴定是常规测定游离酸度的主要方法之一。
Booman等人 [17] 用草酸钾作配位剂,选定合适的pH,分别从1.5 mol/L铀、铝、钍和铁的硝酸盐溶液中用电导滴定法测定了各自金属离子溶液中的游离酸。王翼卿等人 [18] 用8%草酸钾做配位剂以消除Fe3+、Al3+、Nd3+等多种水解离子的影响,用0.1 mol/L标准氢氧化钠溶液直接电位滴定模拟高放废液中游离酸的含量,结果RSD为1.8%,标准加入回收率为100%~101%。李集福等人 [19] 以pH值为6.50的草酸钾溶液作为配位剂,消除溶液中U(VI)、Fe(III)、Al(III)、Mo(VI)、Cr(III)、Ni(II)、Mn(II)等多种水解离子对测定酸度引起的干扰,用标准碱进行滴定。方法曾用于两个工厂中不同体系高放废液的酸度分析,样品分析的最大相对偏差在±4%以内,样品重加回收结果在99.6%~101.0%之间。方法简单快速,能实现远距离操作,因此适合于高放样品的常规分析。Pakalns [20] 用两种方法测定了水解离子存在下的游离酸度,在草酸钾媒介中滴定,pH达到预定的6.05,Bi(III)、Ce(IV)、Sb(III)、Sn(II)、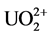 和
和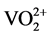 离子也不会水解,氨离子干扰能够通过加入过量的草酸钾形成配合物而克服。
离子也不会水解,氨离子干扰能够通过加入过量的草酸钾形成配合物而克服。
Ryan等人 [21] 在高浓度钚溶液中试验了三种游离酸的测定方法,发现广泛使用的碘酸盐沉淀方法在高浓度钚溶液中结果偏差较大,而改进后的草酸盐配位法能在高达400 g/L钚溶液中得到游离酸测量准确结果,标准偏差小于0.02 mol/L。
马艳等人 [22] 将草酸钠掩蔽法用于电解铜溶液中游离酸的测定,加标回收率>98%。
詹柏熙 [23] 用草酸铵掩蔽硝酸铁溶液中的三价铁,8次测定溶液中游离酸平均值为0.498 mol/L,标准偏差0.002 mol/L,RSD是−2%,变异系数0.41%,加入硝酸回收率99.2%~99.8%。
3.4. 草酸盐-氟化物
Mayankutty等人 [24] 在中性草酸钾媒介中,用三种方法对高浓度铀溶液中游离硝酸的测定结果表明:利用草酸盐-氟化物混合物作配位剂的方法在准确度、精度和消除杂质干扰方面更优越。并与阳离子交换得到的结果做了比较 [25] ,还探讨了三种流程中离子Th(IV)、Al(III)和Fe(III)的允许极限量。
岳廷盛 [26] 在铀酰溶液中直接加入F−、 离子,在DMF的非水介质中(pH = 6.0 ± 0.5),
离子,在DMF的非水介质中(pH = 6.0 ± 0.5), 与F-、
与F-、 形成稳定的[UO2(C2O4)∙F3∙H2O]3−复合配合物,有效掩蔽了
形成稳定的[UO2(C2O4)∙F3∙H2O]3−复合配合物,有效掩蔽了 离子。借助于电位滴定法,用Na2B4O7溶液快速而准确的滴定出铀酰溶液中的游离酸浓度,滴定误差是−6.4 × 10−4%,比文献 [24] 介绍的水溶液中滴定结果误差(0.5%~1.87%)小。
离子。借助于电位滴定法,用Na2B4O7溶液快速而准确的滴定出铀酰溶液中的游离酸浓度,滴定误差是−6.4 × 10−4%,比文献 [24] 介绍的水溶液中滴定结果误差(0.5%~1.87%)小。
Benadict等 [27] 报道了在高负载条件下、用1.1 mol/L磷酸三异戊酯/正十二烷从硝酸媒介中萃取测量U(VI)的分布,在有机相中用草酸盐-氟化物混合物作配位剂测量的游离酸度比单独用草酸盐得到的结果更可靠,金属与游离酸的摩尔比是10:1。
3.5. EDTA
Zhu [28] 用Ca-EDTA作掩蔽剂,pH定为4.5,在稀土含量为100 g/L (其中50 g/L铈)溶液中,游离硫酸测量结果RSD < 1%,5组已知硫酸溶液50次测量结果误差是−1.44%,该法精度高、准确度好,过程简单,不需指示剂,对含Fe(III)、Al(III)、Th(IV)和U(IV)溶液同样适用。
Ganesh等人 [2] [29] 用EDTA掩蔽U(IV)、Pu(IV)等金属离子,用标准碳酸钠溶液测量了游离酸,滴定终点pH定为3.0,此后加入甲醛释放出与肼等量的酸,用同样的Na2CO3溶液测定出肼的含量,硝酸回收率达98.9%,RSD为1.2%;肼回收率99%,RSD是2%。该法不会产生草酸或硫酸盐等腐蚀性废液,在分析废液最后排放前,铀等有价金属容易从中回收。
湿法炼锌过程中,存在着多种高浓度的水解干扰离子和较高浓度的MgSO4,Rolia [30] 利用MgSO4与EDTA形成Mg-EDTA,取代更常使用的钙-EDTA与金属离子配位,整个分析时间是5~10 min。在17g/L Fe3+ + 12 g/L Mg2+ + 13~170 g/LZn2+溶液中,0.2N游离硫酸测量结果偏差最大±0.05%,锌浓度改变对游离硫酸测量结果几乎没影响;12 g/L Mg2+ + 65 g/LZn2+ + 3.35~43.5 g/L Fe3+溶液中,0.2N游离硫酸测量结果偏差最大在−1.5%~1.5%,只要Mg-EDTA足量,铁浓度没有太大影响。在65 g/LZn2+ + 17 g/L Fe3+ + 12 g/L Mg2+溶液中,HCl浓度为0.098~1.172 × 10−3当量,测量误差为−4.1%到−0.8%。
吴继宗 [31] 选用Zn-EDTA二钠盐抑制了Fe3+、Pu3+、Pu4+、Zr4+、Cr3+等高价易水解离子的水解,建立了容量稀释-分光光度法快速测定后处理工艺溶液中游离酸的方法,分析周期小于5分钟,对1AF料液的酸度进行了分析,其结果与定pH值-酸碱滴定法结果在3%范围内一致。建立的流动稀释-分光光度法测定游离酸的线性范围为0.7~2.5 mol/L,测定2.00 mol/LHNO3时的RSD < 0.4%;利用设计加工的流通池和光纤将测定系统远距离化,测定游离酸的线性范围为0.9~2.5 mol/L,测定2.00 mol/LHNO3时的RSD < 3%。
3.6. 硫氰酸盐
周锦帆 [32] 采用硫氰酸铵与Fe3+、Co2+、Ni2+、Cd2+和UO22+形成配合物,用0.2 NNaOH溶液作滴定剂,并将滴定终点pH提前到3.0,避免Al3+水解,然后用标准曲线法测定矿石硫酸浸出液中游离酸。本方法精密度误差<±2%,回收率为100%~102%,操作简便,在15分钟内即能分析6个样品。
在含0.001mol/L H+和1mol/L KSCN的溶液中,Baumann等人 [33] 测量了含有水解离子Al(III)、Cr(III)、Fe(III)、Hg(II)、Ni(II)、Th(IV)和U(VI)的溶液游离酸度。溶液中容忍的金属离子浓度可为酸浓度的2.5倍,测量结果的RSD为±2%,该法已用于含Pu(III)的核处理溶液中。KSCN是强酸强碱盐,对溶液体系中酸的测定没有影响。
3.7. NH4SCN-(NH4)2C2O4-NaF
岳廷盛 [34] 在测定UO22+或U4+溶液中的游离H2SO4浓度时,使铀与SCN−、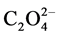 、F−生成稳定的复合配合物,避免铀的水解。在优化实验条件下,测定游离H2SO4的误差<±1%。这是一种快速准确的测定方法,用离子交换法验证了其测定结果.
、F−生成稳定的复合配合物,避免铀的水解。在优化实验条件下,测定游离H2SO4的误差<±1%。这是一种快速准确的测定方法,用离子交换法验证了其测定结果.
3.8. 酒石酸盐
罗重庆 [35] 通过在萃取料液中,加入饱和酒石酸钾钠抑制钽铌水解,回收试验中总酸回收率为99.8%~100.1%。Rajan [36] 在氯化锑溶液中加入100 g/L酒石酸盐作掩蔽剂,用NaOH滴定总酸,用溴酸盐滴定锑含量,从而计算出结合酸度,该法比早期的电位滴定技术简单、快速。
3.9. 柠檬酸盐
Pflug等人 [37] 使用精密Dow自动滴定仪,以柠檬酸盐作配位剂,防止钚的水解,用NaOH溶液滴定了钚溶液中的游离酸度,实验证明:如果开始和终点pH在7.5和8.5之间,柠檬酸盐非常有效,对于浓度7.46 N的硝酸溶液分析误差是±0.06 N。
3.10. 其它
WAGNER等人 [38] 利用吡啶-2,6-二甲酸的配位性质和水/DMSO (二甲基亚砜)混合物,测定了铀、钚等核材料高浓度溶液中的游离酸度,在满足有机相或水相中[H+]/[金属]≥5 × 10−2条件下,测定结果RSD为1%。
Nakashima和Lieser [39] 利用DTPA (pH6.1-6.86)或TTHA (pH7.8)溶液与金属离子U(VI)、Th(IV)、U(IV)、Zr(IV)和U(VI)-U(IV)、U(VI)-Th(IV)配位,然后用NaOH滴定得到总的酸度。当DTPA单独作为配位剂使用,会得到如下的偏差,其中括号中是金属离子含量的最大值,对于Th(IV),±1.4% (116 mg);U(IV),±2.0%(245 mg);Zr(IV),±2.3% (46 mg)。在U(VI)-U(IV)混合溶液中,DTPA结合草酸盐/氟化物(2:1)使用,在119 mg U(VI)~209 mg U(IV)中结果偏差为±3.9%,而在 119 mg U(VI)~464 mg Th(IV)混合溶液中,偏差为±2.7%。
4. 展望
从上面的综述可以看出,用硫酸盐、氟化物、草酸盐和EDTA作配位剂和碱量滴定游离酸度,使用最多且操作简单,偏差和精度在可接受范围。事实上配位剂在水解金属离子存在的溶液中测定游离酸度方面获得了卓有成效的应用,选择适宜的掩蔽剂是建立选择性或专一性分析方法的有效途径之一。溶液中加入配位剂,改变了水解离子在样品中的存在形态,消除或降低了水解离子的干扰,保证了分析结果的准确性和精密度。但在使用配位剂时,也应注意水解离子与配位剂的反应性能和用量,游离配位剂的浓度不宜过多地超过必须使用的浓度,只能控制在合理的范围之内。目前,关于选择配位掩蔽剂的理论和现有掩蔽剂的应用还研究得不够充分,有的金属离子尚缺乏有效的配位剂,再加上溶液中组分间的影响非常复杂,因此,在配位剂和配位掩蔽法的使用上具有一定的局限性。在今后的游离酸分析测定工作中,关于配位剂的掩蔽效应和作用机理还有很多问题待做深入探索,特别是新的高选择性、高效力的配位掩蔽剂的研究、配位剂的合理应用(包括混合配位剂的应用)以及掩蔽作用的定量理论研究等方面有待深度研究。
项目基金
湖南省科技厅社会发展支撑计划资助项目(2015SK2052-1)。