1. 引言
随着人类工业的进步,地球环境的日益恶化已经成为人们急需解决的问题之一 [1] 。以Pb2+污染为代表的重金属污染也给自然界带来了极大的隐患 [2] 。Pb2+主要污染土壤,土壤中的Pb2+主要来源于人类的采矿、金属的冶炼、含铅汽油的燃烧、污水灌溉等生产生活活动 [3] 。由于它在土壤中只存在价态上的变化,所以很难得到有效的清除和治理 [4] 。Pb2+对植物体进行正常的新陈代谢有严重的阻碍作用。已有研究报道,土壤中的Pb2+会使植物的光合作用、呼吸作用、色素合成等生命活动受到抑制,从而影响植物的生长 [5] [6] [7] 。桢楠(Phoebe zhennan),又名楠木,为樟科(Lauraceae)楠属(Phoebe)植物,其木材是享誉盛名的“金丝楠木”,明清时为皇族专用,具有很高的经济价值 [8] 。由于其挺拔优美的树形和四季常绿的特性,日益受到人们的青睐,常被用于庭院绿化树种。随着污染的加剧,土壤中的Pb2+势必会影响桢楠的生长,提高其对Pb2+污染的耐受力势在必行。一氧化氮(Nitric oxide, NO)是在植物体内新发现的生理调控信号物质,与多项生命活动紧密相关,对植物抗逆性的增强也有极大的意义 [9] 。NO对缓解植物在不利条件下遭受到的胁迫(如盐碱胁迫、水分胁迫和重金属胁迫等)有重要意义。本研究探讨了在Pb2+胁迫下对桢楠幼苗叶片喷施不同浓度的SNP (亚硝基铁氰化钠,NO供体,用去离子水现配现用)溶液后,对其生理特性(抗性指标和光合指标)所产生的影响,反映NO对桢楠幼苗抗Pb2+胁迫抗性的影响,以期为桢楠的推广研究提供借鉴依据。
2. 材料与方法
2.1. 试验方法
试验于2016年4月20日开始,于2016年10月20日完成,总共持续约6个月。在长江大学园艺园林学院楠木苗圃地内选择长势相同且健壮的一年生桢楠小苗180棵。随机分成6组,每组均以园土为种植基质,移栽与花盆内,自然生长100天后进行药剂和胁迫处理。分别于8月9、11、13、15分四次选择在傍晚时分对每组小苗喷施浓度分别为0 (CK1)、0 (CK2)、0.1 mmol/L (N1)、0.25 mmol/L (N2)、0.5 mmol/L (N3)和0.75 mmol/L (N4)的SNP溶液,以喷施清水作对照(CK1, CK2)处理,每个重复10株,每个处理设置3个重复。于8月20日开始Pb2+胁迫处理,根据在刨花润楠上的研究 [10] ,我们选择在傍晚时分对胁迫组(CK2, N1, N2, N3, N4)小苗根部施用浓度为900 mg/L的Pb (NO3)2溶液,以施用等量清水作为对照(CK1),每周喷施一次;在处理时同时按浓度为0 (CK1)、0 (CK2)、0.1 mmol/L (N1)、0.25 mmol/L (N2)、0.5 mmol/L (N3)和0.75 mmol/L (N4)的SNP溶液处理桢楠小苗,每周一次。各浓度SNP溶液现配现用,分解变质。整个试验期间正常水肥管理,于2016年10月10日停止所有处理,生长10天后取样。取适量当年生功能性叶片,于−84℃超低温冰箱中保存备用。
2.2. 指标测定方法
桢楠幼苗叶片的光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci)等光合生理指标均用光合指标测定:采用美国Li-6400便携式光合测定仪,在各处理的每个重复中均选取3~4片当年生新梢成熟功能叶片进行测定,每个叶片进行7~9次读数取平均值。测定时间为2016年10月20日上午10:00,天气晴朗,按CK1、CK2、N1、N2、N3、N4的顺序依次测定。依据得到的光合生理参数进行叶片气孔限制值(Ls)和水分利用效率(WUE)的计算。计算公式为:Ls = 1 − Ci/Ca;WUE = Pn/Tr。可溶性蛋白质、MDA和叶绿素含量,POD和SOD活性均依据邹琦的方法 [11] 进行测定。
2.3. 数据分析
数据处理均采用SAS 10.0统计软件及Excel 2016软件进行。并用方差分析法和Duncan多重比较法对处理后的桢楠一年生苗的生理指标进行比较和分析;采用基于模糊数学的隶属函数值法为SNP对Pb2+胁迫下桢楠小苗的抗性进行综合比较评估,隶属函数值按如下方式 [12] 进行:
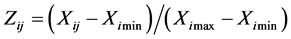
若指标与抗逆性为负相关,计算方法为:

式中:Zij为i组别j指标的抗逆性隶属函数值;Xij为i组别j指标的测定值;Ximin和Ximax分别是所得的各处理指标数据的最小值和最大值。比较各处理指标的平均值,哪个处理的平均值越大,表明该处理对Pb2+胁迫的抗性的影响越强。
3. 结果与分析
3.1. SNP对Pb2+胁迫下桢楠叶片的可溶性蛋白质含量的影响
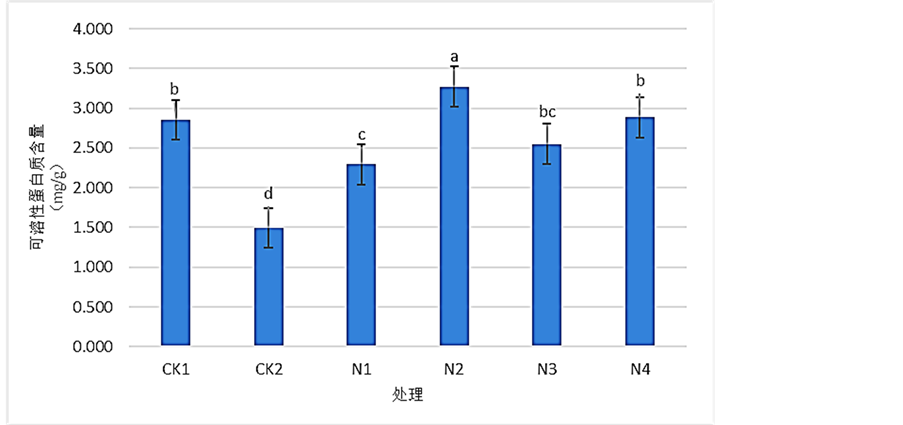
由图1可以看出,经过浓度为900 mg/L的Pb (NO3)2溶液处理后,CK2的可溶性蛋白质含量显著低于CK1、N1、N2、N3和N4,表明受到胁迫后桢楠叶片的可溶性蛋白质含量发生了显著的下降,相比于CK1下降了约47.70%;经过SNP处理后,N1、N2、N3、N4的光合速率均较CK2发生了显著性的提高,并且随SNP溶液浓度的上升呈先上升再下降的趋势。N1、N2、N3、N4相比于CK2分别提高了约53.71%、119.17%、71.01%和93.26%,显然以N2处理提高更为显著。结果表明:Pb2+胁迫能显著降低桢楠叶片可溶性蛋白质含量,在喷施SNP溶液后得到了显著提高,其中以SNP浓度为0.25 mmol/L时效果最好。
3.2. SNP对Pb2+胁迫下桢楠叶片的POD活性的影响
图2所示,由CK1和CK2比较后可知,Pb2+胁迫后,桢楠叶片的POD活性发生了显著的下降,相比于CK1下降了约64.27%。喷施SNP后,N1、N2、N3、N4处理的POD活性均显著高于CK2,随着
 注:图中不同小写字母表示为差异显著(P < 0.05)。
注:图中不同小写字母表示为差异显著(P < 0.05)。
Figure 1. Effects of SNP on the content of soluble protein of Phoebe zhennan seedlings leaves under Pb2+ stress
图1. 各浓度SNP对Pb2+胁迫下桢楠叶片可溶性蛋白质含量的影响
 注:图中不同小写字母表示为差异显著(P < 0.05)。
注:图中不同小写字母表示为差异显著(P < 0.05)。
Figure 2. Effects of SNP on the activities of POD of Phoebe zhennan seedlings leaves under Pb2+ stress
图2. 各浓度SNP对Pb2+胁迫下桢楠叶片POD活性的影响
处理浓度的增加大体上呈上升趋势,并且在CK2的基础上分别增加了约64.41%、166.80%、249.60%和248.41%。喷施SNP后,桢楠叶片的POD活性随着SNP浓度的上升大体上呈现为上升趋势,在N3时达到最高。结果表明:Pb2+胁迫能显著抑制桢楠叶片的POD活性,在施用SNP溶液后得到了明显的上升,以SNP浓度为0.5 mmol/L时效果为佳。
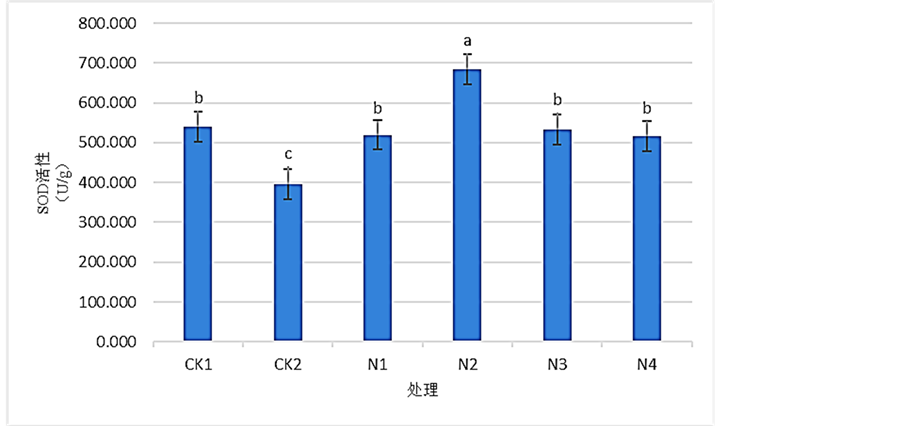
3.3. SNP对Pb2+胁迫下桢楠叶片的SOD活性的影响
如图3所示,由CK1和CK2比较后可知,桢楠受到Pb2+胁迫后,桢楠叶片SOD活性发生了下降,
 注:图中不同小写字母表示为差异显著(P < 0.05)。
注:图中不同小写字母表示为差异显著(P < 0.05)。
Figure 3. Effects of SNP on the activities of SOD of Phoebe zhennan seedlings leaves under Pb2+ stress
图3. 各浓度SNP对Pb2+胁迫下桢楠叶片SOD活性的影响
CK2相比于CK1下降了约26.76%。施用SNP溶液后,桢楠叶片的SOD活性呈现出的是先增加再下降的趋势,且均显著性的高于CK2处理。N2最高,且与其他组合间均有着显著性差别,N1、N3和N4间SOD活性都比较接近。N3处理的SOD活性最高,相比于CK2提高了约73.14%。结果表明:Pb2+胁迫显著的降低了桢楠叶片的SOD活性;在喷施SNP溶液后得到了显著的提高,以SNP浓度为0.25mmol/L时效果为佳。
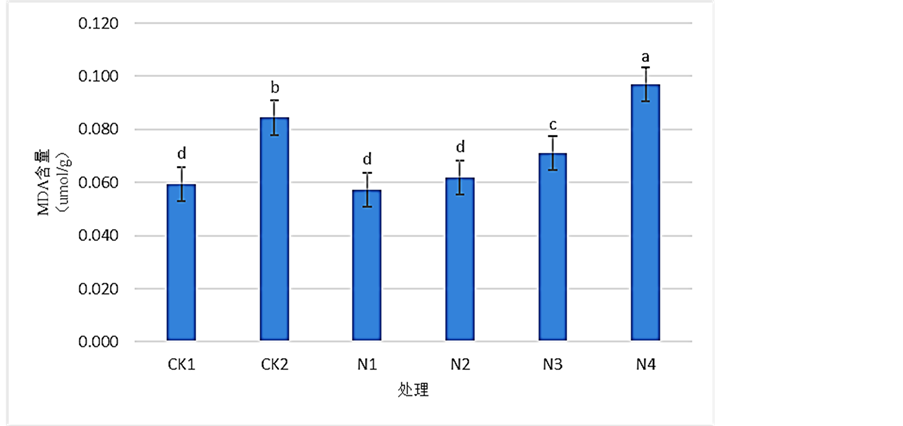
3.4. SNP对Pb2+胁迫下桢楠叶片的MDA含量的影响
如图4所示,由CK1和CK2比较后可知,在桢楠受到Pb2+胁迫后,桢楠叶片MDA含量发生了上升,与CK1相比上升了约41.88%。施用SNP溶液后,除N4处理外其他各个处理组桢楠叶片的MDA含量均得到了显著的减少。在N1处理时达到最低,在CK2的基础上减少了约32.14%。结果表明:Pb2+胁迫能够显著增加桢楠叶片的MDA含量;0.1mmol/L的SNP溶液处理能够使受Pb2+胁迫后桢楠叶片的MDA含量得到显著降低。
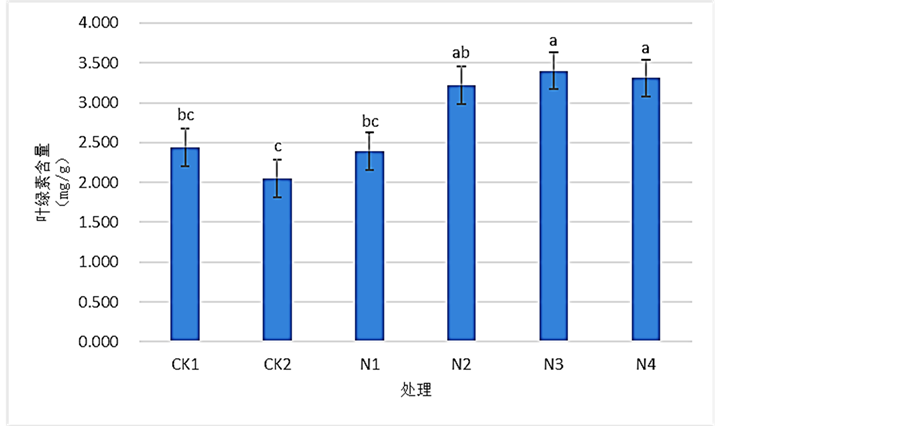
3.5. SNP对Pb2+胁迫下桢楠叶片的叶绿素含量的影响
如图5所示,由CK1和CK2比较后可知,桢楠受到Pb2+胁迫后,桢楠叶片叶绿素含量发生了小幅的下降,下降不显著,相比于CK1下降了约16.18%。在施用SNP溶液后,桢楠叶片叶绿素含量随着处理浓度的提高,呈先上升后小幅减小的走势,且除N1外N2、N3、N4的叶绿素含量均较CK2均得到了显著的上升。其中N3处理叶绿素含量的增加最为明显,相比于CK2上涨了约66.23%。结果表明:900 mg/L的Pb (NO3)2溶液处理,降低了桢楠叶片的叶绿素含量,0.5 mmol/LSNP溶液是能够显著缓解这种因Pb2+胁迫而导致降低的最佳选择。
3.6. SNP对Pb2+胁迫下桢楠叶片的光合生理的影响
由表1可见,经过浓度为900 mg/L的Pb(NO3)2溶液处理后,CK2的光合速率(Pn)显著低于CK1,相比于CK1下降了约33.07%;桢楠叶片在气孔导度(Gs)、蒸腾速率(Tr)、水分利用效率(WUE)和叶片气孔
限制值(Ls)等方面发生了下降,相比于CK1分别下降了约15.91%、20.18%、15.46%和19.1%,但是变化都不显著;桢楠叶片胞间CO2浓度(Ci)发生了上升,相比于CK1上升了约7.92%,上升也不显著。
施用SNP溶液后,N1、N2、N3、N4的Pn、Gs和Tr均较CK2发生了显著性的提高。由表1可知,N1处理时桢楠叶片的Pn值最高,相比于CK2提高了约61.58%;在N3处理时,桢楠叶片的Gs、Ci和Tr值达到最高,相比于CK2分别提高了约183.78%、12.52%和88.02%,与CK2处理均有显著性差异;在N3处理时,桢楠叶片Ls达到最低,相比于CK2下降了约45.06%,且与CK2有显著性差异;N1、
 注:图中不同小写字母表示为差异显著(P < 0.05)。
注:图中不同小写字母表示为差异显著(P < 0.05)。
Figure 4. Effects of SNP on the content of MDA of Phoebe zhennan seedlings leaves under Pb2+ stress
图4. 各浓度SNP对桢楠叶片MDA含量的影响
 注:图中不同小写字母表示为差异显著(P < 0.05)。
注:图中不同小写字母表示为差异显著(P < 0.05)。
Figure 5. Effects of SNP on the content of relative chlorophyll of Phoebe zhennan seedlings leaves under Pb2+ stress
图5. 各浓度SNP对Pb2+胁迫下桢楠叶片叶绿素含量的影响
N2处理的WUE在CK2的基础上有小幅度的增加,分别约为5.85%和10.93%,但是都不显著。N3处理的WUE显著低于CK2,可能的原因是N3处理的SNP浓度过高,导致产生过多的NO毒害叶片所产生的。结果表明:Pb2+胁迫能显著降低桢楠叶片的Pn,能小幅降低桢楠叶片的Gs、Tr、WUE和Ls,小幅增加桢楠叶片的Ci;0.1 mmol/L的SNP处理能够显著提高受Pb2+胁迫后桢楠叶片的Pn,0.5 mmol/L的SNP溶液处理能够使受Pb2+胁迫后桢楠叶片的Gs、Ci和Tr得到显著提高,桢楠叶片的Ls得到显著降低;但是对桢楠叶片WUE的提高效果不显著。
3.7. Pb2+胁迫下桢楠叶片的光合生理指标的相关性分析
在植物的正常生长离不开正常的光合作用,而光合效率的提高又在很大程度上受到植物叶片气体交换环境制约,表2统计了与植物光合相关的6个数据的相关性分析。表明:在浓度为900 mg/L的Pb (NO3)2溶液处理后,桢楠叶片的Pn与Gs、Tr和Ls为极显著正相关(r = 0.383, r = 0.538, r = 0.003; P < 0.01),其中与蒸腾速率相关度最高(r = 0.538);与WUE为显著相关(r = 0.302; 0.01 < P < 0.05);与Ci为极显著负相关(r = −0.074; P < 0.01)。桢楠叶片的Gs与Ci和Tr为极显著正相关(r = 0.889, r = 0.980; P < 0.01);与WUE为极显著负相关(r = −0.682; P < 0.01)。桢楠叶片的Ci与Tr为极显著正相关(r = 0.768; P < 0.01);与WUE和Ls为极显著负相关(r = −0.868, r = −0.996; P < 0.01)。桢楠叶片的Tr与WUE和Ls为极显著负相关(r = −0.595, r = −0.815; P < 0.01)。桢楠叶片的WUE和Ls为极显著正相关(r = 0.826; P < 0.01)。
3.8. SNP对桢楠叶片的Pb2+胁迫抗性影响的综合评价
如表3所示,不同浓度的SNP溶液处理受Pb2+胁迫的桢楠叶片的各项生理指标和光合指标的综合评

Table 1. Effects of SNP on the photosynthetic parameter of Phoebe zhennan seedlings leaves under Pb2+ stress
表1. SNP对Pb2+胁迫下桢楠叶片的光合参数的影响
注:表中不同小写字母表示为差异显著(P < 0.05)。

Table 2. Correlation analysis of photosynthetic characteristics under Pb2+ stress in Phoebe zhennan seedlings
表2. Pb2+胁迫桢楠叶片光合生理指标的相关性分析
**和*分别表示相关显著性水平达到0.01和0.05。

Table 3. Influence evaluation of SNP on physiological index of Phoebe zhennan under Pb2+ stress
表3. SNP对Pb2+胁迫下桢楠叶片生理指标影响的综合评价
价可以知道,在施用900 mg/L的Pb (NO3)2溶液后,桢楠的各项生理指标的综合评价值为0.148明显低于CK1的0.492,900 mg/L的Pb (NO3)2使得其叶绿素和可溶性蛋白质含量,POD和SOD活性以及Pn、Gs、Tr、WUE和Ls也发生了下降,MDA含量和Ci显著的提高,表明胁迫对桢楠叶片功能和结构的正常产生了明显的伤害。在喷施SNP溶液后,N1、N2、N3、N4的桢楠叶片的各项生理指标综合评价分别为0.552、0.810、0.756和0.656,均得到了提高,其中以N2最高,表明:施用0.25 mmol/L的SNP溶液是增加桢楠叶片抗Pb2+胁迫能力为最佳选择。
4. 讨论
Pb2+胁迫是现在已被发现的对植物伤害最大的重金属离子胁迫之一,通常具备非常强的可累积性和不可逆性等特性,极难得到根除。有研究人员发现Pb2+胁迫会导致植物幼苗叶片活性氧的大量聚集,这些活性氧对植物细胞器功能的正常发挥产生强烈阻碍,最终会严重制约植物正常的新陈代谢活动 [13] 。在本研究中,施用900 mg/L的Pb (NO3)2后,桢楠叶片的叶绿素和可溶性蛋白质含量,POD和SOD活性发生了减少;MDA含量得到了显著的提高,表示Pb2+对桢楠叶片组织产生了严重的毒害或破坏。这与王芳等 [14] 和张红 [15] 的研究结果类似。
在植物体整个的生长发育过程中,组织内部会因各种原因生成活性氧物质(如 和H2O2等),这些活性氧物质必须得到清除,否则会严重阻碍植物进行正常的新陈代谢活动,造成组织和结构的破坏而导致植物生长不良甚至死亡。植物抗氧化系统是植物体内为专门用来清除这些有害物质而进化出的一个自我保护系统,植物体内的抗氧化酶(POD、CAT、SOD等)是这一保护系统中的关键,它们广泛的存在于植物各种组织器官之中 [16] [17] ,是植物能够在各种逆境胁迫下依然存活的关键倚仗 [18] 。SOD能将
和H2O2等),这些活性氧物质必须得到清除,否则会严重阻碍植物进行正常的新陈代谢活动,造成组织和结构的破坏而导致植物生长不良甚至死亡。植物抗氧化系统是植物体内为专门用来清除这些有害物质而进化出的一个自我保护系统,植物体内的抗氧化酶(POD、CAT、SOD等)是这一保护系统中的关键,它们广泛的存在于植物各种组织器官之中 [16] [17] ,是植物能够在各种逆境胁迫下依然存活的关键倚仗 [18] 。SOD能将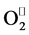 歧化为H2O2,而H2O2被POD转化成无害的O2和H2O [19] 。在本试验中,施用SNP后POD和SOD活性得到了显著的提高,显著的提高了桢楠叶片对Pb2+胁迫的耐受能力。这与这与王芳等 [14] 的研究结果类似。
歧化为H2O2,而H2O2被POD转化成无害的O2和H2O [19] 。在本试验中,施用SNP后POD和SOD活性得到了显著的提高,显著的提高了桢楠叶片对Pb2+胁迫的耐受能力。这与这与王芳等 [14] 的研究结果类似。
游离于植物组织和细胞中的可溶性蛋白,大多数是由与植物各项生命活动密切相关的酶类组成,其含量的多少能够代表植物组织整体的代谢活跃程度 [20] ,前人有报道过,可溶性蛋白含量的上升与植物抗性的强弱呈正相关 [21] 。在本试验中,施用SNP溶液能够使在Pb2+胁迫下的桢楠叶片组织内的可溶性蛋白含量发生了显著的增加。可以得出SNP溶液可以缓解Pb2+胁迫下的可溶性蛋白含量的下降,从而对桢楠叶片的抗性有显著提高的作用。叶绿素在绿色植物利用光能合成有机物的过程中扮演至关重要的地位,它是负责光能的吸收、传递和转化的色素之一 [21] 。有研究表明Pb2+胁迫之所以会造成叶绿素含量的下降,可能是因为Pb2+有促进叶绿素酶活性的作用,加速叶绿素的分解而引发的 [19] 。在本试验中,喷施SNP溶液后使Pb2+胁迫下的桢楠叶片的叶绿素含量显著的到了提高。MDA与植物细胞膜脂的过氧化反应有关,其在植物组织细胞内含量的多少能够间接表示出植物组织在受到胁迫时的损伤水平 [22] 。本试验表明,添加SNP能显著缓解MDA含量的增加,表示SNP能使桢楠叶片组织的膜结构免于或减少受到胁迫的伤害。
植物利用光能的效率的高低,无论对其正常的生长发育还是对其抗逆性的增强都存在着至关重要的意义,也是用来评价植物新陈代谢速度和抗性高低的关键标准之一 [23] 。在植物处于逆境时,主要有两个原因会降低叶片细胞的光合速率:一是由于气孔导度受到影响而产生的气孔限制因素;另外是由于叶片能够利用光能的细胞的光合活性下降而产生的非气孔限制因素。Ci值的高低通常是评判植物叶片光合速率降低原因的依据,若Pn降低的同时Ci值也随之发生降低,植物叶片光合速率降低的原因为气孔限制;反之,若Pn下降的同时Ci值又发生了增加,则说明抑制植物光合是由于非气孔限制而引发的 [24] 。在本试验处理中,Pn值在受到Pb2+胁迫发生了显著降低,Pb2+胁迫对叶绿素的破坏作用是Pn下降的首要因素;同时,Pb2+胁迫还增加了气体交换的阻力,Gs发生了降低,而同时Ci发生了升高。从而可以判断本试验中非气孔因素导致了Pb2+胁迫下桢楠叶片光合作用下降。在Pb2+胁迫下喷施不同浓度的SNP溶液,桢楠叶片光合作用出现显著性的提高,且随SNP浓度的提高呈下降趋势,同时桢楠叶片Gs、Tr、WUE和Ci发生了提高,桢楠叶片的Ls发生了显著的下降,这与王淼等 [25] 所得到的结论相类似。
5. 结论
综上所述:施用900 mg/L的Pb (NO3)2后,桢楠叶片的生理指标和光合指标都发生了显著的下降,施用SNP溶液能显著而有效的缓解这种降低,其中0.25 mmol/L的SNP溶液处理增强桢楠叶片抗Pb2+胁迫能力的效果最佳。
基金项目
湖北省科技支撑计划(2013BBB24)。