1. 引言
目前,治疗心血管疾病的方法有冠脉搭桥手术、药物治疗术和介入治疗。其中,介入治疗由于创伤小,成为治疗心血管疾病的主要方法 [1] 。血管支架虽然解决了许多临床上的问题,但仍存在着支架材料生物相容性不足和引起血管损伤,从而造成再狭窄和晚期血栓等问题 [2] 。支架表面构建多功能仿生层是实现内皮化并最终解决上述问题的根本途径之一 [3] [4] 。
近年来,材料表面细胞外基质等微环境因素模拟被认为是加速表面内皮化的有效方法。水凝胶在结构上与细胞外基质相似,有利于微环境构建 [5] 。此外,水凝胶可以设计成随时间降解的生物材料,有利于控制血管内膜形成过程 [6] 。许多天然高分子材料被用来制成水凝胶,其中包括壳聚糖 [7] 、海藻酸钠盐 [8] 、胶原、透明质酸 [9] [10] 等。透明质酸是一种线性多糖,由(1-β-4)D-葡萄糖醛酸(1-β-3)N-乙酰基-D氨基葡萄糖的双糖单位重复连接组成 [11] [12] 。另外,透明质酸是细胞外基质的重要组成部分,其结构和生物学性质决定其具有调节细胞信号、组织修复和形态重建等功能 [13] [14] 。透明质酸由于具有良好的生物相容性、低免疫性、抗炎症反应等特性,受到许多研究者的青睐 [15] 。多巴胺是一种具有良好粘附性能的生物材料 [16] 。将多巴胺修饰过的透明质酸制成水凝胶,发现这种水凝胶具有好的粘附性能和细胞相容性 [17] 。
但是关于不同多巴胺浓度制成的透明质酸水凝胶对内皮细胞的研究较少,本文研究了不同多巴胺浓度制成的透明质酸水凝胶的细胞相容性的差异。
2. 实验方法
2.1. 主要试剂与仪器
透明质酸(hyaluronic acid, 500 KDa),多巴胺(Dopamine, Sigma),氢氧化纳(NaoH, 0.1 mol/ml),盐酸(HCl, 0.1 mol/ml),高碘酸钠(NaIO4),罗丹明123,DMEM-F12培养基,胎牛血清,0.25%胰酶,0.9%氯化钠注射液,细胞增殖与活性检测试剂盒(CCK-8),内皮细胞(内皮细胞株Eahy926),扫描电镜(SEM,Philips Quanta 200),荧光显微镜(OLYMPUS-IX51,日本),超净工作台,CO2细胞培养箱,高压灭菌锅,电热恒温水浴锅,移液枪,酶标仪等。
2.2. 不同多巴胺反应浓度透明质酸水凝胶的制备
2.2.1. HA-DAP衍生物
首先将0.1 g透明质酸溶解到10 ml去离子水中(透明质酸浓度为10 mg/ml),用搅拌子搅拌两小时,使透明质酸完全溶解。加入一定量1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS)活化。用0.1 mol/ml的盐酸调节PH值到4.0~6.0之间,然后分别在1 ml的透明质酸溶液中加入3 mg、4 mg、5 mg、6 mg多巴胺(DAP),反应9~10小时后,使多巴胺上的氨基与透明质酸上的羧基发生反应,通过酰胺键将多巴胺接枝到透明质酸上,最后将所得的溶液放−4℃冰箱保存,得到HA-DAP衍生物。
2.2.2. 交联反应
将上述2.2.1得到的HA-DAP衍生物从冰箱中取出恢复到室温,分别用0.1 mol/ml的氢氧化钠溶液调节反应溶液的PH值到9.0。再向各样品中加入NaIO4,使多巴胺上的酚羟基氧化为醌基交联到透明质酸上,形成水凝胶。3 mg、4 mg、5 mg、6 mg多巴胺(DAP)对应的样品分别标记为HA-DAP3,HA-DAP4,HA-DAP5,HA-DAP6。
2.3. 理化性质表征
采用紫外可见光谱(UVVis)检测透明质酸与多巴胺反应后样品表面是否有多巴胺的特征吸收峰;用扫描电镜(SEM)观察HA-DAP水凝胶的断面形貌;通过溶胀平衡法测试水凝胶的溶胀率;通过荧光染色法和CCK-8细胞增殖活性检测手段对改性表面的内皮细胞生长行为进行评价。
2.4. 溶胀率测试
如2.2.2所述,所制备的每种样品的平行样分别设置为三个。将水凝胶完全浸泡在PBS中溶胀至平衡,用滤纸擦干凝胶表面的水,称量其质量记为mw。然后将溶胀的水凝胶放入真空干燥箱中至质量不再变化,称量其质量记为mi。根据下式(1)得到各样品的溶胀率。
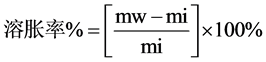 (1)
(1)
2.5. 内皮细胞粘附行为评价
将已经长满的内皮细胞,用生理盐水清洗3遍。用巴氏吸管将残余的NaCl吸尽,然后向培养瓶中加入3~4滴胰酶,使内皮细胞充分消化下来后,再向细胞培养瓶中加入3~5 ml已配好的细胞培养液。然后用巴士吸管吹打细胞悬液,使细胞均匀分布在细胞培养液中。加配置好的培养基,将细胞悬液稀释成4 × 104个/ml。然后,分别向样品中加入1 ml稀释后的细胞悬液,放入CO2孵箱,培养2小时后取出样品。用2.5%戊二醛固定12小时后进行荧光染色,最后于倒置荧光显微镜下观察粘附细胞的形态与数量。
2.6. 内皮细胞增殖能力评价
同2.5方法,分别在两组平行样中种植内皮细胞。在孵箱中培养1天、3天,分别取出样品,在无菌条件下加入CCK-8(VCCK-8:V培养基) = 1:9进行细胞活性检测,然后将细胞悬液弃之,用2.5%戊二醛固定12小时后进行荧光染色,最后于倒置荧光显微镜下观察细胞形态、数量以及增殖情况。
3. 实验结果
3.1. 不同多巴胺反应浓度透明质酸水凝胶制备
3.1.1. 紫外可见光谱(UVVis)检测结果
由紫外图谱(图1)可以看到,经多巴胺修饰的透明质酸样品在280 nm有一个特征吸收峰。那是酚羟基的特征吸收峰,与文献报道相符 [17] 。从而说明多巴胺是接枝到透明质酸上的。
3.1.2. 水凝胶的宏观形貌
图2为HA-DAP水凝胶的宏观形貌图。透明质酸溶液是透明的,加入高碘酸钠后,溶液瞬间变成红褐色,且溶液逐渐变粘稠,一小时后,形成黑褐的水凝胶,如图2所示,凝胶的透光性较弱。将凝胶倒立,不掉落,可知水凝胶的粘着性较好。
3.1.3. SEM结果
图3为不同多巴胺含量HA-DAP水凝胶冷冻干燥后,其断面扫描电镜结果。凝胶内部呈规则的空间网络结构。其中大的孔洞直径在120 μm左右,小的孔洞直径在30 μm左右。水凝胶的孔洞直径随多巴胺浓度增加而减小。这可能是因为高的多巴胺浓度使交联度增高,使水凝胶的孔径直径减小。
3.1.4. 溶胀率
从测试结果(表1)来看,其中多巴胺浓度较小时,溶胀率较高。而随着多巴胺浓度增加,溶胀率有下降的趋势。这主要是因为溶胀率与交联密度相关,当多巴胺浓度低时,水凝胶的交联密度小,这时形成的网络结构间距大,而能充分吸水。当多巴胺浓度大时,水凝胶交联密度大,形成的网络结构间距小,水凝胶吸收的水分较少。
3.2. 内皮细胞相容性评价
3.2.1. 内皮细胞粘附行为
图4为各样品表面内皮细胞粘附2小时荧光染色图。从图中可以看出,内皮细胞在各样品表面种植两个小时后,都有内皮细胞粘附,但内皮细胞数量有所不同。同时也可以看出,内皮细胞在水凝胶上培养两个小时后,几乎没有铺展开来。其中,多巴胺含量为3 mg/ml的HA-DAP水凝胶粘附的内皮细胞数量最多。
3.2.2. 内皮细胞增殖行为评价
图5为内皮细胞静态培养1天、3天后的荧光染色结果图,从图中可以看出,内皮细胞静态培养1天时,细胞在水凝胶表面铺展不明显,各样品表面细胞的数量差距不明显。内皮细胞静态培养3天后,细胞在各样品表面均出现不同程度铺展,其中含低浓度多巴胺的透明质酸水凝胶更有利于内皮细胞的铺展,并且低浓度多巴胺含量的透明质酸水凝胶更有利于内皮细胞增殖。这可能是高浓度多巴胺对细胞有一定的毒性 [18] 。
从内皮细胞CCK-8检测结果(图6)可以看出,内皮细胞静态培养1天后,各凝胶表面细胞活性差异

Figure 1. UV spectrum results of HA-DAP
图1. HA-DAP紫外图谱检测结果

 (a)(b)
(a)(b)
Figure 2. (a) Hyaluronic acid solution, (b) The macroscopic morphology of HA-DAP hydrogel
图2. (a) 透明质酸溶液,(b) HA-DAP水凝胶的宏观形貌图

Figure 3. Scanning Electron Microscopy of HA-DAP Hydrogel
图3. 不同多巴胺含量HA-DAP水凝胶断面扫描电镜图

Figure 4. Immunofluorescence staining of the endothelial cells adhered for 2 hours
图4. 各样品表面内皮细胞粘附2小时荧光染色图

Figure 5. Immunofluorescence staining of the endothelial cells after 1, 3 days of culture
图5. 内皮细胞静态培养1天、3天后的荧光染色结果图

Figure 6. CCK-8 results of endothelial cells after 1, 3 days of culture
图6. 内皮细胞静态培养1天、3天后的CCK-8结果图

Table 1. The swelling rate of HA-DAP hydrogels
表1. 不同多巴胺浓度HA-DAP水凝胶的溶胀率
不大。而内皮细胞静态培养3天后,各凝胶表面细胞活性有明显差别。其中样品HA-DAP3更有利于内皮细胞增殖,这与荧光染色结果相一致。多巴胺反应浓度低的透明质酸水凝胶细胞相容性优于其他样品。
4. 讨论
透明质酸是一种分布在多种组织细胞外基质的蛋白多糖,能够与干细胞表面受体相互作用,并能促进干细胞的增殖、迁移和分化 [19] 。血管新生是再生医学的重要条件之一,而透明质酸贯穿血管新生的整个过程。将多巴胺修饰过的透明质酸制成水凝胶,这种水凝胶具有好的粘附性能和细胞相容性。本研究通过加入不同浓度多巴胺制成的HA-DAP水凝胶,凝胶所具有的性能(溶胀率和孔洞直径)和细胞相容性有差别。
随着反应多巴胺浓度的减小,透明质酸水凝胶孔洞直径呈增大的趋势(图3),溶胀度也增加(表1)。这可能是多巴胺浓度低时交联度也较小,水凝胶的孔径直径较大,能够充分吸水。从内皮细胞粘附(图4)和内皮细胞静态培养1天、3天结果(图5和图6)来看,反应浓度为3 mg/ml的HA-DAP水凝胶细胞相容性更好。这可能是高浓度多巴胺具有一定的细胞毒性,因此HA-DAP6水凝胶细胞相容性(数量、形态和活性)较差。
5. 结论
1) 成功制备出不同多巴胺反应浓度的HA-DAP水凝胶。
2) 随着多巴胺浓度的增加,透明质酸水凝胶孔洞直径呈减小趋势。
3) 多巴胺浓度为3 mg/ml时,透明质酸水凝胶表现出良好的内皮细胞相容性(数量、形态和活性)。
基金项目
国家自然科学基金项目(31470921)。