1. 引言
兰州百合(Lilium davidii var. unicolor)为百合科百合属川百合的变种,是一种多年生鳞茎类草本植物。分析研究表明,兰州百合不但含有丰富的糖类、蛋白质和脂肪,而且含有秋水仙碱,随着人口老龄化的加剧以及人们对抗氧化衰老产品的日益需求,成了全社会所共同关心的热点。现代生物关于活性氧和体内自由基增多是促进衰老进程的主要原因的研究越来越引人注目,衰老的自由基学说被越来越多的实验证实。因此,寻找能够高效清除自由基的天然抗氧化物 [1] [2] 的研究越来越引起人们的重视。
植物内生菌(Endophyte) [3] [4] 是指那些在其生活史的一定阶段或全部阶段生活于健康植物的种组织和器官内部的一类微生物,而宿主植物一般不表现出外在的症状。所有植物中几乎都存在内生菌,可通过组织学方法或从严格表面消毒的植物组织中分离得到,一直被人们认为是生物活性物质的主要来源。
许多研究结果证明百合多糖是百合的主要功效成分,具有良好的抗氧化活性 [5] [6] ,但从兰州百合分离出内生菌及其抗氧化活性的研究尚未见报道。本研究利用组织分离法对兰州百合内生菌进行分离纯化,并进一步对12株兰州百合内生菌的发酵产物进行抗氧化活性测定,对兰州百合更好的开发利用提供参考,并为开发新的抗氧化活性生物资源提供基础和依据。
2. 材料与试剂
2.1. 材料
兰州百合
2.2. 试剂
试剂名称:公司名称
硫酸亚铁:天津市化学试剂厂
水杨酸:天津市化学试剂厂
95%乙醇:天津市化学试剂厂
30%过氧化氢溶液:天津市化学试剂厂
邻苯三酚:成都市科龙化工试剂厂
浓盐酸:新光化工试剂厂
试剂均为分析纯。
2.3. 培养基
1) 分离培养基:高氏I号培养基、营养琼脂培养基、高盐查氏培养基、PDA培养基。
2) 液体摇瓶培养基:营养肉汤培养基。
2.4. 仪器及设备
3. 方法
3.1. 百合内生菌的分离
将采集的百合样品用自来水冲洗去掉表面的泥沙,用无菌滤纸吸干百合表面的水分,对样品进行适当的修剪,使其鳞茎及根分开,然后在无菌超净台中进行处理。首先将百合组织鳞茎及根分别用浓度为0.1%的Tween-20浸泡5分钟,无菌水冲洗干净。75%的酒精浸泡5分钟,无菌水冲洗3次将表面的酒精冲洗干净。用2%的次氯酸钠消毒5分钟,无菌水冲洗3次,但要留下最后一次冲洗百合鳞茎及根的无菌水,装于无菌小烧杯中,待用(作为对照)。再将百合进行研磨,在研钵中加入一定量的无菌蒸馏水,静置用微量移液器吸取200 μl,用涂布棒将菌液均匀的涂布在平板上,用封口膜封住放入37℃恒温培养箱中培养。
3.2. 内生菌的分离纯化
挑取平板上长出的菌落进行划线分离,直至在平板上长出单菌落。
3.3. 内生菌的保藏
斜面低温保藏法 [7] :将分离所得菌种在适宜的固体斜面培养基上,待菌充分生长后,塞子部分用牛皮纸包好,移至4℃冰箱中保藏。
3.4. 兰州百合内生菌发酵产物的抗氧化活性测定
3.4.1. 试样的准备
在150 ml的锥形瓶中加入50 ml营养肉汤培养基,灭菌后,将已培养好的内生菌接种于营养肉汤培养基中。在37℃,180 r/min条件下,摇床振荡培养3 d。
3.4.2. 清除羟自由基(·OH)活性的测定
采用Fenton反应 [8] - [13] 其原理是Fe2+催化H2O2产生羟自由基(·OH),加入水杨酸捕捉·OH产生有色物质在510 nm波长处有吸收峰,因此测吸光度A510值表示样品清除羟自由基(·OH)能力大小A值越高,说明样品清除羟自由基(·OH)能力越弱。
在10 ml离心管中依次加入6 mmol/L硫酸亚铁溶液1 ml,6 mmol/L水杨酸—乙醇溶液1 ml后,把不同菌株的发酵提取液1 ml分别加入试管中,然后加入0.1%的过氧化氢溶液1 ml,总体积5 ml,以双蒸水补足体积,摇匀后在37℃水中温浴30min,7000 r/min离心3 min,在510 nm处测定吸光度值Ai,以相应溶剂代替样本作为空白对照,吸光度为Amax,相应样品溶液的吸光度A0,3次重复取平均值。
自由基清除率按下式计算:·OH清除率: ;
;
公式中引入A0是为了消除供试品本身颜色对测定的干扰,清除率越大,抗氧化活性越高。
3.4.3. 对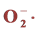 自由基清除能力的测定
自由基清除能力的测定
超氧阴离子清除作用的测定采用邻苯三酚自氧化法,参照迟晓星报道的方法并略有改动 [14] 。在10 ml离心管中依次加入,4.5 ml PH = 8的0.05 mol/L磷酸盐缓冲液放入25℃水浴中加热20 min,分别加入1 ml不同菌株的发酵提取液和0.4 ml 25 mmol/l邻苯三酚溶液,混匀后于25℃水浴中反应5 min,加入80 mmol/L HCL 1 ml终止反应,并摇匀,反应3 min,7000 r/min离心3 min,在波长420 nm处测吸光度Ai,以相应溶剂代替样品作为空白对照,测吸光度为Amax,相应样品溶液的吸光度A0,3次重复取平均值。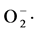 清除率:
清除率: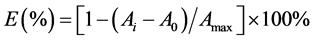 。
。
本实验数据分析是以菌株对羟基自由基(·OH)和超氧阴离子(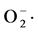 )清除率的大小来分析的,具体试验结果如下:
)清除率的大小来分析的,具体试验结果如下:
4. 结果
4.1. 兰州百合内生菌分离结果
兰州百合表面消毒的最后一次浸泡的无菌水涂布在营养琼脂平板上,平板上未长菌,说明兰州百合表面的微生物已消毒干净,平板上长出的菌均为兰州百合的内生菌。
从兰州百合鳞茎及根分离出内生菌共26株,其中百合鳞茎13株内生菌、从百合根部分离出13株内生菌。
4.2. 13株兰州百合内生菌对·OH的清除作用
随机选取兰州百合内生菌13株,测定其对·OH的清除作用,结果见图1。
由图1可知,13株菌对·OH自由基都有一定的清除作用,其中AJ-2菌株对·OH自由基的清除率最高,可达85%以上。其他多数菌株大部分也都高达60%以上,说明百合的内生菌对·OH自由基有一定的清除作用。
4.3. 13株菌兰州百合内生菌对 的清除作用
的清除作用
随机选取兰州百合内生菌13株,测定其对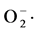 的清除作用,结果见图2。
的清除作用,结果见图2。

Figure 1. The scavenging rate of ·OH radicals in 13 strains. In the figure: A—Actinomycetes culture medium; C—Coates medium; F—Nutrient AGAR medium; E—PDA medium; G—Lily root; Y—Lily bulbs leaf; J—Lily bulbs stems; Numbers represent endophytic fungi from lily, lowercase letters represent endophytes isolated strains
图1. 13株菌对·OH自由基的清除率。图中:A—高氏培养基;C—高盐察氏培养基;F—营养琼脂培养基;E—PDA培养基;G—百合根;Y—百合鳞茎叶;J—百合鳞茎茎;数字代表从百合中分离出的第几株内生菌,小写字母代表亚株

Figure 2. The scavenging rate of 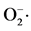 radicals in 13 strains
radicals in 13 strains
图2. 13株菌对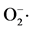 自由基的清除率
自由基的清除率
由图2可知,13株菌对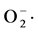 自由基都有一定的清除作用,其中AJ-2菌株对
自由基都有一定的清除作用,其中AJ-2菌株对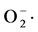 自由基的清除率最高,可高达90%以上,而且其对·OH自由基的清除率也高达85%以上。从图中可以看出百合大部分内生菌对自由基的清除均有一定的作用。
自由基的清除率最高,可高达90%以上,而且其对·OH自由基的清除率也高达85%以上。从图中可以看出百合大部分内生菌对自由基的清除均有一定的作用。
5. 讨论
5.1. 自由基的清除
目前关于活性氧的研究越来越引起人们的关注,国内外学者发现有机体的多种疾病都直接或间接的与自由基对机体的氧化损伤有关,因此寻找高效天然抗氧化剂显得十分重要 [15] [16] 。关于内生菌的抗氧化活性已有报道,如赵云涛等 [17] 在红树林内生真菌的抗氧化作用研究中,利用Fenton反应、邻苯三酚自养化法测定浓度为100 mg/ml的红树林内生真菌发酵产物对羟自由基和超氧阴离子的清除作用,结果表明测定的18株内生真菌中,具有清除羟自由基的菌株有9株,抑制率最高达85.49%;具有清除超氧阴离子自由基的菌株有10株,抑制率最高达68.85%能够同时对羟自由基和超氧阴离子自由基都具有清除能力的有5株。候奎等 [18] 在葛的根、茎、果实中分离出128株内生真菌,并采用DPPH自由基酶标仪法对其清除自由基活性进行检测,结果表明分离出的葛内生真菌普遍具有清除自由基的活性,且分离部位不同产地不同所具有的活性也不同。同一部位分离出的不同菌株之间活性亦不同,其中菌株在浓度215 mg/ml的清除自由基活性达到92.3%。本研究随机挑选的13株菌均有一定清除自由基的能力,大部分具有良好的抗氧化活性。
5.2. 抗氧化活性
自从1993年美国学者首次从短叶红豆杉的韧皮部分中分离到一株产紫杉醇的内生真菌以来,关于植物内生菌的研究就一直为学者所关注,但关于内生菌的大部分研究主要是集中在其抗肿瘤和抗菌方面,相对于抗氧化活性的研究相对较少。本研究以甘肃本地特产兰州百合为实验材料,采用组织分离法得到26株内生菌。随机选取的13株菌均有一定的清除自由基的能力,具有潜在的开发利用价值,尤其是AJ-2菌株表现出较强的清除自由基的能力,加之较易培养,因此被定为本实验的最优良菌株,可作为进一步研究的对象。
5.3. 内生菌分离
在内生菌的分离过程中,表面消毒是内生菌分离的关键步骤,既要彻底杀死供试材料表面的菌,又不伤及供试材料内部的内生菌,过轻或过重都会影响植物内生菌的分离。在植物内生菌分离过程中用PDA培养基、高氏培养基、高盐察氏培养基、营养琼脂培养基可以最大限度分离出尽可能多的内生菌。在进行测定菌株清除羟基自由基和超氧阴离子自由基实验时,两组实验是分开进行的,由于菌株是在固体斜面培养基上保存的,到后期菌株代谢活力减慢,因此不能很好的在液体培养基内生长,所以测定百合内生菌抗氧化活性实验选取的是生长状态较好的13株进行的。
6. 结论
从兰州百合分离出26株内生菌,其中百合鳞茎叶分离出5株、百合鳞茎茎分离出8株、从百合根部分离出13株菌。随机挑选的13株百合内生菌菌均有一定清除自由基的能力,都具有良好的抗氧化活性,其中AJ-2菌株对·OH自由基的清除率最高,可达85%以上;其他多数菌株对·OH自由基的清除率都高达60%以上;AJ-2菌株对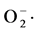 自由基的清除率达93.88%,而且其对·OH自由基的清除率也高达85.39%,可作为进一步研究对象。
自由基的清除率达93.88%,而且其对·OH自由基的清除率也高达85.39%,可作为进一步研究对象。
基金项目
西北民族大学国家级大学生创新创业训练计划资助项目(项目编号:201610742072)。
NOTES
*通讯作者。