1. 引言
氯膦酸二钠(Clodronate)是一种双膦酸盐,常用于恶性肿瘤患者因骨溶解引起的骨质疏松和高钙血症 [1] [2] 。游离的氯膦酸二钠不易穿过细胞膜而被细胞吸收,降低了药物利用效率且增加了肝脏和肾脏毒性 [3] 。脂质体(Liposome)作为一种常用的药物载体具有很多常规药物所不具备的优点,比如可通过靶向给药减少药物对其他脏器的毒性、具有缓释特点可提高药物利用效率、减少机体对药物的降解使药物更稳定等特点 [4] 。
先天免疫细胞如巨噬细胞、肥大细胞、树突状细胞及辅助性T细胞等在各种疾病中扮演者极为重要的作用,其中巨噬细胞和许多疾病的发生有直接或间接的关系,如自身免疫性疾病 [5] [6] 、肥胖 [7] 、动脉粥样硬化 [8] 、癌症 [9] 等。利用氯膦酸二钠的细胞致死活性清除巨噬细胞可显著地改善结肠炎和肾炎 [6] [10] 。由于脂质体易于被巨噬细胞吞噬,所以用脂质体包封氯膦酸二钠是一种很有效的药物载体,脂质体的磷脂双分子层被巨噬细胞溶酶体磷脂酶降解后可释放氯膦酸二钠。巨噬细胞内的氯膦酸二钠不易被细胞排出,可诱导巨噬细胞死亡从而清除巨噬细胞。
本研究用1, 2-二棕榈酰-sn-甘油-3-磷酸胆碱(DPPC)和胆固醇为脂质体主要成分,添加带负电荷的磷酸二鲸蜡酯使脂质体带负电从而增加巨噬细胞的吞噬率,同时可降低脂质体聚合,采用薄膜水化法制备氯磷酸二钠脂质体,用离体培养的小鼠巨噬细胞对该脂质体制剂诱导细胞凋亡的作用进行了探讨。
2. 材料与方法
2.1. 试剂
1,2-二棕榈酰-sn-甘油-3-磷酸胆碱(1,2-dipalmitoyl-sn-glycero-3-phosphocholine,简称DPPC);胆固醇(Chlesterol);磷酸二鲸蜡酯(dicetylphosphate,简称DCP);氯膦酸二钠(Clodronate)均购自Sigma公司。
2.2. 氯磷酸二钠脂质体制备
氯膦酸二钠脂质体的制备采用改进的薄膜水化法 [11] 。脂质体配方参考Calvagno等人的报道 [12] ,用正交设计法选择最佳配方,DPPC:胆固醇:DCP的摩尔比为6:4:1。准确称取脂类,加入5 mL三氯甲烷,搅拌至完全溶解后,转移至50 mL圆底烧瓶中,旋转蒸发使有机溶剂完全挥发,继续真空抽吸30分钟,圆底烧瓶底部形成均匀脂质薄膜,置通风橱过夜。于次日加入5 mL氯膦酸二钠溶液(10 mg/mL,用PBS配制,pH7.4),旋转振摇30~40分钟使圆底烧瓶壁上的脂质完全脱落,形成均匀的乳白色悬浊液。转移至带盖的试剂瓶中冰水浴条件下超声(200 w) 5分钟后4℃保存。
2.3. 氯膦酸二钠脂质体粒径测定
脂质体粒径的测定参考Vorauer-Uhl等报道的方法用流式细胞仪测定脂质体粒径分布 [13] 。测定粒径所用标准参考品粒径为200、500、1000、2000纳米的4种纳米颗粒(Thermo Fisher),用FACSCalibur流式细胞仪(BD Bioscience)分别测定各种颗粒的侧向散射度,以侧向散射高度值为横坐标、粒径(nm)为纵坐标制作标准曲线。脂质体用磷酸缓冲液稀释后用流式细胞仪测定粒径。
2.4. MTT法测定细胞致死活性
为确定氯膦酸二钠脂质体药物的有效性,我们用离体培养的RAW264.7小鼠巨噬细胞测定氯膦酸二钠脂质体制剂的细胞致死活性。收集RAW264.7细胞,用台盼蓝染色后计数,于96孔板每孔接种1 × 104 细胞。所用培养基为DMEM培养基含l0%胎牛血清(FBS)、青霉素100单位/mL和链霉素100 μg/mL,于5%二氧化碳培养箱37℃培养过夜。游离氯膦酸二钠、空脂质体及氯膦酸二钠脂质体分别用DMEM完全培养基系列稀释,小心吸除RAW264.7细胞培养液,加入系列稀释的各处理液100 μL/孔,每个稀释度重复4孔。将细胞放回二氧化碳培养箱培养48小时后用MTT法测定细胞存活率 [14] 。每孔细胞中加入25 μLMTT试剂(5 mg/mL,用PBS配制,pH7.4),置37℃继续培养2小时。每孔加入100 μL提取液,置室温避光过夜。用微孔板分光光度计读取OD570nm。以未处理的细胞为100%存活率计算各稀释度的氯膦酸二钠及脂质体的细胞存活率。
2.5. 免疫印迹法检测活性半胱天冬酶-3(Cleaved Caspase-3)
接种RAW264.7细胞于6孔细胞培养板,每孔接种1 × 106细胞置5%二氧化碳培养箱37℃培养过夜,加入游离氯膦酸二钠、氯膦酸二钠脂质体及空脂质体(25 µM和50 µM两个剂量),置5%二氧化碳培养箱37℃培养48小时。用200微升细胞裂解液裂解细胞后离心收集上清液,取20微克总蛋白用12%SDS-PAGE分离后转至PVDF膜(Bio-Rad)。PVDF膜用5%牛血清白蛋白封闭后加1:1000稀释的活性caspase-3兔抗(Cell Signaling Technology)4℃孵育过夜,用1 × TBST洗膜三次,加入1:5000稀释的辣根过氧化物酶(HRP)标记的羊抗兔IgG抗体(Invitrogen),于室温振摇孵育1小时,洗膜三次后用化学发光法检测caspase-3。以β-肌动蛋白为内参,小鼠抗β-肌动蛋白单克隆抗体(Santa Cruz Biotechnology)1:2000稀释后于室温孵育1小时,二抗为1:5000稀释的HRP标记的羊抗鼠IgG (Invitrogen)。
2.6. 流式细胞术测定细胞凋亡
将RAW264.7细胞接种于25 cm2细胞培养瓶,每瓶接种1 × 106细胞于5mL DMEM完全培养基,分别向细胞中加入氯膦酸二钠脂质体,以空脂质体(未包封氯膦酸二钠)作对照,于5%二氧化碳培养箱37℃振荡培养(25转/分钟)以避免细胞贴壁。分别于0、5、24、48小时离心收集细胞,用细胞凋亡测定试剂盒(Annexin V Apoptosis Detection Kit FITC,Invitrogen)染色后,用FACSCalibur (BD Bioscience)流式细胞仪测定凋亡细胞数。
2.7. 氯膦酸二钠脂质体的毒性试验
选择6~8周龄的野生型C57BL/6J小鼠随机分为两组,每组10只小鼠。从第0天起每组小鼠经肛门分别用100微升和200微升氯膦酸二钠脂质体灌肠,每周灌肠一次,共计10次。注意观察动物健康状况的变化、每周称重一次、记录动物死亡时间。最后一次灌肠结束一周后(第70天)尚未死亡的动物麻醉后行安乐死。
2.8. 统计学分析
统计学分析及动物生存曲线用GraphPad Prism 5软件进行处理,实验数据以平均值 ± 标准差表示,实验组与对照组的比较用t检验,P ˂ 0.05判断为显著性差异。
3. 结果
3.1. 氯膦酸二钠脂质体形态学和理化特性
本试验制备的脂质体原液呈乳白色混悬液,脂质体经超声处理后4℃冰箱保存。该混悬液用PBS稀释后于倒置显微镜观察照相,如图1所示,脂质体呈球形或近球形、粒径均一、聚集度低。以纳米颗粒标准品的直径(nm)为横坐标、侧向散射值(高度)为纵坐标绘制标准曲线,侧向散射高度和纳米颗粒的直径之间呈指数相关关系(y = 10.743e0.9433x,R2 = 0.9707),用以上公式求脂质体粒径表明90%的脂质体粒径在200~1000纳米之间,中间值为472 nm。

Figure 1. Microscopic morphology of clodronate liposomal enema
图1. 氯膦酸二钠脂质体灌肠剂的光学显微镜形态图
3.2. 氯膦酸二钠脂质体对离体培养的小鼠巨噬细胞的致死作用
用不同浓度的氯膦酸二钠脂质体、空脂质体以及游离的氯膦酸二钠处理RAW246.7小鼠巨噬细胞48小时,MTT法测定细胞存活率的结果表明游离氯膦酸二钠和空脂质体对RAW264.7巨噬细胞的致死毒性无显著性差异(P = 0.073),低浓度游离氯膦酸二钠和空脂质体没有明显的细胞毒性,100 μM的游离氯膦酸二钠和空脂质体48小时后呈轻度细胞毒性,细胞存活率分别为86.7% ± 2.9%和80.0% ± 4.0%。如图2所示,氯膦酸二钠脂质体对RAW264.7细胞具有明显的致死活性,用12.5 μM的氯膦酸二钠脂质体处理48小时后细胞存活率为63.2% ± 12.7%;当氯膦酸二钠脂质体浓度增加至100 μM时其细胞存活率为47.7% ± 5.8%。
3.3. 氯膦酸二钠脂质体激活半胱天冬酶-3
MTT试验结果表明氯磷酸二钠脂质体具有显著的细胞致死活性,为进一步确定氯膦酸二钠脂质体是否诱导细胞凋亡(Apoptosis),我们首先用25 μM和50 μM的氯膦酸二钠脂质体处理小鼠巨噬细胞48小时,用相同浓度的游离氯膦酸二钠和空脂质体作对照,免疫印迹法从氯膦酸二钠脂质体处理的细胞中检测到活性半胱天冬酶-3,其表达量随氯膦酸二钠脂质体浓度而增加;相反,未经处理的巨噬细胞及对照组均未能检测到活性半胱天冬酶-3的表达(图3)。
3.4. 氯膦酸二钠脂质体诱导巨噬细胞凋亡
为确证氯膦酸二钠脂质体诱导细胞凋亡,我们选用50μM的氯膦酸二钠脂质体和空脂质体处理RAW264.7巨噬细胞,于5、24、48小时用流式细胞术检测细胞凋亡的特异标志物Annexin V。未经处理的细胞(0小时)有极少部分死亡细胞,空脂质体处理巨噬细胞5~48小时均未见显著增加的凋亡细胞,总凋亡细胞占8.3% ± 0.8%~9.5% ± 2.7%。氯膦酸二钠脂质体处理5~48小时后均有显著增加的凋亡细胞,总凋亡细胞占比分别为16.4% ± 4.0%、28.2% ± 3.3%、45.7% ± 7.3%(图4)。以上实验结果表明巨噬细胞吞噬氯膦酸二钠脂质体可诱导巨噬细胞凋亡。
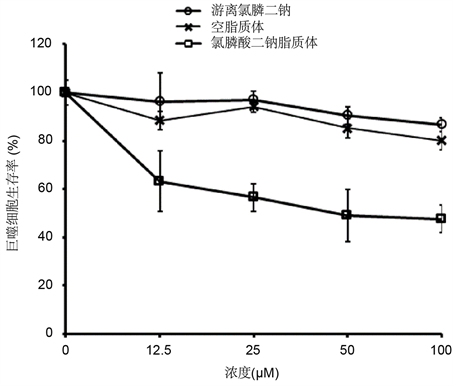
Figure 2. Cytotoxicity of clodronate liposomal enema in macrophages in vitro
图2. 氯膦酸二钠脂质体对离体培养的巨噬细胞的致死活性
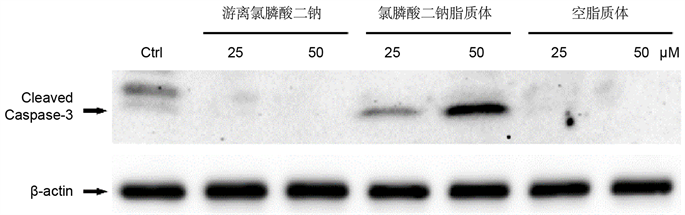
Figure 3. Western blots for cleaved caspase-3 show remarkably increased expression of cleaved caspase-3 in RAW264.7 macrophages
图3. 免疫印迹法表明氯膦酸二钠脂质体可诱导RAW264.7巨噬细胞中活性半胱天冬酶-3的表达
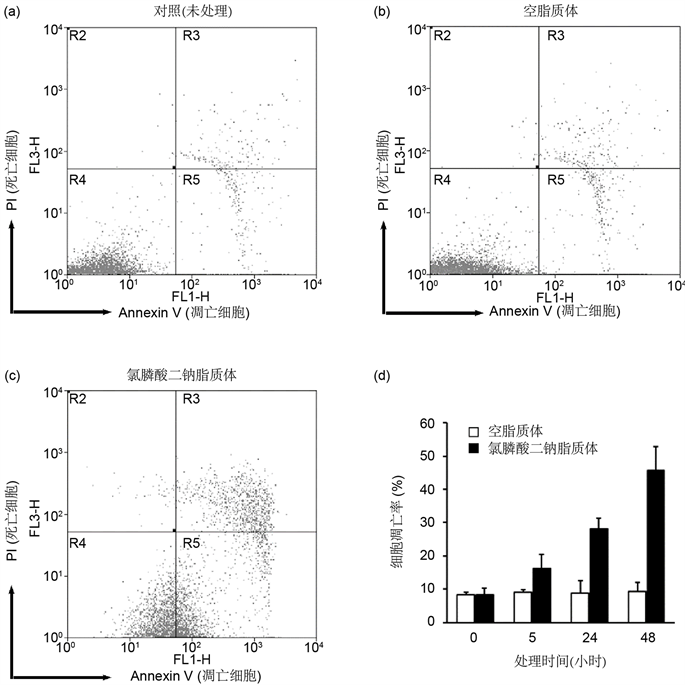
Figure 4. Fluorescence-activated cell sorting (FACS) analysis detects clodronate liposomal enema-induced apoptosis in macrophages.
图4. 流式细胞术检测氯膦酸二钠脂质体诱导的巨噬细胞凋亡
3.5. 氯膦酸二钠脂质体灌肠剂的毒性
用100微升和200微升两种不同剂量灌肠10次,如图5所示,用100微升氯膦酸二钠脂质体灌肠的小鼠全部存活至试验周期结束(70天);而200微升氯膦酸二钠脂质体灌肠组第7次灌肠后死亡一只,至10次灌肠试验结束时共有3只小鼠死亡,存活率为70%。
4. 讨论
本研究通过优化脂质体组分制得一种新型的氯膦酸二钠脂质体灌肠剂。脂质体制备方法很多,各有利弊,有些方法虽然可制备高质量的脂质体但需要特殊的设备且不适合产业化生产 [15] ,而另一些方法虽简单易行但制得的脂质体质量较差。我们通过对脂质体配方进行优化,采用薄膜水化法制备氯膦酸二钠脂质体。此法的特点是操作简单,有机溶剂消耗少,无需特殊设备。
脂质体的带电属性是影响细胞吞噬率的主要因素之一,不同的组织和细胞对不同带电性质的脂质体吞噬率不同,如肿瘤组织选择性地吞噬带阳性电荷的脂质体 [16] 。因为本项目中脂质体药物的靶细胞是巨噬细胞,巨噬细胞对带负电的粒子具有较高的吞噬率 [17] 。本研究研制的氯膦酸二钠脂质体通过改变磷脂种类,选用带有两性电荷的1, 2-二棕榈酰-sn-甘油-3-磷酸胆碱为主要成分,并通过加入少量带负电的磷酸二鲸蜡酯(摩尔比为1)使脂质体带负电性,以提高巨噬细胞对脂质体的吞噬率,同时有助于脂质体逃逸网状内皮系统的捕获 [18] 。
脂质体药物的粒径对巨噬细胞的吞噬率具有很大的影响。虽然有报道显示不同的巨噬细胞可吞噬颗粒的粒径相差很大,从0.5微米到10微米不等 [19] ,但外周血和腹膜巨噬细胞的最适吞噬的脂质体粒径一般在100~1000纳米 [20] [21] 。粒径超过1000纳米的脂质体经常会在肺、肝、脾等脏器发生沉积形成血栓从而产生不良后果。相反,如果脂质体粒径小于80纳米则很容易逃逸巨噬细胞的捕获而显著地降低吞噬率。我们所得脂质体灌肠剂90%的脂质体粒径分布在200~1000纳米之间,这种粒径的脂质体非常适合动物巨噬细胞的吞噬。同时由于添加了带负电的脂类成分,极大地提高了的巨噬细胞的吞噬率。
我们的实验结果表明该氯膦酸二钠脂质体药物对离体培养的小鼠巨噬细胞具有显著的细胞毒性。双膦酸盐可竞争破骨细胞中的ATP而抑制腺嘌呤核苷酸转位酶从而诱导细胞凋亡 [3] ,但氯膦酸二钠脂质体诱导细胞凋亡的机理在不同的细胞种类中有所不同。Selander等发现游离氯膦酸二钠诱导蛋白激酶C介导的牛破骨细胞凋亡,脂质体包封的氯膦酸二钠可诱导大鼠腹腔巨噬细胞和小鼠肝脏巨噬细胞的凋亡但未能诱导RAW264.7细胞凋亡 [22] ;另外,氯膦酸二钠脂质体处理RAW264.7细胞未见显著增加的Bcl-2,因此,Selander等认为RAW264.7细胞可能缺失了氯膦酸二钠诱导的细胞凋亡信号传导途径中的某些起
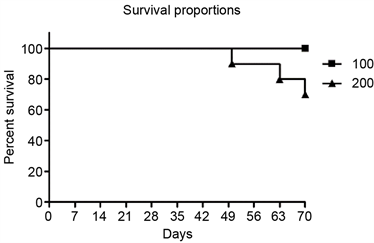
Figure 5. Lethality of clodronate liposomal enema in mice
图5. 氯膦酸二钠脂质体灌肠剂的小鼠致死剂量
始成分 [22] 。本研究结果表明氯膦酸二钠脂质体可诱导活性半胱天冬酶-3和Annexin V的表达,确证该脂质体制剂诱导RAW264.7细胞凋亡。
尽管用AnnexinV和PI双染色的流式细胞术检测早期凋亡(Early apoptotic)细胞非常有用,但对于晚期凋亡(Late apoptotic)细胞,由于细胞膜结构的改变,PI染色呈阳性,所以无法区分细胞凋亡和坏死(Necrosis)。本研究虽未用细胞坏死的标志物以区分细胞凋亡和坏死,但免疫印迹法检测48小时处理后细胞裂解液中活性半胱天冬酶-3的结果表明氯膦酸二钠脂质体引起的细胞死亡是细胞凋亡。另外,由于RAW264.7细胞是一种贴壁细胞且很难用胰酶/EDTA消化的方法收集细胞,通常只能用细胞刮刀收集细胞,细胞刮刀收集细胞时可损伤细胞膜而导致大量细胞呈PI染色阳性。因此,本研究尝试用振荡培养的方法使RAW264.7细胞呈悬浮状态而不贴壁。结果显示,虽然未经处理的细胞因振荡培养有少量的细胞呈Annexin V/PI染色阳性,但基本解决了流式细胞术测定RAW264.7细胞凋亡的难题。
综上所述,本研究研制的氯膦酸二钠脂质体灌肠剂因带负电荷、粒径适中,巨噬细胞吞噬率高。该氯膦酸二钠脂质体制剂可诱导离体培养的小鼠巨噬细胞表达活性半胱天冬酶,导致细胞凋亡而有效地杀伤巨噬细胞。今后的研究将用该新型脂质体灌肠剂清除活体动物肠道巨噬细胞以治疗动物结肠炎的效果进行评价,进一步验证本研究中离体试验的结果,这些研究结果无疑将为该新型脂质体灌肠剂用于人类结肠炎的辅助治疗和结直肠癌的预防提供充分的实验证据。
致谢
感谢兰州市人才创新创业项目、人社部及甘肃省人社厅对本研究的资助和支持。
基金项目
本项目受兰州市人才创新创业项目(2014-RC-81)和人社部2015年留学人员回国创业启动支持计划资助。