1. 引言
随着天然水体的污染日益严重,富营养化水体中蓝藻水华的暴发给环境带来了巨大的危害 [1] ,2007年5月29日太湖蓝藻水华的暴发,导致了无锡市200多万居民的一场饮水危机,给工业和生活带来巨大影响。蓝藻水华带来的直接危害之一就是微囊藻毒素的产生,威胁着人类和动物健康。微囊藻毒素(Microcystins, MCs)是一种具有多器官多系统毒性的物质,且具有很强的促肝癌作用 [2] [3] [4] [5] 。微囊藻毒素会随着藻细胞的衰老、死亡或破裂释放到水中,最后可通过各类水生生物间接进入人体内,从而对人类健康带来风险 [2] 。1996年,巴西100多名肾透析患者发生藻毒素急性中毒事故,7个月内至少50人死于藻毒素产生的急性效应,除此之外世界各地经常发生微囊藻毒素中毒事件 [6] ,淡水水体中的微囊藻毒素污染已成为全球性的公共卫生问题 [7] 。
藻毒素对水生态系统的危害以及对人体健康的威胁使得它成为国内外众多科学家们研究的热点,因此在开展微囊藻毒素相关领域的研究时,对微囊藻毒素纯品的需求量越来越大 [8] [9] ,但微囊藻毒素在藻细胞中含量少,藻类细胞内色素、蛋白等杂质多,提取过程繁琐、复杂 [10] ,而直接购买使用经济成本太高,种种因素为开展微囊藻毒素的研究带来了很大困难。迄今为止,已经发现近100余种微囊藻毒素异构体,其中以MC-LR、MC-RR、MC-YR最为普遍 [11] 。1982年Botes等 [12] 率先研究了MCs的提取方法,至今国内外已报道的提取方法主要包括反复冻融提取 [7] 、5%冰乙酸提取法 [13] 、超声波破碎提取[6] [14] 、搅拌提取 [15] 和沸水浴法 [16] 提取等,闫海等 [17] 将干藻粉用40%甲醇溶液萃取,并超声震荡1 h,从滇池水华蓝藻中提取出至少1260 μg /g的MC-RR和840 μg/g的MC-LR;陈东等 [15] 用60%甲醇将研磨90 min后的干藻粉微波加热得到300 μg/g的MC-LR。本实验以天然水体中打捞的微囊藻为原料,研究了冰乙酸萃取、研磨处理、煮沸处理以及反复冻融处理等微囊藻毒素的提取方法,从提取效率、设备要求、实验简易程度以及操作安全性等方面综合比较后,反复冻融法是实验室提取藻毒素的优选方法之一,为实验室提取天然水华微囊藻中的藻毒素提供参考,为进一步纯化获取微囊藻毒素标准品提供了基础。
2. 材料与方法
2.1. 实验仪器
TDZ5-WS型台式多管自动平衡离心机(长沙平凡仪器仪表有限公司),DY89-II型电动玻璃匀浆机(宁波新芝生物科技股份有限公司),TGL-205型台式高速冷冻离心机(长沙平凡仪器仪表有限公司),GC-2091型格力电磁炉,KQ-500E型超声波清洗器(昆山美美超声仪器有限公司),LC-20A型高效液相色谱仪(岛津企业管理(中国)有限公司)。
2.2. 实验材料与试剂
天然水体中的水华微囊藻藻浆于2015年8月采自湖南省某富营养化水体(112˚57'4''N, 28˚11'6''E),MC-RR、MC-YR及MC-LR的标准品(纯度 ≥ 95%)购自Alexis公司。
2.3. 实验方法
选取一批天然水体打捞的微囊藻,并通过过滤浓缩成微囊藻藻浆,共1100 mL,分别使用5%冰乙酸提取、研磨处理、煮沸处理、反复冻融法来提取微囊藻毒素,所有样品均设A、B两个平行组,同种提取方法的平行组实验条件均相同。
2.3.1. 提取方法
1) 冰乙酸萃取:取50 mL微囊藻藻浆置于离心管中,加5%的冰乙酸溶液,静置24 h使其充分反应;
2) 研磨处理:取50 mL微囊藻藻浆置于离心管中,使用电动玻璃匀浆机(速度均为1000 r/min)分别研磨5、10、15 min处理,保证每份样品都在实验预设时间内研磨充分、尽可能使藻毒素从破碎的藻细胞中释放出来;
3) 煮沸处理:将50 mL微囊藻藻浆使用电磁炉分别煮沸5、10、15 min处理,煮沸时不断搅拌防止粘锅,煮沸后待冷却至室温后置于50 mL离心管;
4) 反复冻融:取50 mL微囊藻藻浆在-20℃冰箱中冷冻4 h以上,再自然解冻,按此操作将所取样品分别反复冻融1、2、3、4次。
2.3.2. 除杂方法
藻毒素提取液中含大量藻胆蛋白等有机物,这些物质的存在对藻毒素的提取纯化有很大的干扰作用,应设法在过固相萃取柱之前去除,故将完成上述所有步骤之后的提取液低速离心(3800 r/min, 15 min),取上清液,调节pH = 3 (去除藻胆蛋白) [8] ,静置3小时以上,使其充分反应,产生蓝色絮状沉淀(煮沸处理处理后的样品本为土黄色,调节pH之后颜色变化不明显),再低速离心(3800 r/min, 15 min)去除沉淀;取上清液,调节pH = 8.5,去除杂蛋白,并静置3小时以上使其充分反应,产生黄色絮状沉淀,再低速离心(3800 r/min, 15 min)即可得到除去大部分蛋白及色素的藻毒素粗提液,此时将所有样品pH调至7 [8] ,静置1小时,取1 mL高速离心,吸取上清液100 μL置于自动进样瓶中,用HPLC法检测所有样品浓度。
2.3.3. HPLC条件
流动相:甲醇:超纯水:三氟乙酸 = 57:43:0.05;流速:0.8 mL/min;自动进样器进样:20 μL;检测波长:238 nm。
3. 结果与讨论
3.1. MCs色谱分析
采用外标法高效液相色谱分析:MCs标准品中,三种异构体色谱峰先后顺序为MC-RR、MC-YR、MC-LR,其保留时间约为7.961、13.964、22.054 min (图1),本研究提取的三种化合物与标准品的保留时间基本一致(图2),且均在238 nm具有最强的吸收峰,吸收图谱形状极为相似,因此可以确认从水样中提取的化合物就是MCs,并根据保留时间确定水样中的三种异构体为MC-RR、MC-YR、MC-LR。采用外标法定量,提取方法不同,所得藻毒素含量比例也不同。
3.2. 5%冰乙酸萃取处理
5%冰乙酸萃取法获得的三种藻毒素浓度(依次为MC-RR、MC-YR、MC-LR,下同)分别是0.73 ± 0.03、0.43 ± 0.04、0.85 ± 0.06 μg/mL。目前,不同浓度的甲醇溶液是从微囊藻细胞中提取藻毒素应用最为普遍的有机溶剂,其中50%~80%的甲醇溶液被认为是MC最有效的提取剂 [6] ,但闫海 [17] 等的研究表明40%的甲醇即可以最高效的提取出MC-RR和MC-LR,继续升高甲醇浓度反而使提取液中MC浓度下降。Nina [18] 等的研究表明,水、5%冰乙酸、70%甲醇和100%甲醇作为提取剂提取MC-RR的效率相同。唐红枫 [8] 等报道,5%冰乙酸溶液和连续抽提法可以从藻细胞中提取更多的MC-RR和MC-LR,40%甲醇提取液中MC的浓度比80%甲醇溶液和100%甲醇溶液的高,但40%甲醇从东湖水华微囊藻细胞中提取MC-RR和MC-LR的效率也远低于5%冰乙酸溶液和连续抽提法。本研究中,虽然5%冰乙酸萃取提取效率低于其他方法,但其提取操作简单,且根据唐红枫 [8] 等的研究报道,提取时间最好控制在120 min内,过长的提取时间可能影响MC-LR的稳定性,或加剧MC-LR的变异,这也可能是造成本实验提取效率偏低的原因之一。

Figure 1. HPLC profiles of standard MCs
图1. MC标准品HPLC图谱
3.3. 研磨处理
如图3所示,研磨5 min获得的三种藻毒素浓度分别为:1.05 ± 0.01、0.43 ± 0.04、1.03 ± 0.06 μg/mL,研磨10 min获得的三种藻毒素浓度分别为:1.07 ± 0.02、0.46 ± 0.09、1.17 ± 0.22 μg/mL,研磨15 min获得的三种藻毒素浓度分别为:1.14 ± 0.13、0.37 ± 0.02、1.13 ± 0.12 μg/mL。研磨处理的原理是靠电动玻璃匀浆机的转头转动使藻细胞破碎从而释放出胞内的藻毒素,理论上随研磨时间增加,细胞破碎更充分,藻毒素浓度会增高,本研究在此原理的基础上还探究了最佳研磨时间,根据实验结果,使用电动玻璃匀浆机研磨约10 min可获得最大量的藻毒素(图3),超过10 min后,MC-LR和MC-YR的含量有所降低。
3.4. 煮沸处理
煮沸法处理5 min获得的三种藻毒素浓度分别为:0.97 ± 0.03、0.76 ± 0.12、0.77 ± 0.03 μg/mL,煮沸10 min获得的三种藻毒素浓度为:0.74 ± 0.05、0.88 ± 0.12、0.63 ± 0.10 μg/mL,煮沸15 min获得三种藻毒素浓度分别为:0.84 ± 0.09、0.88 ± 0.08、0.66 ± 0.02 μg/mL。由于环状结构的微囊藻毒素性质稳定,加热处理不会破坏其结构,因此有人利用沸水浴、微波或超声等方法来提取过微囊藻毒素 [16] [19] ,但未报道过几种提取方法的效果比较。张维昊 [19] 等的实验比较了加热、超声与溶剂提取的效果,结果表明加热虽然可以缩短平衡时间,但对提取效率并无显著影响,而超声前后粗提液中藻毒素含量也没有明显差异。本实验结果表明,直接将藻毒素煮沸处理可以破碎细胞并释放出藻毒素,且最佳煮沸时间大约为5 min,超过5 min后所提取的藻毒素含量都趋于稳定(图4),但该方法存在一定的系统误差(比如粘锅),而且煮沸处理会使藻细胞内诸多蛋白变质,增加除杂的工作量,且操作过程伴有恶臭 [20] [21] ,可能给后续纯化带来污染与干扰。
3.5. 反复冻融处理
冻融1次获得的三种藻毒素浓度分别为:0.72 ± 0.12、0.79 ± 0.02、1.61 ± 0.02 μg/mL,反复冻融2次获得的三种藻毒素浓度分别为:0.80 ± 0.17、0.97 ± 0.03、1.78 ± 0.05 μg/mL,反复冻融3次获得的藻毒素浓度为:1.20 ± 0.15、0.93 ± 0.01、1.83 ± 0.17 μg/mL,反复冻融4次所获藻毒素浓度为:0.82 ± 0.30、0.96 ± 0.04、1.93 ± 0.06 μg/mL (图5)。本实验结果表明,冻融操作少于3次时,随着冻融次数增加,所提取的藻毒素量有所增加,冻融超过3次后,得到的藻毒素浓度趋于稳定。
本研究比较了四种方法提取藻毒素的效果,发现它们的提取效率各不相同(图6)。5%冰乙酸萃取获
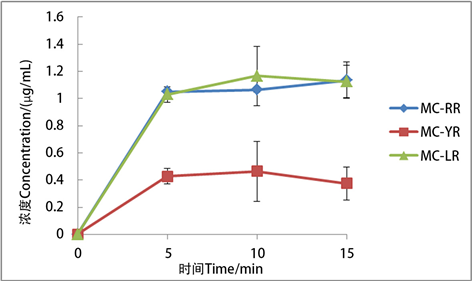
Figure 3. Concentrations of MCs extracted by grinding method
图3. 研磨法提取藻毒素的浓度

Figure 4. Concentrations of MCs extracted by boiling method
图4. 煮沸法提取藻毒素的浓度
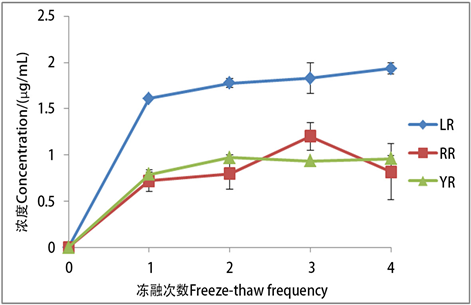
Figure 5. Concentrations of MCs extracted by freeze-thaw 4 times
图5. 反复冻融法提取藻毒素的浓度
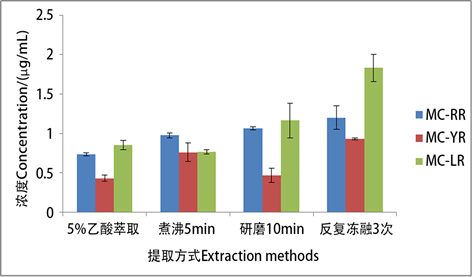
Figure 6. Concentrations of MCs extracted by different methods
图6. 不同提取方法所提取的藻毒素浓度

Table 1. The comparison of four extraction methods
表1. 4种提取方法的对比
得的三种藻毒素浓度分别为:0.73 ± 0.03、0.43 ± 0.04、0.85 ± 0.06 μg/mL;煮沸处理最优时间是5 min,获得的三种藻毒素浓度依次为:0.97 ± 0.03、0.76 ± 0.12、0.77 ± 0.03 μg/mL;研磨处理最优时间是10 min,获得的藻毒素浓度分别为:1.07 ± 0.02、0.46 ± 0.09、1.17 ± 0.22 μg/mL;反复冻融3次获得的藻毒素浓度为:1.20 ± 0.15、0.93 ± 0.01、1.83 ± 0.17 μg/mL,这些差异主要由于不同的提取方法对藻毒素的稳定性、藻细胞的破坏力等影响不同而造成的,除此之外,微囊藻中各类型的藻毒素含量也与藻株类型、地域及水华发生时间有关 [20] 。本研究对各个提取方法进行了对比(表1),结合实际操作,由表1可知,4种提取方法适用条件不同,研磨处理可用于短时间内小剂量的提取;煮沸处理和反复冻融法可用于大批量藻毒素提取,但煮沸时伴有恶臭,且操作中发现该方法产生的杂质不易于后续的富集、纯化,故不推荐采用;相对而言,5%冰乙酸萃取法用于大、小剂量的提取皆可,但有机溶剂的使用一定程度上降低了实验的安全性。
Lehman [22] 的研究发现反复冻融能促进细胞壁的破裂,彭亮 [6] 的研究也认为反复冻融能显著提高三种MCs样品的提取效率,是藻毒素提取的高效方法之一,本实验中反复冻融法也得到了较好的提取效果,除此之外,本实验在前人的研究基础上探究了最佳的冻融次数,并探讨了藻毒素的提取效果。研究结果表明冻融3次最为适宜,除了较高的提取效率之外,反复冻融操作还有其他优点——与有机溶剂萃取的提取方式相比,反复冻融可以省去有机溶剂做提取剂的操作,节省实验试剂,简化操作步骤,同时避免了有机溶剂对操作人员的身体健康带来损伤;与煮沸加热的方法对比,反复冻融法大大减少了提取过程中的环境污染,所得藻毒素杂质也更少 [20] [21] ;研磨处理的提取效率虽仅次于冻融法,但其操作本身不适用于大规模的藻毒素提取,因此在进行大批量藻毒素提取时,不推荐采用。综上所述,本研究认为,在实验室用反复冻融法提取藻毒素有着高效、简捷、安全、环保的优点,其实用性强,重复性高,且成本较低,便于藻毒素的大批量提取、纯化与分离。
4. 结论
(一) 本研究采集的湖南省某富营养化水体的(地理坐标:112˚57'4''N,28˚11'6''E)微囊藻中含有微囊藻毒素MC-LR、MC-RR和MC-YR;
(二) 本研究中,反复冻融法(3次)提取藻毒素的效率最高,研磨处理(10 min)和煮沸处理(5 min)次之,5%冰乙酸萃取提取所得的藻毒素量最少。因此,反复冻融法可作为实验室提取藻毒素最为优选的方法之一,可实现提取效率高,无毒、无腐蚀的安全提取,为大规模制备藻毒素纯品奠定了基础。
基金项目
大学生自由探索计划支持项目(201610533523, 201710533329, ZY20170939);湖南省自然科学青年基金(2016JJ3166);中国博士后科学基金特别资助(2016T90766);博士后科学基金面上项目(2015M572273)。