1. 引言
植物的不同组织器官中,每时每刻都在发生着各种代谢反应,活性氧(ROS)是植物代谢反应中的副产物。当植物遭受环境胁迫时,植物细胞中会产生并积累大量的活性氧 [1] 。低浓度的活性氧可以作为信号分子使植物相关防御基因表达 [2] 。植物细胞中积累的高浓度的活性氧会导致细胞损伤,膜脂氧化,从而使植物的正常生长和代谢受到影响 [3] 。多篇文献报道过,过量的ROS对植物生长发育是有害的。植物的线粒体、叶绿体等部位都会产生活性氧。而在植物细胞正常的生长和代谢过程中,植物细胞中叶绿体的类囊体膜上的光系统I(PSI)和光系统II(PSII)反应中心是ROS代谢的主要部位 [4] 。
为了防止ROS对细胞产生的伤害,植物有自己的抗氧化系统,包括酶促抗氧化系统和非酶促抗氧化系统。酶促抗氧化系统主要通过氧化清除酶类如谷胱甘肽过氧化物酶(GPX)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等来催化分解细胞产生的活性氧,防止细胞损伤。非酶促抗氧化系统主要是通过小分子化合物如坏血酸(AsA)、谷胱甘肽(GSH)、甘露醇等作为底物参与酶促反应来清除细胞产生的活性氧 [5] 。
在植物生长过程中,光氧化应激条件下,光合作用高能态的反应与O2丰富供应使叶绿体成为活性氧产生的主要部位。当细胞中积累的活性氧不足以被抗氧化防护系统清除时,过量的活性氧就会使叶绿体及细胞产生光氧化损伤 [6] ,导致光合作用下降,光合膜系统受到损伤 [6] ,使植物的正常生长受到抑制甚至死亡。本研究通过对毛白杨植株氧化胁迫处理前后的转录组分析,分析了氧化胁迫对毛白杨光合作用相关通路蛋白以及叶绿体膜结构相关蛋白的影响,以期对氧化胁迫后的木本植物光合作用提供实验依据。
2. 材料与方法
2.1. 实验材料
野生型毛白杨组培植株由实验室保存。植株生长条件为25℃,每天光照16 h。
2.2. 实验处理
选取生长时期为两个半月的野生型毛白杨组培植株,取植株中第二片叶子,用去离子水冲洗干净。室温避光条件下,将叶片完全浸入100 μmol/LMV(甲基紫金)溶液中处理5 h,将未处理的野生型毛白杨和氧化胁迫条件下处理的野生型毛白杨叶片用液氮速冻后保存于−80℃冰箱后进行转录组测序,将未处理的野生型毛白杨命名为wt,氧化胁迫条件下处理的野生型毛白杨命名为wt-1。
2.3. 实验方法
2.3.1. RNA-Seq技术:样本采集,Illumina测序和数据处理
将MV处理的叶片与未处理的叶片,根据制造商的方案(Invitrogen)使用TRIzol试剂分离总RNA,使用琼脂糖凝胶电泳检测RNA的完整性,用Agilent 2100 Bioanalyzer检测mRNA浓度,用Dynabeads mRNA Purification Kit进行mRNA的分离纯化,然后将片段化的mRNA反转录合成cDNA。使用Illumina基因组分析仪(HiSeqTM2000; Illumina, San Diego, CA, USA)对样品进行测序。将获得的Raw Reads数据进行数据过滤,选取Clean Reads数据,采用短reads组装软件trinity做转录组从头组装,得到两端不能延长的序列,即为Unigene,使用SOAPaligner/SOAP2将选取的Unigene序列的转录组与毛果杨基因组数据库比对 [7] 。使用RPKM(每百万读数每读取一个读数)计算基因表达水平 [8] 。
2.3.2. 差异表达基因的鉴定与分析
基于标准化的读取计数,使用DEGseq R软件包(1.12.0) [9] 对MV处理与未处理的野生型叶片之间的差异表达分析。使用Benjamini和Hochberg(1995)方法调整P值。校正后P值<0.005, 作为显著差异的阈值。
作为显著差异的阈值。
2.3.3. 差异基因GO功能,KEGG富集分析
使用GOseq R软件包对差异表达基因按分子功能、生物学过程、细胞组分做GO功能富集分析 [10] 。校正后的P值<0.05的GO功能被认为在差异表达的基因中显着富集。
利用KEGG数据库对差异表达基因进行代谢通路注释分析,采用Fisher检验计算差异表达基因的富集度,classic Fisher ≤ 0.01作为筛选阈值 [11] 。
3. 结果与分析
3.1. Reads与参考基因组比对情况统计(表1)
选取HISAT软件将过滤后的测序序列进行基因组定位分析。不同处理的样品wt得到43657504 reads,wt-1得到44090468 reads,经过与毛白杨基因组比对,分别比对上30486927和27708170个reads。
3.2. 差异基因GO富集分析
使用Gene Ontology数据库以及毛果杨基因组注释数据库对wt-1与wt对比组获得的显著性差异基因功能进行富集及注释分析。分析显示wt-1与wt对比组中,总基因数为3495,其中上调基因个数为1683,下调基因个数为1812(图1)。显著差异表达的上调基因中被功能注释且主要涉及383个生物学功能,富集在分子功能、生物学过程、细胞组分的3种GO分类中,分别为156,211和16种生物功能。显著差异表达的下调基因中被功能注释且主要涉及380个生物学功能,富集在分子功能、生物学过程、细胞组分的3种GO分类中,分别为78,246和78种生物功能。
GO功能中的差异基因进行分析得出,生物学过程在调控RNA代谢过程,转录调控,大分子代谢过程的调控等功能中都存在显著性上调基因,包括CIGR1,DRE1D,ERF19,AP2等基因,其中CIGR1

Table 1. Reads and reference genome alignment list
表1. Reads与参考基因组比对情况一览表

Figure 1. Difference gene volcano map. Significantly differentially expressed genes were expressed in red (up-regulated) and green (down-regulated), with no significant difference in genes expressed in blue dots; abscissa representing gene expression fold changes in different samples; and ordinate representing genes Statistical significance of differences in expression change
图1. 差异基因火山图。有显著性差异表达的基因用红色点(上调)和绿色点(下调)表示,无显著性差异表达的基因用蓝色点表示;横坐标代表基因在不同样本中表达倍数变化;纵坐标代表基因表达量变化差异的统计学显著性
的上调对植物防御和发育具有双重作用 [12] ,DREB1D的上调是植物对压力反应性转录调控的适应性策略,从而减轻环境胁迫的不利影响 [13] 。在分子功能中核酸结合转录因子活性,DNA结合等功能中都存在显著性上调基因,包括SCL14,WRKY6,WRK33等基因上调是植物氧化应激在转录水平上的调节作用 [14] ,从而减轻氧化应激对于细胞的损伤(图2)。
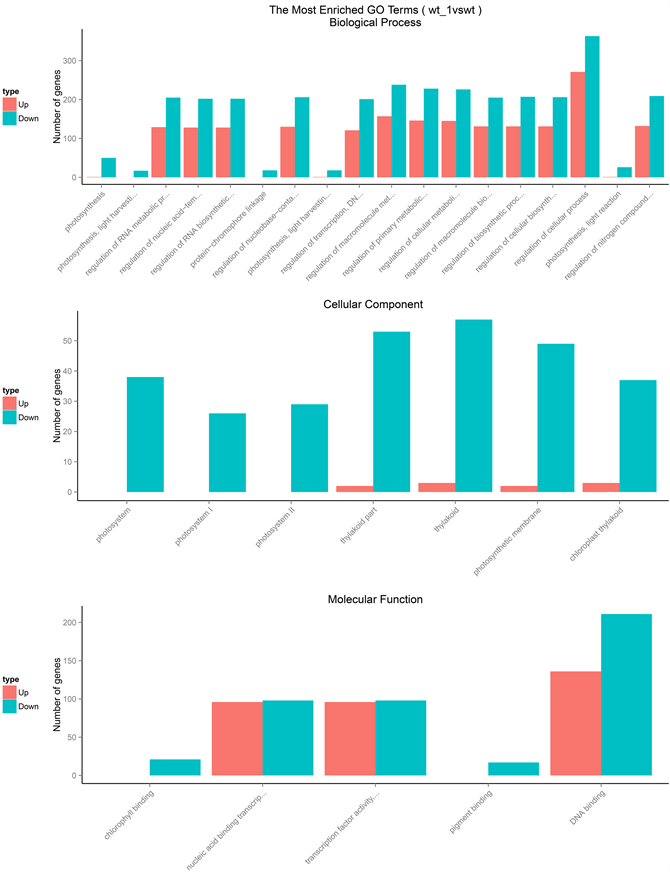
Figure 2. Enrichment of the histogram, the vertical axis is the enriched GO term and the horizontal axis is the number of differential genes in the term
图2. GO富集柱状图,纵坐标为富集的GO term,横坐标为该term中差异基因个数
光合作用中光能的捕获、电子传递等一系列的光反应都是由在光合膜上的色素蛋白复合物所推动的,其中植物光系统中捕光蛋白质复合物LHC是与色素分子结合的膜蛋白复合物,主要参与光合作用中光能的捕获与传递 [15] 。植物光系统II中的Psb复合蛋白是植物进行光合电子传递、水的裂解和氧气释放的重要蛋白复合物 [16] 。ATPc1所代表的的磷酸肌醇信号传导是早期发育阶段和微卫星形成过程中液泡形成的重要线索 [17] 。go功能中的差异基因进行分析得出,与生物学过程-光合作用相关的功能中,包括光反应,光调节,光采集等功能中都存在这显著性下调的基因,这些基因包括:PRK、Lhca、Lhcb、cp24、ACSF、ATPc1、CHL27、CP24、CP26、geranylgeranylreductase family protein、Lhca、Lhca1、Lhca2、Lhca3、Lhca4、Lhcb1、Lhcb2、Lhcb3、Lhcb4、LIL3、phytochrome A、PsaG、PsaK、Psb27、Psbp、PsbQ、PsbS、PsbW、PsbY、PsbX等蛋白(图2)。说明在氧化胁迫后,在光合作用中,相关天线蛋白复合物的光采集与电子传递传递,磷酸肌醇信号传导等蛋白都出现了下调的异常。
在光系统II(PSII)中,光合叶绿素结合蛋白,质体蛋白家族对于叶绿体光捕捉和类囊体的基粒的堆积与膜重组都具有关键作用 [18] 。go功能中的差异基因进行分析得出,与细胞组分–光合膜相关的功能中,包括光合膜,光系统I(PSI),光系统II(PSII),叶绿体类囊体膜,质体类囊体膜,叶绿体类囊体,膜蛋白复合物等功能中都存在这显著性下调的基因,这些基因包括:ACSF、ATPc1、CHL27、CP24、CP26、cytochrome b6f、geranylgeranylreductase family protein、Lhca、Lhca1、Lhca2、Lhca3、Lhca4、Lhcb1、Lhcb2、Lhcb3、Lhcb4、LIL3、PetE、phytochrome A、PsaD、PsaG、PsaK、Psb27、Psbp、PsbQ、PsbS、PsbW、PsbY、PsbX等蛋白(图2)。说明在氧化胁迫后,叶绿体遭到破坏,与光合作用有关的定位在叶绿体光合膜上以及类囊体膜上的膜脂蛋白被氧化,导致与叶绿体光合膜上以及类囊体膜上的蛋白等都出现了下调的异常。
高等植物光系统I是一种多蛋白色素复合物,其中由四个色素蛋白复合(Lhca1-Lhca4)组成的LHCI参与协调叶绿素a,叶绿素b,叶黄素,紫黄质,和β胡萝卜素的合成 [19] 。go功能中的差异基因进行分析得出,与分子功能-叶绿素,色素结合相关的功能中,包括光反应,光调节,光采集,光合膜,光系统I,光系统II,叶绿体类囊体膜等功能中都存在这显著性下调的基因,这些基因包括:ACSF、ATPc1、CHL27、CP24、CP26、cytochrome b6f、geranylgeranylreductase family protein、Lhca、Lhca1、Lhca2、Lhca3、Lhca4、Lhcb1、Lhcb2、Lhcb3、Lhcb4、LIL3、PetE、phytochrome A、PsaD、PsaG、PsaK、Psb27、Psbp、PsbQ、PsbS、PsbW、PsbY、Psb等蛋白(图2),说明在氧化胁迫后,叶绿体光系统I内蛋白色素复合物降低了对叶绿素和叶黄素等色素的合成,导致与叶绿素、色素结合相关的蛋白等都出现了下调的异常。
通过对go功能的生物学过程,细胞组分,分子功能的结果分析,在氧化胁迫条件下,野生型毛白杨中与抗性相关的存在着显著性上调,而与光合作用相关功能基因的存在显著性下调,说明经过氧化胁迫后,叶绿体产生氧化损伤,叶绿体光合作用受到破坏,光合膜相关蛋白可能被氧化。
3.3. 差异基因KEGG分析
在生物体内,不同基因相互协调行使其生物学功能,通过Pathway显著性富集能确定差异表达基因参与的最主要生化代谢途径和信号转导途径。通过分析得出Pathway的代谢通路在显著性上调基因主要富集在在植物病原体相互作用,蛋白质在内质网中的加工,胞吞作用等代谢通路中(图3)。而显著性下调基因主要富集在植物激素信号转导代谢通路中,光合作用–天线蛋白谢通路中,光合作用谢通路中,卟啉和叶绿素代谢通路中(图4)。
氧化应激条件下,植物病原体相互作用通路相关的抗性信号的基因的表达上调,可能是由于ROS累积的毒性直接作用于植物病原体而引起的 [20] 。蛋白质在内质网中的加工通路中ERAD_C的泛素连接酶

Figure 3. Protein processing in endoplasmic reticulum, Red represents the up-regulated gene
图3. 蛋白质在内质网中的加工,红色代表上调基因
Doa10基因上调,可能是氧化应激条件下,蛋白质被氧化,导致ERAD_C的泛素连接酶Doa10识别并降解异常的内质网蛋白 [21] (图3)。
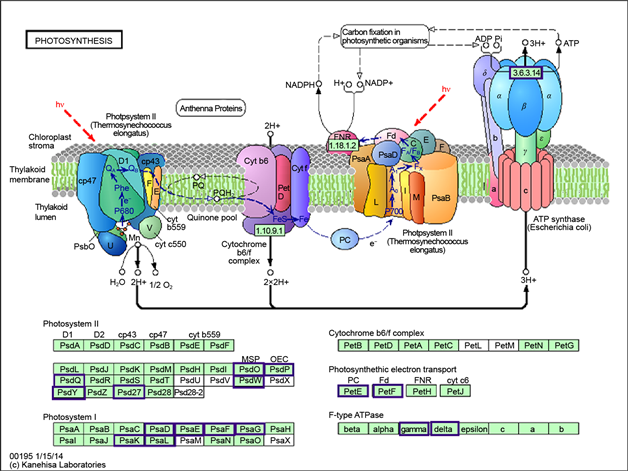
在光合作用中,光系统I(PSI)和光系统II(PSII)是通过捕光天线蛋白来调节光能的分配,促进过剩光能的耗散,降低ROS在叶绿体中的积累,从而保护植物光合作用 [22] ,并在光捕获和适应光照变化方面起着重要的作用。在光合作用–天线蛋白通路中,LHC (采光天线蛋白)中,显著性下调基因包括Lhca1、Lhca2、Lhca3、Lhca4、Lhcb1、Lhcb2、Lhcb3、Lhcb4、Lhcb5、Lhcb6 (图4(b))说明在氧化胁迫后,光合作用受损,叶绿体PSII中LHC遭到破坏,从而使光系统II主要捕光色素蛋白复合体(LHCII)结合相关的蛋白等都出现了下调的异常。
在光能传递中,植物光系统II(PSII)中的psb复合蛋白是植物进行光合电子传递、水的裂解和释放氧气的重要蛋白复合物 [23] 。而PsbW蛋白对于类囊体膜基粒区域中PSII-LHCII超复合体的组装和稳定性是起关键作用的 [24] ,type-ATP中叶绿体F1Fo-ATP合成酶(CF1Fo)驱动ATP合成和ATP水解的逆反应,尤其是在胁迫条件下,ATPase氧化还原调节可以增加叶绿体对于H2O2的耐受性 [25] 。而LDH3对于植物中活性氧中间体的水平有调节作用 [26] 。在光合作用通路PSI中,显著性下调基因包括PsaD、PsaE、PsaF、PsaG、PsaK、PsaL。PSII中,显著性下调基因包括PsbO、Psbp、PsbQ、PsbW、PsbY、Psb27。F-type ATP中,显著性下调基因包括gamma、delta (图4(a))。说明在氧化胁迫后,ROS在叶绿体中的积累破坏了光合作用,导致了PsaG、psbW、CF1Fo等基因的下调,从而导致了电子传递,类囊体膜蛋白形成受到影响。
通过对Pathway显著性富集通路的分析,氧化胁迫条件下,抗性信号的基因的表达上调,相关降解异常内质网蛋白的酶表达上调,而光合作用有关的蛋白以及与光合膜,类囊体膜有关蛋白存在着显著性下调,说明氧化胁迫后,植株的光合作用降低,光合相关膜脂结构被氧化。
4. 讨论
氧化胁迫通常由植物遭受环境胁迫时,造成植物细胞中产生并积累大量的活性氧,这些活性氧会使植物形态、生理生化和细胞结构产生一系列变化 [27] 。植物发展出自己的抗氧化防御系统来阻止ROS对
 (a)
(a)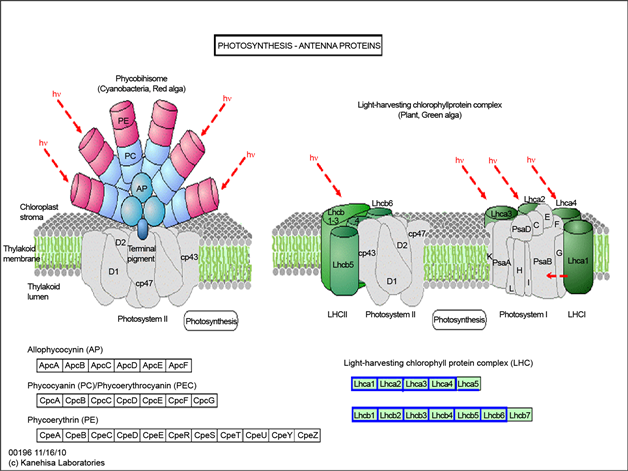 (b)
(b)
Figure 4. Significant enrichment of the KEGG pathway metabolic pathway map (a) for photosynthesis, (b) for Photosynthesis-antenna protein
图4. 显著富集的KEGG pathway代谢通路图(a)为光合作用,(b)为光合作用–天线蛋白
细胞产生的潜在伤害 [4] 。本研究对野生型毛白杨组培植株的叶片进行氧化胁迫后,通过对其转录组进行分析,通过go功能和KEGG等方面进行比对,发现野生型毛白杨植株光合作用相关通路蛋白、叶绿体膜结构相关蛋白有显著性型下调的趋势。首先,通过go功能和KEGG分析得出经过氧化胁迫后的植株体的光合作用中光系统I,光系统II的光反应中心和LHCI(外围部分采光天线)的蛋白均显著性下调。同时光合膜,类囊体膜结构,相关叶绿体类囊体的基粒的堆积和膜重组相关蛋白也显著性下调。说明了ROS的积累可能导致光合作用受损。氧化胁迫后的chl27下调,在拟南芥相关研究中也已得到证实,chl27的突变会阻碍植物正常生长和破坏PSII反应中心,从而损坏引起叶绿体发育使类囊体膜遭到破坏,光合活性降低 [28] 。氧化胁迫后的Lhcb1下调,说明了相关膜脂蛋白被氧化,导致光合膜结构、类囊体膜结构也出现了异常,这在已报到的Lhcb1对于类囊体膜结构的灵活性以及基粒的堆积和膜形成都有重要作用已经被证实 [29] 。最后,叶绿体是植物细胞ROS代谢和受活性氧损伤的主要部位 [30] ,本研究中发现经过氧胁迫后的毛白杨组培植株叶片中与光合作用有关的蛋白以及与光合膜,类囊体膜有关蛋白存在着显著性下调。在受到氧化胁迫下,本研究中相关下调蛋白可以作为植物受到氧化胁迫的证据之一,为植物尤其是木本植物应对氧化胁迫及各种逆境胁迫提供实验依据。
5. 结论
毛白杨植株遭受外界环境的变化而产生氧化胁迫后,会产生大量的活性氧并会在细胞内积累。实验得出,高浓度的活性氧会使叶绿体产生氧化损伤 [26] ,导致光合作用下降,光合膜系统受到损伤,从而影响细胞正常的生理生化。
基金项目
北京林业大学杰出青年人才计划100万“中央高校基本科研业务费专项资金资助”(supported by “the Fundamental Research Funds for the Central Universities”) JC2015-01。