1. 引言
自第一次工业革命以来,全球工业水平的飞速发展促进社会不断进步的同时也造成了许多的环境污染问题 [1] 。其中,对污染水资源的处理与再利用成为目前重点关注的要点之一,净化效率高、二次污染小的新的处理手段急需开发 [2] [3] 。光催化氧化技术是消除水污染较好的一种方法,近年来得到了广泛的关注和研究 [4] [5] 。它利用半导体吸收太阳光产生光生载流子,进而生成一系列具有强氧化性的自由基来实现对污染物分子的降解,将废水中的有机污染物氧化还原成H2O、CO2等小分子物质,达到高效率处理废水的目的。一般来讲,光催化所用的半导体材料例如MoO3、MoS2、CuO等需要具有合适的禁带宽度(带隙能Eg),当更大能量的光照射半导体材料时,价带上的电子(e-)将吸收光子获得足够的能量被激发,形成的电子空穴便具备了强的还原性和氧化性,经过反应产生的强氧化还原性的自由基使有机物分解 [6] 。
在众多光催化半导体材料中,MoO3有着丰富的储量,并具有化学稳定性高、制备成本低等诸多优点,在光催化应用领域具备潜在的应用价值 [7] 。但MoO3带隙较宽(3.1 eV),难以在可见光下产生响应,并且载流子迁移速率较慢,通常采用与其它半导体复合的方法加以改善 [8] 。例如,甄延忠等 [9] 采用化学沉积法将Fe2O3纳米颗粒负载到MoO3纳米带上得到Fe2O3/MoO3复合光催化剂,发现可见光下催化剂异质结能够快速分离光生电子和空穴,40 min内对RhB的降解效率高达99%。揣宏媛等 [10] 将静电纺丝技术与溶胶–凝胶法相结合,成功制备了V2O5/MoO3纳米纤维。发现Mo/V摩尔比为1:6时降解除去率达97.24%。Honglin Li等 [11] 采用计算和实验的方法对负载MoS2纳米颗粒的MoS2/MoO3复合光催化剂进行了研究,结果发现,复合光催化剂能够更高效地利用可见光能量,同时促进电子、空穴分别向MoO3导带和MoS2价带转移,进而有效提升光催化活性。我们课题组 [12] 采用化学沉淀法在MoO3纳米带表面负载了AgBr量子点,制备的AgBr/MoO3不仅对RhB溶液具有超强的光催化氧化降解效果,还对噻吩等有机物具有明显可见光催化效果。由此可见,两种半导体的复合可以利用不同半导体的能带位置差,有效地将电子、空穴转移到不同的半导体上,从而实现光催化效率的提升。
MoS2是目前广泛应用于光催化领域的半导体材料,其带隙较窄,能够有效地在可见光下激发 [13] [14] 。基于此,本文在前期MoO3纳米带研究的基础上,探索其与MoS2的复合制备,期望获得催化性能良好的复合体系,用于有机污染物的有效光降解去除。
2. 实验材料和方法
2.1. 实验材料
钼粉(Mo),分析纯,阿拉丁;硫氰化钾(KSCN),分析纯,南京化学试剂有限公司;过氧化氢(H2O2),30%纯度,南京化学试剂有限公司;钼酸钠(Na2MoO4),分析纯,阿拉丁;硫代乙酰胺(CH3CSNH2),分析纯,国药集团化学试剂有限公司;无水乙醇(C2H5OH),分析纯,南京化学试剂有限公司;罗丹明B(C28H31ClN2O3,RhB),分析纯,阿拉丁。
2.2. 样品制备
2.2.1. 单独MoO3的制备
称取0.72 g钼粉置于35 mL的去离子水中,磁力搅拌5 min。然后逐滴缓慢滴加10 mL浓度为30%的过氧化氢溶液,每次滴加1 mL,分十次滴加,其中时间间隔为10 s,持续搅拌30 min,直到溶液逐渐由浑浊的深灰色转变为澄清的亮黄色。接着将制得的前驱体溶液转移到聚四氟乙烯反应釜内衬中,将反应釜放入180℃烘箱中保温12 h。冷却后收集固体粉末,用去离子水和无水乙醇分别清洗过滤去除杂质,70℃烘干,得到白色MoO3粉末备用。
2.2.2. MoS2@MoO3复合光催化剂的制备
称取上述制备的0.1 g的MoO3置于烧杯中加入40 mL去离子水中。再加入2 mg的钼酸钠和4 mg的硫代乙酰胺,将混合溶液磁力搅拌30 min,混合均匀后转移至反应釜中,180℃下保温24 h。随炉冷却后收集粉末样品,用去离子水和无水乙醇分别洗涤两次,80℃干燥得MoS2@MoO3复合光催化剂。单独的MoS2采用0.1 g的钼酸钠和0.2 g的硫代乙酰胺的水热反应获得,用于对比。
2.3. 样品表征
采用日本理学的Miniflex 600 X-射线衍射仪进行物相表征分析,测试条件为:电流、电压分别为15 mA、40 KV;Cu靶Kα激发;衍射角2θ测试范围:10˚~70˚;扫描速度:10˚/min。采用美国FEI公司S-4800型场发射扫描电子显微镜对样品进行微观形貌表征及能谱测试。
2.4. 染料标准曲线绘制
在暗吸附及光催化实验中,染料溶液的浓度无法直接测得。由于不同浓度的染料溶液在紫外-可见分光光度计下的吸光度值不同,从而可利用吸光度通过换算得到待测溶液中的染料浓度。根据朗伯比尔定律(Lambert-Beer law):
(1)
其中,A为测试样品的吸光度;Io和I分别为入射光强和透射光强;T为透射比,即透射光强与入射光强之比(I/Io);k为吸光比例系数;c为待测样品溶液浓度;d为光程,即盛放溶液石英槽的透光厚度。据此可知,溶液的吸光度与其浓度存在线性关系,因此我们可以配置一系列已知浓度的染料溶液并进行线性拟合,再根据得出的线性方程计算被测染料溶液的浓度。
试验中使用的染料是RhB。染料溶液标准曲线的绘制过程为:首先使用1 L的容量瓶配置浓度为100 mg/L的RhB溶液,然后稀释一定的倍数配置出浓度为1~10 mg/L的RhB溶液,并对每份样品溶液进行光吸收度测试。不同浓度标准溶液的紫外-可见吸收光谱如图1(a)所示。由图谱可知RhB溶液的特征吸收峰位于553 nm处,样品溶液的浓度和特征吸收峰处吸光度的对应关系如图1(b)所示:RhB染料的标准曲线拟合方程为A = 0.0937C − 0.0012,相性相关系数为0.99545。
2.5. 光催化测试
光催化反应实验过程中一直磁力搅拌保证实验样品与染料溶液能够充分接触。另外,光催化反应的
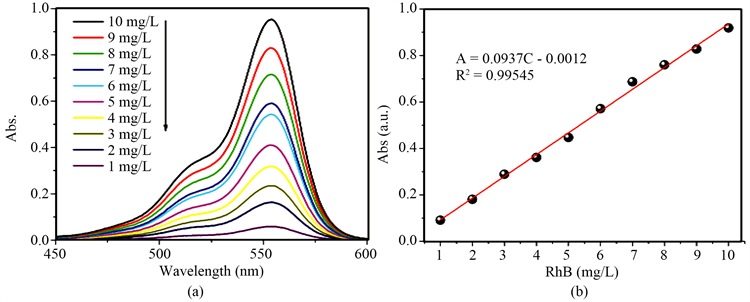
Figure 1. (a) Standard absorbance spectrum of different concentrations of the RhB solution; (b) Absorbance fitting curve of concentration and characteristic absorption peak
图1. (a) 不同浓度RhB溶液的标准吸光度图谱;(b) 浓度-特征吸收峰吸光度拟合曲线
过程中采用循环水冷凝,防止溶液在强光照射下由于吸收能量使得自身温度过高而蒸发,影响溶液浓度,降低实验的精准度。可见光下光催化实验使用的光源是功率为150 W的氙灯,波长为400 nm~800 nm。
实验中以RhB溶液为模拟有机污染物,称取待测物质15 mg,量取100 mL浓度为10 mg/L的RhB溶液。将溶液倒入烧杯中,然后加入待测物质磁力搅拌,在黑暗条件下搅拌1 h使待测物质与染料分子之间达到吸附-脱附动态平衡。暗态吸附结束后进行光照,每隔10 min从烧杯中抽取5 mL上层溶液离心后测试。使用UV-3600型紫外-可见分光光度计测试暗态吸附及光催化过程中的染料溶液,根据特征峰 (553 nm)对应的光吸收度,换算得到所测溶液的浓度,计算出光催化降解度。公式为:
(2)
式中Et为光催化进行到t时刻的光催化降解效率,Co为暗态吸附结束后染料溶液的浓度,Ct为光催化进行到t时刻使染料的浓度。
3. 结果与讨论
3.1. X-射线衍射分析(XRD)
图2为单体MoO3和MoS2以及MoO3@MoS2复合物的XRD图谱。通过与标准JCPDS卡对照发现,单体MoO3的衍射峰与正交晶系的α-MoO3相对应(JCPDS #05-0508, a = 0.3962 nm, b =0.1385 nm, c = 0.3697 nm),相应的(020)、(110)、(040)、(021)、(150)等主要衍射峰明显而尖锐,表明其结晶度较高 [15] 。而单体MoS2的衍射峰对应于标准六方相MoS2(JCPDS #37-1492),其中2θ = 14.52˚、32.56˚、40.67˚和57.60˚处的衍射峰分别对应于MoS2的(002)、(100)、(103)和(110)晶面 [16] 。相比之下,MoO3@MoS2复合结构样品的衍射峰包含MoO3和MoS2的衍射峰,只是(020)晶面对应的MoO3衍射峰强度明显下降,2θ约15˚、33˚位置处的强度较弱、跨度较宽的峰对应于MoS2的(002)和(100)晶面。这种结果可以确认MoS2/MoO3复合催化剂的成功合成,并且水热反应过程中MoO3的晶体结构保持稳定,MoS2可能优先在MoO3的(020)晶面形核生长。
3.2. 表面形貌分析
图3(a)为单体MoO3的SEM照片,可以看出,白色的MoO3呈相互堆叠交织的纳米带结构,纳米带

Figure 2. XRD patterns of monomer MoO3, MoS2 and MoS2@MoO3 composite sample
图2. 单体MoO3、MoS2及MoS2@MoO3复合样品的XRD图谱

Figure 3. SEM images of different samples: (a), (b), (c) surface morphology of MoO3, MoS2 and MoS2/MoO3 composite sample; (d) EDS energy spectrum of loaded particles
图3. (a) MoO3和(b) MoS2以及(c) MoS2/MoO3复合样品的SEM图;(d) 负载颗粒的EDS能谱
的宽度在2~5 μm之间,且表面及边缘均清晰、光滑,相关研究表明,MoO3的带状形貌与水热反应溶液的强酸性环境有关。而黑色的单体MoS2为板片状结构,板片由1~3 μm的MoS2团聚而成,如图3(b)所示。图3(c)为MoS2@MoO3复合物的SEM照片,由图可以看出,复合样品中MoO3纳米带表面出现明显的MoS2纳米颗粒。根据相关光催化研究经验,MoS2的催化活性位点主要分布于其侧面边缘,这些位置存留着大量的悬挂键和晶体缺陷细,但是在范德华力的作用下,单相MoS2常产生较为严重的团聚现象,不可避免的使边缘活性位点数量大幅度下降,导致其催化活性降低 [17] [18] ,因此弥散分布的负载颗粒保证了催化活性位点不会因为团聚而消失,有利于载流子的迁移,从而提高了整体的催化能力。图3(d)为MoS2@MoO3复合物中负载颗粒的EDS能谱,可以发现Mo、S的原子比接近1:2,这表明MoO3纳米带表面生长的纳米颗粒为纯净的MoS2,进一步证实了MoS2@MoO3复合物的形成。
3.3. 样品的光催化性能
图4(a)为吸附平衡后单体MoO3、MoS2以及MoS2/MoO3复合物的光催化降解RhB的曲线。从图中可以看出,单体MoO3和单体MoS2在60 min的可见光照射下浓度几乎没有变化,这表明这种条件下RhB并没有得到降解。归其原因在于单体MoO3带隙过宽,可见光下无法有效激发出电子、空穴,故不显示光催化活性;而单体MoS2虽然带隙窄小,可见光下可以激发出大量电子、空穴,但电子、空穴复合严重,因而也不显示光催化活性。然而,MoS2/MoO3复合物显示了较高光催化活性,在60 min的可见光照射下降解率可达到75%。通过光催化降解RhB曲线变换得到In(C/C0)~t曲线,拟合后可以计算出产物的降解速率常数,如图4(b)所示。单体MoO3和单体MoS2的降解速率常数几乎为0,这与其几乎不显示光催化活性的结果一致,而MoS2/MoO3复合物的降解速率常数为0.02304,远远大于单体的降解速率常数值。在可见光的照射下,MoS2/MoO3复合物中的MoS2价带的电子(e−)跃迁至导带,在价带留下强氧化性的空穴(h+)。一部分空穴直接氧化降解RhB分子,另一部分与溶液中的OH-反应生成强氧化性的羟基自由基(·OH),进而氧化RhB分子。同时,激发至导带的e−向MoO3导带转移,因而e−与h+实现了快速分离,故复合催化剂表现出较好的可见光催化活性。
4. 结论
通过水热法成功地获得了MoS2/MoO3复合催化剂,SEM显示复合物由MoO3纳米带表面负载MoS2纳米颗粒组成,XRD和EDS进一步确认了MoS2/MoO3复合物的形成。产物的光催化性能测试表明,MoS2/MoO3复合物展示了比单体MoS2和MoO3更优异的降解RhB特性,在60 min的可见光照射下降解率可达到75%,对应的降解速率常数为0.02304,这种更好的可见光催化活性来自于电子与空穴的快速分离。

Figure 4. (a) Photocatalytic degradation curves of monomer MoO3, MoS2 and MoS2@MoO3 composite sample; (b) Corresponding photocatalytic reaction rate fitting curve
图4. (a) 单体MoO3、MoS2及MoS2@MoO3复合样品的光催化降解RhB曲线;(b) 对应的光催化反应速率拟合曲线
致谢
感谢大学生创新训练计划项目(No. 2017CX00608)和中央高校基本科研业务费专项资金(No. NS2017038)对本文的资助。
NOTES
*通讯作者。