1. 引言
硫醇如半胱氨酸(Cys)、谷胱甘肽(GSH)和同型半胱氨酸(HCy),是许多蛋白质和小分子的重要组成部分,也是生命活动过程中不可或缺的 [1] [2] 。例如,体内缺乏半胱氨酸会引起儿童生长缓慢、肝脏损伤和皮肤病等 [3] [4] 。作为细胞中含量最高的硫醇,谷胱甘肽可以提高细胞的抗氧化能力,对细胞生长过程的氧化应激和代谢功能起着至关重要的作用。谷胱甘肽水平也与许多其他的疾病直接相关 [5] 。此外,血液中同型半胱氨酸的增加将导致维生素B12的缺乏,甚至引起阿尔茨海默症 [6] 。因此,检测硫醇具有重要意义。
在过去的几十年中,检测硫醇的方法有很多,包括高效液相色谱法(HPLC) [7] 、电化学方法 [8] [9] 、毛细管电泳法(CE) [10] 、质谱法(MS) [11] 和荧光法 [12] [13] [14] 等等。 [15] [16] [17] 这些技术方法中,荧光法由于其灵敏度高、易于操作的特点受到了广泛关注。然而,大多数的生物样品通常在低于600 nm的波长范围内有荧光发射,很容易和荧光探针的荧光发射光谱重叠,从而干扰荧光检测的灵敏度 [18] 。事实上,在近红外光区(700 nm以上),生物样品中的背景干扰可大大降低 [19] [20] 。因此,设计合成具有高灵敏度以及良好选择性的近红外荧光探针来检测硫醇是十分必要的。
在本工作中,我们发现设计合成的对称性方酸分子Sq-TPE可以作为一种近红外荧光探针来检测硫醇化合物。方酸菁染料分子带隙很低,核心结构是一个常见的缺电子单元,很容易被亲核试剂进攻,如F-和含硫基的化合物等等 [21] ,导致共轭结构发生改变,从而产生颜色和荧光发射的变化。我们测试了Sq-TPE分子对硫醇化合物的选择性响应,通过紫外吸收光谱和荧光光谱对其检测机理和检测效果进行了研究。
2. 实验部分
2.1. 药品、试剂及仪器
初始原料均采购于阿拉丁生化科技股份有限公司、百灵威科技有限公司和安耐吉化学试剂公司等。合成过程中用到的溶剂(甲苯和四氢呋喃等)均在氩气氛围下,经溶剂处理装置处理后使用。此外,其它的试剂和药品除特殊标注外,均直接使用。核磁共振氢谱和碳谱测试采用的是BrukerAVANCE III 600 MHz核磁共振仪,以氘代氯仿为溶剂,四甲基硅烷为内标。基质辅助激光解吸电离飞行时间质谱(MALDI-TOF)采用的是Bruker Autoflex质谱仪,以1,8,9-三羟蒽作为基质。紫外-可见吸收光谱采用岛津UV-2450型紫外可见光谱仪测试,电化学实验是在CHI660A型电化学工作站上进行的,所有电化学测试均是在氩气保护下,以二茂铁为内标,以0.1 mol/L四丁基六氟磷酸铵的二氯甲烷溶液为电解质溶液,扫描速度为50 mV/s。
2.2. 中间产物2和终产物Sq-TPE的合成
中间体2和最终产物Sq-TPE的合成路线如图1所示。
2.2.1. 中间产物2的合成
将化合物1 (500 mg, 1.04 mmol)和1-hexyl-1H-pyrrole-2-carbaldehyde (186 mg, 1.04 mmol)置于150 mL两颈烧瓶中,通氩气15 min除氧,加入40 mL THF溶解,于0℃下一次性加入NaH (150 mg, 3.75 mmol)。反应30 min后升至室温,然后在65℃下回流反应过夜。反应完成后,将反应液倒入冰水中,用三氯甲烷萃取后合并有机相,水洗三次,然后用无水硫酸钠干燥,过滤后旋干溶剂,得到粗产品。粗产品经柱层析纯化,淋洗剂为三氯甲烷和石油醚的混合溶剂,体积比为1:5,得到亮黄色固体320 mg,产率61%。
2.2.2. 终产物Sq-TPE的合成
将化合物2 (320 mg, 0.63 mmol)和3,4-二羟基-3-环丁烯-1,2-二酮(36 mg, 0.32 mmol)置于150 mL两颈烧瓶中,通氩气15 min除氧,加入20 mL甲苯和20 mL正丁醇溶解,在回流泠凝管上加一分水器,回流反应过夜。反应完成后,将反应液倒入冰水中,用三氯甲烷萃取后合并有机相,水洗三次,然后用无水硫酸钠干燥,过滤后旋干溶剂,得到粗产品。粗产品经柱层析纯化,淋洗剂为三氯甲烷和石油醚的混合溶剂,体积比1:1,得到棕黑色固体158 mg,产率46%。
3. 结果与讨论
3.1. 中间产物和终产物的氢谱碳谱分析
1) 中间产物2:1H NMR (600 MHz, CDCl3): δ 7.17 (d, J = 8.4 Hz, 2H), δ 7.15-7.01 (m, 15H), δ 6.97 (d, J = 8.4 Hz, 2H), δ 6.87 (d, J = 16.2 Hz, 1H), δ 6.76 (d, J = 15.6 Hz, 1H), δ 6.65 (t, J = 1.8 Hz, 1H), δ 6.44-6.43 (m, 1H), δ 6.13 (t, J = 3.0 Hz, 1H), δ 3.91 (t, J = 7.2 Hz, 2H), δ 1.73-1.70 (m, 2H), δ 1.33-1.26 (m, 6H), δ 0.87 (t, J = 6.6 Hz, 2H). 13C NMR (150 MHz, CDCl3):δ 143.86, 143.80, 142.45, 140.92, 140.73, 136.04, 131.69, 131.44, 131.38, 127.79, 127.68, 127.63, 126.47, 126.40, 125.62, 125.24, 122.53, 116.88, 108.23, 106.56, 47.02, 31.55, 31.39, 30.90, 29.72, 26.48, 22.54, 13.99.
2) 终产物Sq-TPE:1H NMR (600 MHz, CDCl3 ): δ 7.83 (s, 2H), δ 7.37 (d, J = 8.4 Hz, 1H), δ 7.25 (d, J = 8.4 Hz, 2H), δ 7.17-6.95 (m, 38H), δ 6.85 (d, J = 4.8 Hz, 2H), δ 6.78 (d, J = 9.0 Hz, 1H), δ 4.79 (d, J = 6.6 Hz, 4H), δ 1.74 (t, J = 6.0 Hz, 4H), δ 1.37-1.27 (m, 12H), δ 0.86 (t, J = 6.6 Hz, 6H). 13C NMR (150 MHz, CDCl3): δ 168.88, 145.95, 144.96, 143.58, 143.53, 143.44, 141.85, 140.33, 134.79, 134.35, 132.02, 131.39, 131.36, 131.32, 130.55, 127.86, 127.80, 127.67, 126.73, 126.65, 126.61, 126.42, 123.98, 114.76, 113.82, 46.66, 32.08, 31.56, 29.69, 26.13, 22.51, 13.98. HRMS-ESI m/z: calcd for C80H72N2O2 [M+H]+ 1093.5667, found 1093.5652.
3.2. 方酸分子Sq-TPE的光物理性质
图2表示的Sq-TPE分子在二氯甲烷溶液中的紫外-可见吸收光谱和荧光发射光谱。如图所示,Sq-TPE分子的吸收峰主要在714 nm处,代表的是方酸分子的分子内电荷转移(ICT),从两侧的TPE-pyrrole基团
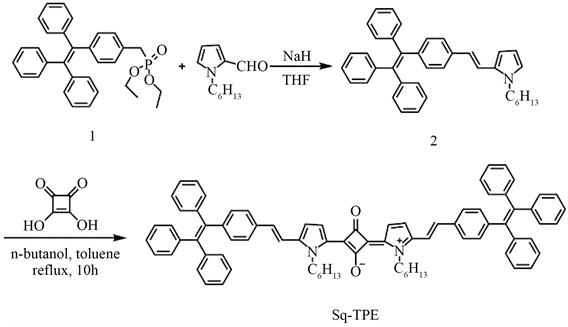
Figure 1. Synthetic routes for the squaraine dye Sq-TPE
图1. Sq-TPE分子的合成路线
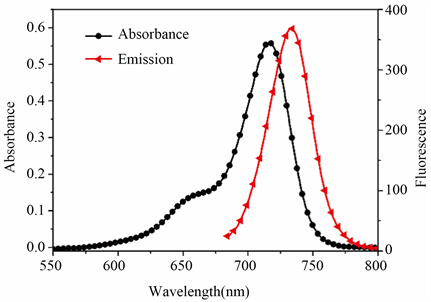
Figure 2. UV-vis absorption (black line) and the emission spectra (red line, λex 665 nm) of Sq-TPE (2 μM) in CH2Cl2
图2. Sq-TPE在二氯甲烷溶液中的紫外-可见吸收(黑线)和荧光发射光谱(红线)
向中间方酸结构单元进行电荷转移。Sq-TPE分子在近红外光区也表现出强烈的荧光发射,最大的发射波长为740 nm。Sq-TPE分子的吸收和发射谱带都很窄,而均位于近红外光区,斯托克斯位移也只有18 nm,这些均符合方酸菁染料的典型特征。
3.3. 紫外和荧光滴定
我们首先研究的是Sq-TPE探针分子对硫醇的响应情况。图3是荧光探针对硫醇的紫外和荧光滴定图,其中滴定实验是在DMSO-H2O混合溶剂中进行的,溶剂体积比为9:1。如图3(a)所示,随着Cys的加入,Sq-TPE探针在714 nm处的最大吸收强度逐渐降低。与此同时,在425 nm处出现一个新的吸收带,并逐渐增强。相应地,由图3(a)中的插图可以看到,溶液产生了一个肉眼可见的颜色变化,从墨绿色到黄色。吸收的变化表明,Cys的加入使得Sq-TPE分子的共轭结构发生了变化。荧光光谱的激发波长为665 nm,
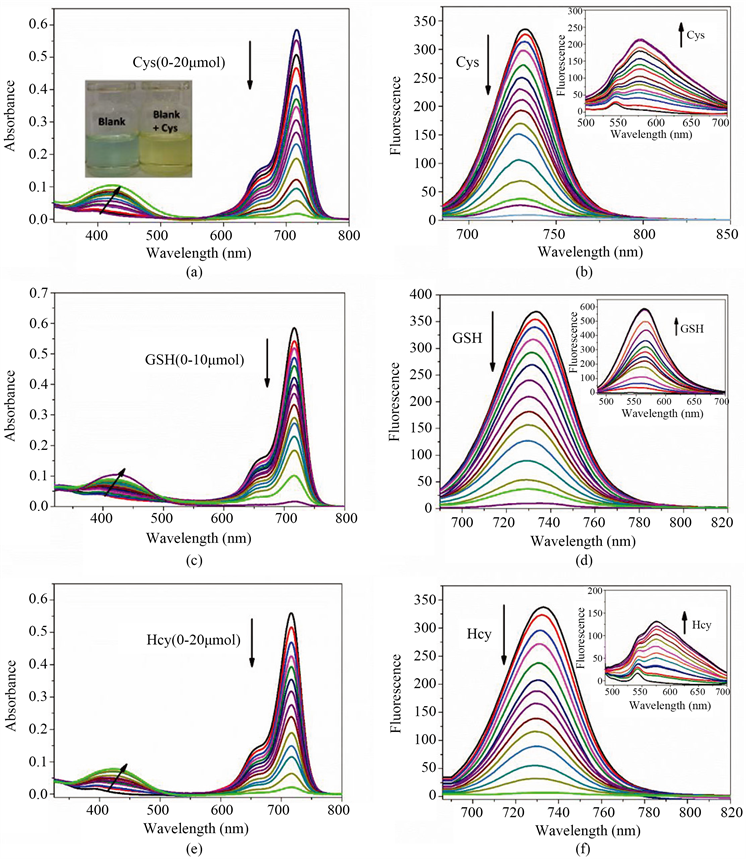
Figure 3. The changes of absorption spectra of Cys, GSH and HCy by Sq-TPE probe molecules (a) and emission spectra (b, excited at 665 nm) of Sq-TPE (2 μM) with addition of Cys (0~20 μM). Inset: (a) the color change of Sq-TPE after addition of Cys; (b, d, f) the change of emission spectra (excited at 425 nm)
图3. Sq-TPE探针分子对Cys、GSH和HCy的紫外和荧光滴定图。插图:a添加Cys后,Sq-TPE的颜色变化;b、d和f激发波长为425 nm的荧光滴定图
为了保持荧光发射光谱的完整性没有用最大吸收波长(710 nm)激发。如图3(b),随着Cys的加入,Sq-TPE探针分子在740 nm的荧光强度逐渐降低直至完全淬灭。另一方面,当激发波长为425 nm时,探针分子在575 nm处的荧光强度却逐渐增强,从图3(b)中的插图可以很清楚地观察到,这也与近红外发射强度的减弱相对应。加入Cys后,紫外吸收和荧光发射的变化完全一致,证明了Sq-TPE分子的共轭结构受到破坏。当探针分子应用于对GSH和HCy的检测时,由图3中的c-f图可以看出,结果与对Cys的检测效果类似。以上结果表明,Sq-TPE探针分子可同时通过颜色变化和比率荧光响应来检测硫醇。
3.4. 检测限及Job曲线
检测限(LOD)是衡量一个探针检测性能的标准。因此,我们测试了Sq-TPE分子对硫醇的检测限。以Cys为例,根据紫外滴定图,我们取最大吸收点(714 nm)强度的变化和对应的Cys浓度作图,如图4(a)所示。在Cys的浓度在0~2 μM范围内,714 nm处的吸收强度变化几乎是成线性的(R2 = 0.9946)。根据线性拟合方程A = 0.57924 − 0.19719 [Cys] (μM)得出标准曲线的斜率k,然后根据公式3σ/k (其中σ为空白溶液的标准偏差) [22] ,计算得到Sq-TPE对Cys的最低检测限为9.8 nM。用相同的方法计算,Sq-TPE对GSH和Hcy的检测线分别为12.4 nM和9.7 nM,拟合曲线见图4(b)和图4(c)。表1给出了最近报道的一些关于硫醇检测的探针分子的检测限,相比之下,在相似测试环境下,我们的荧光探针分子Sq-TPE对硫醇检测的灵敏度更高 [23] [24] [25] 。
为了研究Sq-TPE与硫醇的相互作用,我们测定了Sq-TPE与硫醇分子作用的Job曲线。以Cys为例,Sq-TPE和Cys的总浓度固定为2 μmol/L,改变Sq-TPE与Cys的浓度比分别为0:10、1:9、2:8、3:7、4:6、5:5、6:4、7:3、8:2、9:1和10:0,然后进行紫外吸收光谱的测试,以Cys的浓度为横坐标,A0-A为纵坐标(A代表的是Sq-TPE在加入Cys时的最大吸收值(714 nm处),A0是纯Sq-TPE溶液的最大吸收值)进行作图。如图5(a),当Cys的浓度为0.5时,A0-A达到最大值。另外,实验表明Sq-TPE分子对于另外两种硫醇化合物GSH和HCy的响应情况和Cys是类似的。由此得出,Sq-TPE与几种硫醇相互作用的化学计量比均为1:1。
Figure 4. Plots of absorption intensity change of Sq-TPE (2 μM) at 714 nm against varied concentrations of GSH and Hcy from 0 to 2 μM
图4. Sq-TPE探针分子在714 nm处的吸收与不同浓度的硫醇(Cys、GSH和HCy)在0~2 μM范围内的线性拟合曲线

Table 1. A summary of recent developed fluorescent probes for Cys
表1. 近年来报道的荧光探针对Cys的检测限

Figure 5. Job’s plots for the complexation of Cys, GSH and Hcy with Sq-TPE. A0 and A represent the absorbance intensities at 714 nm in the absence and presence of GSH and Hcy, respectively
图5. Sq-TPE探针分子与硫醇(Cys、GSH和HCy)结合的Job曲线
3.5. 检测机理
方酸菁染料分子的核心结构是一个强吸电子基团,往往容易被富电子亲核试剂进攻,如硫醇、F-、CN-等。根据以往的文献报道,硫醇(Cys)应该会进攻方酸的中心环,如图6所示。Cys的引入导致整个分子的共轭断裂,从而导致分子内电荷转移作用减弱。该反应机理与加入含硫氨基酸后吸收和荧光发射的变化情况也是一致的。可以注意到,随着Cys浓度逐渐增加,在425 nm处的吸收和575 nm处的荧光发射均有所红移,如图3所示。原来的短波长的吸收(约400 nm)和荧光发射(550 nm波长)来自TPE-py单元。显然,Sq-TPE分子在形成硫醇加合物后依然具有吸电子性,而且其分子内电荷转移程度要强于TPE-py单元。因此,随着硫醇的加入,Sq-TPE-Cys组分逐渐增多,在滴定曲线上表现为一定的红移。
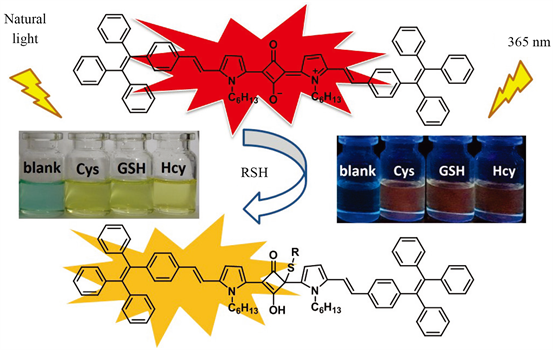
Figure 6. Structure of Sq-TPE and proposed reaction mechanism
图6. Sq-TPE探针分子的化学结构及对硫醇的检测机理
3.6. 探针分子对硫醇检测的专一性
我们继续研究了Sq-TPE探针分子对不同氨基酸的选择性。在Sq-TPE溶液(5 μmol/L)中加入50 μmol/L的各种氨基酸,包括半胱氨酸、谷胱甘肽、半胱氨酸、蛋氨酸、丙氨酸、甘氨酸、谷氨酸、精氨酸、酪氨酸、亮氨酸、脯氨酸、色氨酸、丝氨酸、苏氨酸、天冬氨酸、缬氨酸、异亮氨酸和组氨酸。从图7(a)可以看到,只有加入含巯基的氨基酸,即加入有Cys、GSH和HCy的Sq-TPE溶液的荧光发生了淬灭。相比之下,其他所有的氨基酸加入后溶液的荧光强度均无明显变化。图8更加直观,随着Cys、GSH和HCy加入,溶液的颜色有一个明显的从墨绿色到黄色的变化,这一变化是肉眼可见的。同时,在365 nm激发下,溶液的荧光也转变为橙色。结果表明,Sq-TPE探针分子对硫醇化合物具有很高的选择性。
事实上,在生物条件下进行检测不仅存在一种分析物,竞争总是存在的。因此,为了进一步探讨Sq-TPE探针的选择性,我们进行了以下测试:在Sq-TPE溶液(5 μmol/L)中加入150 μmol/L各种不同的竞争性氨基酸以及金属离子和其他一些阳离子等,包括Na+、K+、Al3+、Ca2+、Fe2+、Fe3+、Mg2+、Zn2+、H2O2和葡萄糖,然后加入50 μmol/L的Cys,接着对两种情况下在740 nm处荧光强度的变化进行比较,结果如图7(b)所示。显然,加入所有的竞争物后740 nm处的荧光强度并无太大的变化。然而,将Cys添加到混合物中,溶液的荧光随即发生淬灭。这些结果表明,Sq-TPE对硫醇具有很好的选择性,在检测过程不会受到这些竞争物的干扰。此外,我们就Sq-TPE对F−,S2−和CN−等亲核试剂的响应情况也进行了研究,排除这些常见的亲核试剂的干扰。如图9所示,F−,S2−和CN−的加入并不能改变Sq-TPE的发光,而只有在硫醇存在的情况下,Sq-TPE的荧光才会发生改变。因而进一步证明了Sq-TPE探针分子对硫醇检测的高度专一性。
4. 结论
综上所述,我们设计合成了新型方酸菁分子Sq-TPE,并研究了其对硫醇的检测情况,结果发现该荧光探针在近红外光区有着很强的吸收和荧光发射。Cys、HCy和GSH加入后,溶液颜色明显从墨绿色变为黄色,荧光发射也发生了改变。而且Sq-TPE探针分子对硫醇的检测具有高度的专一选择性,不受其他氨基酸以及阳离子等干扰物的影响。Sq-TPE探针分子对Cys、HCy和GSH检测限分别为9.8 nM、12.4 nM

Figure 7. The fluorescence intensity changes of Sq-TPE at 740 nm: (a) different amino acids; (b) other various analytes. The red bars represent fluorescence intensity of Sq-TPE in the presence of competing substances, the green bars represent the fluorescence intensity upon addition of Cys to the solutions containing Sq-TPE and competing substances
图7. Sq-TPE探针分子对不同的氨基酸的响应情况:红色条柱代表加入各种竞争物的荧光强度变化,绿色条柱代表的是加入各种竞争物后继续添加Cys的荧光强度变化

Figure 8. The photoimages of Sq-TPE upon addition of different amino acids (50 μM): (a) under natural light; (b) excited at 365 nm
图8. 向Sq-TPE溶液中加入不同氨基酸后溶液颜色的变化情况,即:(a) 自然光下;(b) 365 nm荧光灯下
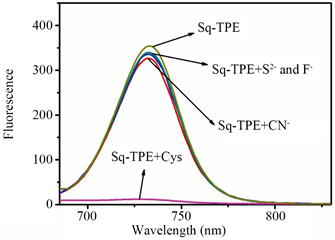
Figure 9. The responses of S2−, F−, CN− and Cys (20 μM) to Sq-TPE (20 μM) at 740 nm
图9. Sq-TPE探针分子对F−、S2−和CN−的响应情况
和9.7 nM,低于最近报道的一些关于硫醇检测的探针分子的检测限。总的来说,Sq-TPE探针分子可以作为一种近红外比率荧光探针来对硫醇包括半胱氨酸、同型半胱氨酸和谷胱甘肽进行检测,并且灵敏度和选择性都很高。
基金项目
国家自然科学基金(第51203046号)。
NOTES
*通讯作者。