1. 引言
阿霉素(简称DOX)属于蒽醌类抗生素,是广谱的抗肿瘤药物,其药理研究一直备受关注 [1] [2] [3] [4] 。目前,DOX的临床使用方法大多是静脉滴注给药,静脉滴注后DOX会迅速分布全身,毒副作用较大,如会引起骨髓抑制、心脏毒性、脱发等。同时,DOX在血液中的半衰期较短,达到病灶部位的很低,药效较差。因此,为了进一步实现DOX的低毒副作用,高生物利用度和药效,寻求一种有效的载药方法已成为研究热点。
近年来,国内外提出了一系列基于不同材料的载药体系,如纳米粒、脂质体、微乳和胶束等 [5] [6] 。其中,聚合物纳米载药体系由于具有其独特的性能而被广泛应用于聚合物载药体系的构建 [7] 。聚(甲基丙烯酸甲酯-共-甲基丙烯酸(简称:PMMA-co-MAA),作为一种嵌段共聚物,在水溶液中能够自组装形成“外亲水,内疏水”的核–壳状纳米胶束结构 [8] 。基于此,本文以自身具有荧光性质的DOX为研究对象,利用共沉淀–自组装法成功制备出PMMA-co-MAA包裹DOX的纳米载药体系(简称:DOX@PMMA-co-MAA)。该纳米胶束载药体系具有优良的光学性质、高生物适应性、良好的水分散性和光学稳定性等,有望实现在中药制剂和生物医药领域的潜在应用。
2. 实验部分
2.1. 仪器与试剂
紫外–可见分光光度计(UV-2700型,日本岛津公司);荧光分光光度计(RF-5301PC型,岛津企业管理有限公司);电子天平(万分之一,MS204S型,瑞士Mettler Toledo公司);微量高速离心机(TG-16W型,长沙湘仪);上海雷磁公司pH-25型pH计;超声仪(SK3310HP型,上海科导超声仪器有限公司);离心机(lx-800型,海门其林贝尔仪器制造有限公司);纳米粒径电位分析仪(Nano-ZS90型,英国Malvern公司);扫描电子显微镜(JSM-6700F);Mili-Q超纯水机(LX2-XSJCCSXT型,美国密理博公司)。
共聚物PMMA-co-MAA(分子量为34,000,PMMA和MAA的摩尔比为1:0.016)购自希恩思生化科技有限公司(天津,中国);阿霉素(DOX)购自Sigma-Aldrich公司;磷酸二氢钠(NaH2PO4),磷酸氢二钠(Na2HPO4)购自阿拉丁公司;其余试剂均为分析纯;实验所用均为超纯水(18.2 MD)。
2.2. DOX@PMMA-co-MAA纳米载药体系的制备及表征
2.2.1. 共沉淀–自组装法制备纳米胶束
共沉淀–自组装法的具体操作步骤如下:分别量取1 mL 0.1 mM阿霉素溶液和2.0 mg PMMA-co-MAA,在室温搅拌下,将两者逐个加入到9 mL水中,继续搅拌混合液10 min,即可得到浅黄色溶胶溶液。在35℃下旋转蒸发以除去丙酮,然后在6000 r/min转速下离心15 min,弃去上清液,冷冻干燥得到固体,4℃条件下保存备用。
2.2.2. 纳米载药体系的表征
通过SEM、DLS、zeta电位等对纳米胶束进行表征。具体操作过程如下:精密量取PMMA-co-MAA和DOX@PMMA-co-MAA水溶液1mL,在室温条件下测定其粒径和电位。同时,取适量用于SEM表征。
2.3. DOX@PMMA-co-MAA纳米载药体系的光学性能考察
2.3.1. 实验条件优化
首先,PMMA-co-MAA浓度:取不同量的PMMA-co-MAA加入到含有DOX的水溶液中(浓度范围0~300 μg/mL),制备纳米胶束,室温下测定光谱。其次,温度的优化:在不同温度条件下(分别为20℃,22℃,25℃,30℃,32℃,35℃),取适量纳米胶束溶液测定光谱。最后,pH的优化:配制不同pH范围的20 mM PBS缓冲溶液(6.0, 6.5, 7.0, 7.4, 8.0, 8.5),按上述优化好的浓度和温度条件,测定荧光光谱。
2.3.2. 光学稳定性考察
在最佳反应条件下,将一定量的DOX@PMMA-co-MAA纳米胶束溶液加入到400 μL反应缓冲液(pH 7.4, 20 mM PBS)或血清中,25℃测定荧光光谱。
2.3.3. 细胞成像研究
对于细胞成像实验,HeLa细胞接种到培养皿中,过夜培养细胞至约90%时,用PBS冲洗3次。然后将1 mL含有DOX@PMMA-co-MAA纳米探针的细胞培基溶液加入到每个培养皿中,37℃孵育2 h。用PBS洗涤3次,通过激光共聚焦成像系统进行活细胞成像。
3. 结果与讨论
3.1. 设计原理
本论文利用共沉淀–自组装法将DOX包裹在共聚物PMMA-co-MAA中,形成水溶性较好的DOX@PMMA-co-MAA纳米载药体系。该体系可以明显提高DOX的生物相容性,降低其毒副作用。具体设计机理如图1所示:DOX是一种疏水性药物,将其溶解在良溶剂丙酮中,然后将其加入到PMMA-co-MAA的水溶液中(此处水为DOX的不良溶剂),随着丙酮溶剂的扩散,DEAS所处微环境的改变,使得DOX在较短时间内进入PMMA-co-MAA胶束的疏水空腔中聚集成核,进而晶核生长成纳米颗粒。这样,DOX和PMMA-co-MAA通过共沉淀–自组装法形成纳米载药体系。
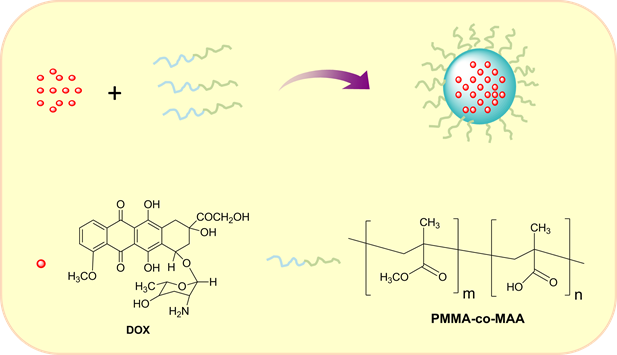
Figure 1. Schematic representation of the DOX@PMMA-co-MAA nano-drug system formation by coprecipitation and self-assembled method
图1. 利用共沉淀–自组装法形成DOX@PMMA-co-MAA纳米载药体系的示意图
3.2. 纳米载药体系的表征
本实验采用DLS和zeta电位对所制备的DOX@PMMA-co-MAA纳米载药体系进行表征,如图2所示,纳米胶束是一种粒径在50 nm左右的球形颗粒,DLS测得水合半径约为77 nm。这两种方法测定结果不一致的主要原因是样品中大颗粒的光散射比较强所造成的。DEAS@PMMA-co-MAA纳米胶束的表面电位为−45.7 mV,负电荷主要来源于纳米颗粒表面的羧基离子化。这些数据进一步表明,DEAS@PMMA-co-MAA纳米颗粒的形成,以及在水溶液中具有很好的分散性和稳定性。
3.3. 实验条件的优化和稳定性考察
为了考察纳米胶束的荧光性能,本论文考察了不同浓度的PMMA-co-MAA对DOX荧光强度的影响,如图3所示,DOX的最大发射峰位在560 nm左右。随着PMMA-co-MAA浓度的增加,DOX的荧光强度逐渐增强,当PMMA-co-MA浓度达到100 µg/mL时,荧光强度达到最强(即两者的浓度比最佳,胶束溶液达到平衡,即使继续增加至300 µg/mL,对其荧光增强效果也不明显),故选用100 µg/mL作为最佳浓度。结果表明,纳米胶束的形成为DOX提供一个封闭环境,减少DOX的扭曲分子内电荷转移过程(TICT),减少非辐射跃迁的能量损失,大大提高了其荧光强度。
纳米载药体系的稳定性是在复杂体系中生物应用的基础,首先,考察了温度、pH、缓冲液和血清对探针荧光强度的影响。如图4A,图4B所示,温度在25℃~35℃范围内,荧光强度较稳定;同时,在生理pH范围内(6.0~8.5)其荧光强度也较稳定。其次,进一步考察了探针在缓冲液(pH 7.4)和血清中的稳定性,如图5所示,每间隔一段时间测定一次样品,通过对纳米胶束和游离DOX荧光强度的测定,发现在缓冲液(pH 7.4)和血清中,DOX在一定时间范围内荧光强度明显降低,而DOX@PMMA-co-MAA纳米胶束的荧光强度没有随时间的延长而降低。因此,实验结果均表明纳米胶束在不同反应体系中具有较高的光学稳定性,为后续复杂生物样品中的实际应用提供了保障。
3.4. 细胞成像研究
由上述实验可知,DOX@PMMA-co-MAA纳米胶束具有良好的生物相容性,因此,本实验在此基础上考察了该纳米胶束在细胞内的分布情况。如图6所示,DOX@PMMA-co-MAA纳米胶束与细胞孵育3 h,通过荧光共聚焦成像图可观察到纳米胶束均匀分布在细胞内,且具有较强的蓝色荧光。实验数据表明PMMA-co-MAA对染料分子的屏蔽和保护作用,降低了染料的非辐射跃迁造成的部分能量损失,使得荧光强度显著增强。

Figure 2. The SEM (A), DLS (B) and zeta potential (C) of the nano-drug loading system
图2. 纳米载药胶束的SEM (A),DLS (B)和zeta电位(C)表征
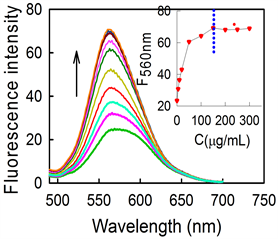
Figure 3. Fluorescence emission spectrum of DOX in the presence of different concentrations of PMMA-co-MAA (0, 5, 10, 20, 50, 100, 150, 200, 250 and 300 μg/mL, bottom to top)
图3. 不同浓度PMMA-co-MAA对DOX荧光强度的影响;(从下到上,浓度依次为:0,5,10,20,50,100,150,200,250,300 μg/mL)

Figure 4. The stability of DOX@PMMA-co-MAA nano-drug system at different temperature (A) and pH (B)
图4. (A)温度和(B)pH对DOX@PMMA-co-MAA纳米载药胶束的荧光稳定性考察
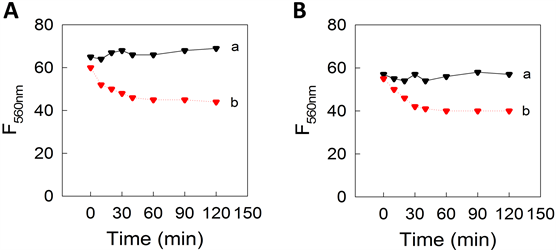
Figure 5. The stability of DOX@PMMA-co-MAA (a) and DOX (b) in buffer (A) and serum (B)
图5. DOX@PMMA-co-MAA(a)和DOX (b)在缓冲体系(A)和血清中(B)的荧光稳定性考察
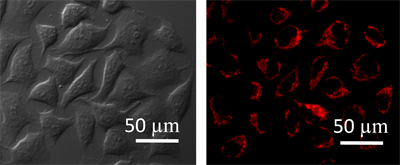
Figure 6. Confocal FL microscopy images of HeLa cells incubated with DOX@PMMA-co-MAA nanomicelle
图6. DOX@PMMA-co-MAA纳米胶束的细胞成像研究
4. 结论
本论文构建了一种基于共沉淀–自组装法构建DOX@PMMA-co-MAA荧光纳米载药体系,通过嵌段共聚物PMMA-co-MAA对疏水性药物DOX的包裹,改善了其荧光强度和光学稳定性,降低其毒副作用,提高生物利用度。同时实现了在细胞水平上的荧光成像研究。在此基础上,本实验可以进一步将带氨基的靶向基团(核酸适配体,RGD多肽和抗体等)通过酰胺反应与纳米胶束表面的带羧基共价结合,形成靶向纳米载药胶束,实现对靶细胞的特异性结合和特定部位的荧光成像研究。因此,该纳米载药体系的构建为进一步实现在生物医药领域提供强有力的实验基础。同时,在医药领域、生化分析、肿瘤治疗等方面的存在潜在的应用前景。
基金项目
本研究由国家级大学生创新训练项目(批准号:201610472034),国家级大学生创新训练项目(批准号:201610472068),国家自然科学基金(批准号:21605127),化学生物传感与计量学国家重点实验室(湖南大学)开放课题(批准号:2015018)和新乡医学院博士科研启动基金支持。
NOTES
*通讯作者。