1. 引言
许多研究表明糖尿病患者发生骨质疏松的风险明显高于非糖尿病患者,流行病学调查资料显示糖尿病患者骨质疏松的发病率为40%~60% [1] ,其发病机制尚未完全阐明,且存在许多争议。
骨髓间充质干细胞(Bone Marrow Mesenchymal Stem Cells,BMSCs)是目前研究较多的成体干细胞之一,在适宜的诱导下具有向骨、软骨、脂肪、神经等多向分化潜能 [2] [3] 。BMSCs是成骨细胞和脂肪细胞的前体干细胞,其分化去向在骨平衡中扮演了重要角色,其中成骨与成脂分化的调控是当前研究的热点 [4] 。研究发现BMSCs向成骨分化减少、成脂分化增多是骨质疏松症发病的重要机制 [5] [6] 。抑制BMSCs 成脂分化、促进成骨分化从而纠正骨代谢失衡是治疗骨质疏松症的方向之一 [7] [8] [9] 。
本实验通过采用高糖高脂饮食加小剂量链脲佐菌素的方法建立2型糖尿病模型,观察不同时间段糖尿病模型大鼠BMSCs成骨和成脂分化情况,旨在研究糖尿病模型大鼠骨质疏松的形成与BMSCs成骨及成脂分化能力的相关性。
2. 材料与方法
2.1. 实验材料
2.1.1. 实验动物
SPF级健康雄性SD大鼠,体质量(180~220) g,20只。由广东省医学实验动物中心提供,许可证号:SCXK(粤)2013-0002。实验过程中对动物的处置符合动物伦理学标准。
2.1.2. 主要药品与试剂
DMEM培养基(GIBCO)、胎牛血清(GIBCO)、成骨诱导液、成脂诱导液、油红O (MBCHEM)、碱性磷酸酶(ALP)测定试剂盒(南京建成生物工程研究所)、茜素红S (MBCHEM)、cDNA试剂盒(Fermentas公司)、Trizol Reagent (Invitrogen公司)、TaqDNA聚合酶(上海申能博彩生物科技有限公司)、引物(上海生工生物工程技术服务有限公司),等。
2.1.3. 仪器
核酸蛋白测定仪(Eppendorf)、多功能PCR扩增仪(Thermo Hybaid, PXII)、电泳系统(BIO-RAD, Mini-Sub Cell)、凝胶成像及分析系统(BIO-RAD, GelDoc)、UV-7504型单光束紫外可见分光光度计(上海欣茂仪器有限公司)。
2.2. 实验方法
2.2.1. 糖尿病大鼠模型的制备
高糖高脂饲料喂养大鼠四周,35 mg/kg腹腔注射链 STZ,3 d后剪尾静脉测血糖,以>16.67 mmol/L视为糖尿病模型成功,腹腔注射后3周复测1次尾静脉血糖和体重,以确保血糖浓度>16.67 mmol/L。
2.2.2. BMSCs分离培养
分别于注射STZ液 4、8、12周后,取糖尿病组大鼠及对照组大鼠,10%水合氯醛0.3 mL/l00g体质量腹腔注射麻醉,摘除双侧后肢,浸泡在75%乙醇中5 min,再用无菌生理盐水冲洗至无乙醇,置于无菌培养皿上,剥除股骨、胫骨表面附着的肌肉等组织,无菌PBS反复冲洗。剪断胫、股骨的骨骺端,5 mL一次性注射器吸取DMEM完全培养液(含10%胎牛血清、青霉素100 U/mL及链霉素100 µg/mL)充分冲洗骨髓腔,至骨髓腔变白为止。原代BMSCs培养24 h后进行首次换液,PBS清洗3次,以去除未贴壁的细胞。以后每3 d换液1次。当细胞接近80%铺满瓶底后,以2.0 × 105个/mL细胞的密度接种于培养瓶中进行扩增培养。
2.2.3. BMSCs的成骨分化
取对数生长期的P3-P6细胞以2 × 105个/mL接种于6孔板内,每孔接种1 mL,72 h后,用成骨细胞诱导液(含10−7 mol/L地塞米松、10 mmol/L β-甘油磷酸钠、0.05 mmol/L左旋抗坏血酸)添加5%空白血清培养。每周换液2次,培养7 d后,检测ALP活力。14 d后,进行茜素红染色及RT-PCR法检测ALP和OC mRNA含量。
2.2.4. ALP活力检测 [10]
培养7 d后,用PBS将细胞洗涤3遍,加入细胞裂解液4℃放置,细胞超声破碎仪处理1 min后转至1.5 mL离心管中,于10,000 rpm离心5 min (4℃)。收集上清液,取5 μL加于测定管内,按照ALP试剂盒说明,标准管加入5 μL酚标准应用液,空白管加入双蒸水5 μL,各管加入缓冲液50 μL和基质液50 μL,充分混匀,37℃水浴15 min,加入显色剂150 μL,立即混匀,选择520 nm波长,空白管调零,以紫外分光光度计比色,测各管吸光度值(OD值)。根据下列公式计算ALP活力,计算公式:
ALP活力 = (OD测定管 ÷ OD标准管) × 0.003mg ÷ 取样量中蛋白克数
单位定义:每克组织蛋白在37℃与基质作用15 min产生1 mg酚为1单位(U);0.003 mg为标准管含酚的量。根据分光光度计检测得到样品的OD值(检测波长为520 nm),利用上述公式计算得出待检样品中ALP的活力(U/gprot)。
2.2.5. 茜素红染色
吸弃培养液,PBS洗3遍。95%酒精固定5 min。加2%茜素红溶液染色5 min,PBS冲洗3遍。倒置相差显微镜下观察,拍照。
2.2.6. RT-PCR 法检测ALP和OC mRNA含量
引物序列和反应条件见表1。PCR产物10 μL,在1.5%琼脂糖凝胶上电泳1 h,电压80 V,BIO-RAD凝胶成像及分析系统观察并拍照。分别以β-actin为参考基因,行半定量分析。引物设计用primer 6.0软件设计,由上海生工生物工程技术服务有限公司合成。
实验重复3次。
2.2.7. BMSCs的成脂分化
取对数生长期的P3-P6细胞以2 × 105个/mL接种于6孔板内,每孔接种1 mL,72 h后,用成脂细胞诱导液(含1 μmol/L地塞米松、0.01 mg/mL胰岛素、200 μmol/L吲哚美辛、0.5 mmol/L异丁基甲基黄嘌呤)添加5%空白血清培养。每周换液2次。14 d后,进行油红O染色及RT-PCR法检测LPL和PPARγ2 mRNA含量。
2.2.8. 油红O染色
称取0.5 g油红,加异丙醇至100 mL,作为储存液。吸弃诱导液,PBS洗3遍。95%酒精固定5 min。稀释油红储存液,按油红液/去离子水以3:2稀释,针孔滤器过滤,室温放置10 min。每孔加入l mL染液,染色10 min。用PBS洗3遍,去除残留的染色液和残渣。
1) 脂肪细胞转化率

Table 1. Primer sequences of β-actin, ALP and OC
表1. β-actin, ALP, OC引物序列
倒置相差显微镜下随机取8个非重叠视野,高倍镜下计数阳性细胞和总细胞数,计算每个视野中脂肪细胞阳性率数值即脂肪细胞转化率。
2) 油红O染色定量分析
彻底移去油红O,用清水洗4次。去除剩余的水,风干。用100%异丙醇冲洗油红O,作用10 min。用移液枪吹打几次,使油红O充分溶解于异丙醇中。将其移到1.5 mL EP管中,用100%异丙醇作为空白对照。根据分光光度计检测得到样品的OD值(检测波长为450 nm),采用5 mm的比色杯,以空白管调零。
2.2.9. RT-PCR 检测LPL和PPARγ2 mRNA含量
引物序列和反应条件见表2。PCR 产物10 μL,在1.5%琼脂糖凝胶上电泳1 h,电压80 V,BIO-RAD凝胶成像及分析系统观察并拍照。分别以β-actin为参考基因,行半定量分析。
实验重复3次。
2.3. 数据处理
实验数据以均数±标准差(
± s)表示,用SPSS 19.0统计软件进行处理。比较使用单因素方差分析,组间两两比较采用LSD法。P < 0.05为差异有统计学意义。
3. 结果
3.1. 成骨诱导细胞形态的变化
对照组细胞随着诱导时间的增加,细胞聚集成多个散在的细胞结节,逐渐形成多层结构,并产生大量分泌颗粒,将结节包埋,结节中心部逐渐变浓,直至形成不透光致密团状结构,糖尿病组细胞形态变化与对照组相似,但细胞结节明显少。
图1(a):对照组细胞经诱导后聚集生长,并逐渐形成多个散在的细胞结节,排列紧密,逐渐形成多层结构。
图1(b):糖尿病组细胞经诱导后,形态变化与对照组相似,但结节明显少于对照组。
3.2. ALP活力检测
成骨诱导后,ALP活力明显增加,对照组ALP活力明显高于糖尿病组,差异有统计学意义(P < 0.01)。见表3。
3.3. 茜素红染色
成骨诱导第14 d,茜素红染色结果表明,对照组钙化结节数量明显高于糖尿病组,见图2(a)、图2(b)。
图2(a):对照组成骨诱导液培养14 d后,茜素红染色可见多个散在的红色致密结节。
图2(b):糖尿病组,茜素红染色阳性,钙化结节数明显少于对照组。

Table 2. Primer sequences of LPL, PPARγ2 and β-actin
表2. LPL, PPARγ2, β-actin引物序列
 (a)
(a)  (b)
(b)
Figure 1. (a) Cells of control group (×100); (b) Cells of diabetes group (×100)
图1. (a) 对照组细胞(×100);(b) 糖尿病组细胞(×100)

Table 3. ALP activity detection (unit: U/gprot, n = 3, x ¯ ± s)
表3. 各组ALP活力检测(单位:U/gprot, n = 3,
± s)
与对照组比较,**P < 0.01。
 (a)
(a) 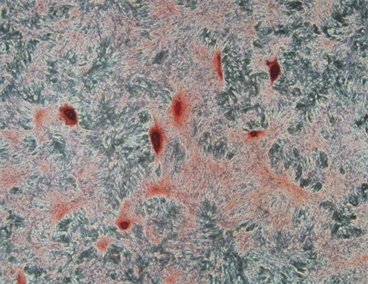 (b)
(b)
Figure 2. (a) Control group (×40); (b) Diabetes group (×40)
图2. (a) 对照组(×40);(b) 糖尿病组(×40)
3.4. RT-PCR法检测ALP和OC mRNA含量
对照组、糖尿病组均有表达ALP、OC基因。β-actin的表达则较为一致。以β-actin为内参,进行OD值的比较半定量分析,对照组ALP、OC基因的表达明显增强,与糖尿病组比较,差异有统计学意义(P < 0.01, P < 0.05)。见图3。

 与对照组比较,*P < 0.05,**P < 0.01。
与对照组比较,*P < 0.05,**P < 0.01。
Figure 3. Expression of ALP and OC genes
图3. 成骨分化标志物ALP、OC基因的表达
3.5. 成脂诱导细胞形态的变化
成脂诱导2 d后,即有小脂滴出现,脂滴主要集中于细胞核周围,随诱导时间的延长,小脂滴逐渐聚集成大的脂泡,细胞逐渐增大,由原来的梭形变为圆形、椭圆形或多角形,细胞增殖不明显。糖尿病组含脂滴的细胞明显多于对照组,见图4(a)、图4(b)。
图4(a):诱导7d后,对照出现大量的脂肪细胞。
图4(b):糖尿病组脂肪细胞明显多于对照组。
3.6. 脂肪细胞转化率
培养第14 d后,进行油红O染色,对照组、糖尿病组镜下观察可见脂滴为红色,脂肪细胞中含大小不等的脂肪滴,细胞核被脂滴挤于细胞一侧(见图5(a)、图5(b))。随机取8个非重叠视野计算细胞总数及脂肪细胞数,脂肪细胞数占细胞总数的百分比即脂肪细胞转化率。对照组脂肪细胞转化率明显低于糖尿病组,差异有统计学意义(P < 0.05),见表4。
图5(a):对照组成脂诱导14 d后油红O染色,可见大量的红色脂滴。
图5(b):糖尿病组14 d后油红O染色,可见有红色脂滴形成,数量明显多于对照组。
3.7. 油红O染色定量分析
油红O染色定量分析结果见表5,对照组与糖尿病组比较,差异有统计学意义(P < 0.01)。
3.8. RT-PCR 检测LPL和PPARγ2 mRNA含量
对照组、糖尿病组均有表达LPL、PPARγ2基因。β-actin的表达则较为一致。以β-actin为内参,进行OD值的比较半定量分析,糖尿病组LPL、PPARγ2基因的表达明显增强,与对照组比较,差异有统计学意义(P < 0.01, P < 0.01)。见图6。
4. 讨论
虽然骨质疏松症和糖尿病通常被认为是2个独立的疾病,但目前有许多研究表明糖尿病患者发生骨质疏松的风险明显高于非糖尿病患者 [11] ,糖尿病合并骨质疏松症的发病机制尚不清楚,这给临床治疗带来了极大难题 [12] 。本实验通过建立糖尿病骨质疏松大鼠模型 [13] [14] ,观察不同时间段糖尿病模型大鼠
 (a)
(a)  (b)
(b)
Figure 4. (a) Control group (×100); (b) Diabetes group (×100)
图4. (a) 对照组(×100);(b) 糖尿病组(×100)
 (a)
(a)  (b)
(b)
Figure 5. (a) Control group (×100); (b) Diabetes group (×100)
图5. (a) 对照组(×100);(b) 糖尿病组(×100)

Table 4. Conversion rate of adipocytes (%, n = 8, x ¯ ± s)
表4. 脂肪细胞转化率(%, n = 8,
± s)
与对照组比较,**P < 0.01。

Table 5. Quantitative analysis of oil red O staining (OD value, n = 8, x ¯ ± s)
表5. 油红O染色定量分析(OD值, n = 8,
± s)
与对照组比较,**P < 0.01。

 与对照组比较,**P < 0.01。
与对照组比较,**P < 0.01。
Figure 6. Expression of LPL and PPARγ2 genes
图6. 成脂分化标志物LPL、PPARγ2基因的表达
BMSCs成骨和成脂分化情况,旨在研究糖尿病模型大鼠骨质疏松的形成与BMSCs成骨及成脂分化能力的相关性,为糖尿病骨质疏松发病机制提供依据。
实验结果显示,注射STZ液4周以后,糖尿病组大鼠BMSCs成脂分化能力增强,体现为脂肪细胞转化率、油红O染色定量明显高于对照组。成脂分化标志物LPL、PPARγ2基因相对OD值明显高于对照组。8周以后,糖尿病大鼠BMSCs的成骨分化能力明显下降,体现为糖尿病组大鼠BMSCs ALP活力明显下降,钙化结节数量明显少于对照组。成骨分化标志物ALP、OC基因明显相对低于对照组。
在骨质疏松症患者中,骨髓间充质干细胞向脂肪方向分化增多,向成骨方向分化减少,其分化命运受多条信号通路调控,并涉及转录调控、转录后调控和表观遗传等多种调控机制,是目前研究的热点与焦点。糖尿病性骨质疏松的发生源于糖尿病状态下骨代谢的改变。间充质干细胞作为成骨细胞、脂肪细胞等的来源细胞,其数量、功能活性以及成骨成脂之间的平衡是成骨质量的关键。近年来多项研究表明,糖尿病相关的细胞因子、生长因子、信号通路在间充质干细胞的分化过程中发挥着重要的调控作用,共同导致糖尿病性骨质疏松的发生。多种糖尿病相关因素通过调控间充质干细胞的成骨成脂分化,从而对糖尿病的骨代谢过程产生影响 [15] 。
然而,目前对糖尿病患者骨髓间充质干细胞的变化及其在骨质疏松发生中的作用研究较少,其具体分子机制尚不清楚,需进一步的研究与探讨。本实验结果显示糖尿病大鼠BMSCs成脂分化能力增强,成骨分化能力明显下降,可能与糖尿病骨质疏松的形成有一定的关系 [16] 。
基金项目
广东省科技计划项目(2015A030302068):链脲佐菌素诱导糖尿病大鼠骨质疏松发生机制的研究。