1. 引言
水环境中的重金属及其化合物是持久性有机污染物,在我国首个“十二五”专项规划中明确提出防治、规划及控制以下5种重金属:铅、砷、镉、汞和铬。水生动物可以通过呼吸、摄食、体表与水体的渗透交换富集水体重金属 [1]。摇蚊幼虫是淡水生态系统中最常见的底栖动物,约为底栖生物总量的70%~80% [2] [3] ,在激流和静水的底栖生物群落环境中占主导地位 [4]。因此,摇蚊幼虫是水生态毒理实验重要的研究对象,是监测河流和湖泊水质的重要指示生物之一 [5] [6] ,有助于对水体重金属污染做出快速反应。其中,花翅摇蚊(Chironomus kiiensis)幼虫是研究应对不同曝光时间层次的重金属污染的好材料 [7]。
两种不同重金属之间对摇蚊幼虫的联合毒性存在协同作用和拮抗作用。其中,重金属间的协同作用在很多研究中均有发现,但不同重金属间的协同机理也有所不同 [8] - [13]。例如,低浓度的Mn2+对Cu2+、Cd2+和Zn2+表现为拮抗作用,然而,高浓度的Mn2+对Cu2+、Cd2+和Zn2+表现为协同作用 [14] ,Mn2+在与生物大分子相结合时,会和其他的一些金属离子发生竞争性抑制作用,这使得其间的联合作用表现为随浓度的变化而不断变化 [15]。类似的结果也可以在吕耀平 [16] 等对Mn7+和Hg2+对青虾的联合毒性作用研究中发现。
许多研究表明,重金属可以诱导摇蚊口器畸变。闫宾萍等 [17] 研究了Ni2+、Hg2+和五氯酚对羽摇蚊幼虫(Chironomus plumosus)的毒性作用和生物浓缩,其研究结果显示,镍、汞和五氯酚都会使羽摇蚊幼虫的口器产生不同程度的畸变。李浩等 [18] 通过对口器和抗氧化酶活性变化的观察,对Cu2+对羽摇蚊幼虫的毒性作用进行了分析,研究结果表明,致畸率与Cu2+的暴露浓度之间呈正相关关系(P < 0.05),其结果对将羽摇蚊幼虫应用于监测水环境污染中发挥一定作用。
抗氧化酶系是经常用于水环境污染监测中的生物标志物之一。抗氧化酶系包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)等。为研究抗氧化酶在水污染监测方面的作用,国内展开了多种不同的污染物与水生生物的抗氧化酶活性之间关系的探究。2009年,王涛在萘和镉单一毒性的研究基础上,分别研究萘和镉的联合毒性对大型海藻孔石莼和斑马鱼的SOD和CAT活力的影响 [19]。李莹 [20] 通过SOD,CAT酶活性以及丙二醛含量的明显变化来判断化合物对生物体的抗氧化防御系统产生了一定的氧化损伤,从而表明多氯代联苯醚具有潜在的生物毒性。
有研究表明,重金属及其化合物可以影响摇蚊幼虫的生长发育。其中,Cd2+可以影响羽摇蚊幼虫的体长及羽化时间 [12]。Wentsel等 [21] 研究发现,摇蚊幼虫暴露在重金属下不会造成其羽化后性比的改变,但是会使得羽化所需的时间延长,并且重金属的暴露会降低其羽化率。
本研究以摇蚊的优势种花翅摇蚊为受试生物,测定了汞和镉对花翅摇蚊幼虫进行联合毒性、SOD活性及CAT活性测定,明确水体中重金属污染物(汞和镉)与抗氧化酶活性之间的关系,对进一步了解重金属污染物的生态毒性和对抗氧化酶催化机理的研究具有重要的意义。同时,通过研究汞和镉对花翅摇蚊幼虫口器形态、体重和化蛹率的影响,进一步了解汞和镉对花翅摇蚊幼虫的形态、生长发育的影响,以期为水体污染的早期预警提供更全面的监测指标,为水污染生态风险评价以及环境监测和治理提供更加全面的理论依据。
2. 材料与方法
2.1. 材料
供试花翅摇蚊(Chironomus kiiensis)初始种群来源于中国农业大学昆虫生理与毒理实验室,于室内用暴晒除氯3 d以上的自来水进行饲养,放置于玻璃鱼缸中,每4 d换水一次,每日投喂1~3 g金鱼幼虫饲料(饲料成分:进口鱼粉、南极虾粉、植物蛋白、维生素、矿物质以及氨基酸),采用50目纱网罩住玻璃鱼缸以防止成虫飞出,自然光照饲养。
2.2. 方法
2.2.1. 确定慢性毒性安全浓度
参照《化学品沉积物–水系统中摇蚊毒性实验加标于沉积物法》 [22] 进行暴露。用人工介质M4配制实验溶液,分别设置Hg2+和Cd2+的6个质量浓度组,浓度为1.0、1.4、1.8、2.2、2.6和3.0 mg∙L−1。每组设置三个平行试验,并且设置空白对照组。实验期间给摇蚊幼虫投喂金鱼幼虫饲料,水环境pH值为6.0 ± 0.5,水温为(17.0 ± 1.0)℃,t(光):t(暗) = 16 h:8 h。观察每个实验组摇蚊幼虫的存活状况,并且及时用毛笔刷挑出已经死亡的个体,计算出死亡率。摇蚊幼虫死亡判定标准为:用玻璃棒轻压幼虫尾部3次后,观察其无“8”字扭动的运动现象。用线性回归法 [23] 计算暴露24 h时重金属对花翅摇蚊幼虫的半数有效浓度(ρ(24 h, EC50))。根据安全浓度(ρS)计算公式ρS =ρ(24 h, EC50) × 0.1 [24] 和急性毒性实验的半数有效浓度(EC50),进而确定慢性毒性试验中重金属的安全浓度。
2.2.2. 制毒处理
参照花翅摇蚊幼虫的ρ(24 h, EC50)值,在慢性毒性试验中,将HgCl2和CdCl2按照1:1毒性配比配制成0.002、0.004、0.008、0.016、0.032、0.064、0.128和0.256 mg∙L−1的附水沉积物 [22]。每个浓度设3个平行组,随机挑取5条花翅摇蚊的卵带放入附水沉积物中,含有等量不添加HgCl2和CdCl2的附水沉积物作为对照,在适宜条件下培养40 d。实验期间不投饵以水环境中的沉积物为食物来源,且用空气泵充气以保证水环境内氧气充足。
2.2.3. 筛查致畸情况
选取大小相近的活泼4龄幼虫,用沸水烫死,剥离幼虫头部制片,在Motic BA410显微镜下,利用Motic Images Plus 2.0成像系统采集照片。
2.2.4. 测定抗氧化酶活性
1) 组织样本制备
依次从不同浓度处理组中随机挑取10头花翅摇蚊4龄幼虫,滤纸吸取其表面水分后称重,快速放入5 ml玻璃匀浆器内,按重量(g):体积(ml) = 1:9的比例加入其9倍体积的生理盐水,并在冰水浴条件下,用玻璃匀浆器充分研磨,在2500 r/min下离心15 min,取其上清液,加入生理盐水稀释成浓度为1%的组织匀浆后待测。
2) 测定蛋白浓度
按照蛋白定量测试盒(A045-2)说明书加入试剂,混匀后静置10 min,于595 nm波长处,1 cm光径,用双蒸水调零,测定各管分光光度(OD)值,根据计算公式得出各浓度的蛋白浓度。
3) 测定抗氧化酶
分别按照SOD试剂盒(测总)和CAT可见光试剂盒的说明书加入试剂,混匀,在室温下静置10 min后,用双蒸水调零,于不同波长处测得其OD值,根据计算公式得出各浓度SOD和CAT活性。
2.2.5. 生长发育
以花翅摇蚊幼虫的ρ(24 h, EC50)值为基准,将HgCl2和CdCl2的混合母液用营养液 [22] 分别配制成0.004、0.016、0.064和0.256 mg∙L−1 4个亚致死浓度,以营养液 [22] 为空白对照,选取长度和颜色均一致的健壮花翅摇蚊4龄幼虫,将其放入盛有500 ml溶液的冰盘(20 cm × 15 cm)中,使溶液温度保持在16.0℃ ± 1.0℃,每次处理100头,每个浓度设5个重复组。从中随机选取三个重复组用于观察幼虫的化蛹率,每隔24 h统计一次幼虫化蛹的个数,直至冰盘中的幼虫全部死亡或化蛹为止。其余的重复组用于测定其干湿重,在处理48 h后,每个浓度随机挑取60头幼虫后分成三组。用蒸馏水润洗两次洗去幼虫表面杂质,再用滤纸吸干体表水分,立即称量其湿重,然后将其放入50℃烘箱内烘4 h,再升温至120℃,在该条件下烘至恒重后称量干重。干湿重均用相对干湿重表示。
相对干(湿)重 = [处理组干(湿)重/对照组干(湿)重]。
2.2.6. 数据分析
采用SPSS16.0统计软件对各组间各指标作单因素方差分析(ANOVA),采用t检验法分析各浓度组与对照组间的差异显著性。所有数据处理和作图均采用SPSS16.0统计软件和Excel软件。
3. 结果
3.1. 汞和镉的联合毒性
通过Hg2+和Cd2+ 24 h的EC50,运用相加指数法计算出Hg2+和Cd2+的毒性单位之和M
(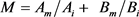 ,其中,Am和Bm是指24 h的EC50(混)中Hg2+、Cd2+之浓度,Ai是24 h的
,其中,Am和Bm是指24 h的EC50(混)中Hg2+、Cd2+之浓度,Ai是24 h的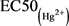 ,Bi是24 h的
,Bi是24 h的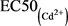 ,将其绘制图表,由图1可知M < 1,Hg2+和Cd2+对花翅摇蚊幼虫的联合毒性作用属于协同作用。
,将其绘制图表,由图1可知M < 1,Hg2+和Cd2+对花翅摇蚊幼虫的联合毒性作用属于协同作用。
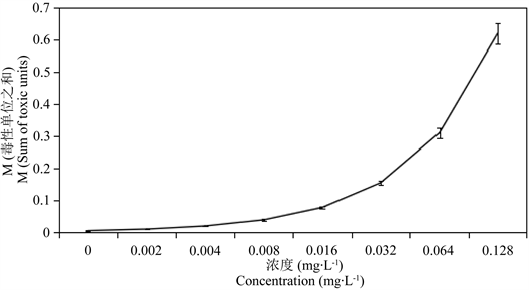
Figure 1. Sum of toxic units of Hg2+ and Cd2+ on CAT activity in tissues of larval Chironomus kiinensis
图1. Hg2+和Cd2+对花翅摇蚊幼虫的毒性单位之和
3.2. Hg2+-Cd2+胁迫对花翅摇蚊幼虫口器畸变的影响
经不同浓度Hg2+-Cd2+暴露后,通过显微镜观察发现花翅摇蚊幼虫颏部发生畸变,在0.002 mg∙L−1处理组其颏部的中间齿部分缺失(图2(a),箭头所指位置),从0.004 mg∙L−1处理组开始,摇蚊幼虫颏部出现侧面齿部分缺失现象(图2(b),箭头所指位置)。每50头幼虫中有43头发生畸变。另外,经过观察比较,发现花翅摇蚊幼虫的口器畸变类型与暴露浓度无关。

Figure 2. The mandibles of exposed to Hg2+-Cd2+ of larval Chironomus kiinensis(200×)
图2. 汞和镉联合作用下花翅摇蚊幼虫颏部(200×)
3.3. Hg2+-Cd2+胁迫对花翅摇蚊幼虫抗氧化酶活性的影响
3.3.1. 不同浓度Hg2+-Cd2+对花翅摇蚊幼虫体组织中SOD活性的影响
由图3可知,在两种重金属的协同作用下,花翅摇蚊幼虫体内的SOD活性随浓度的升高而逐渐升高,在0.016 mg∙L−1组活性最强,随后SOD活性随浓度的升高而逐渐下降,差异性显著(P < 0.05),在0.128 mg∙L−1组和0.256 mg∙L−1组的SOD活性低于对照组。
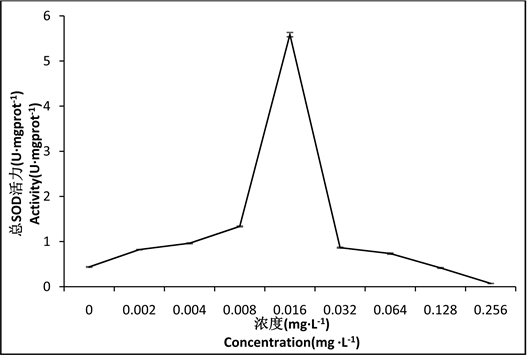
Figure 3. Effect of Hg2+-Cd2+ on SOD activity in tissues of larval Chironomus kiinensis
图3. Hg2+-Cd2+对花翅摇蚊幼虫体组织中SOD活性的影响
3.3.2. 不同浓度Hg2+-Cd2+对花翅摇蚊幼虫体组织中CAT活性的影响
通过观察图4可以发现,随浓度的升高,CAT活性逐渐增强,但0.002 mg∙L−1组和0.004 mg∙L−1组的活性低于其对照组,在0.008 mg∙L−1组活性最强,随后,活性继续逐渐下降,差异性显著(P < 0.05),0.064 mg∙L−1组、0.128 mg∙L−1组和0.256 mg∙L−1组的CAT活性低于对照组。
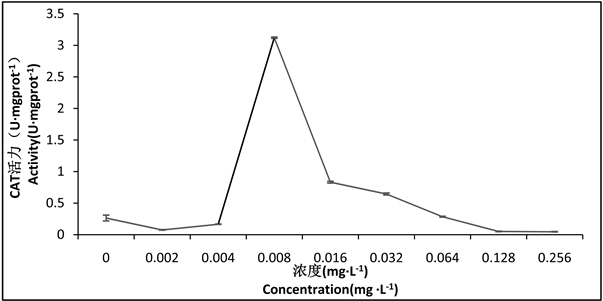
Figure 4. Effect of Hg2+-Cd2+ on CAT activity in tissues of larval Chironomus kiinensis
图4. Hg2+-Cd2+对花翅摇蚊幼虫体组织中CAT活性的影响
3.4. Hg2+-Cd2+胁迫对花翅摇蚊幼虫生长发育的影响
3.4.1. 不同浓度Hg2+-Cd2+胁迫对花翅摇蚊幼虫体重的影响
亚致死剂量的Hg2+-Cd2+对花翅摇蚊体重影响如图5所示。与对照组相比,0.004 mg∙L−1、0.016 mg∙L−1、0.064 mg∙L−1和0.256 mg∙L−1处理组摇蚊幼虫的相对干重随浓度的升高而逐渐增加,且始终高于对照组。处理组的相对湿重随浓度的升高先增加,在0.064 mg∙L−1处理组湿重略有下降后,相对湿重继续随浓度的升高而增加,在此过程中,处理组的相对湿重也始终高于对照组。在0.004 mg∙L−1、0.016 mg∙L−1和0.064 mg∙L−1处理组湿重高于干重,而在0.256 mg∙L−1处理组相对干重大于相对湿重。
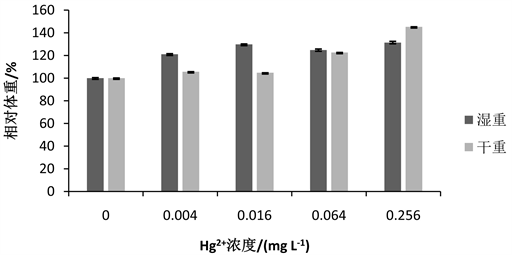
Figure 5. Effect of Hg2+-Cd2+ on weight of 4th-instar larval Chironomus kiinensis
图5. 汞和镉联合作用下花翅摇蚊4龄幼虫体重变化
3.4.2. 不同浓度Hg2+-Cd2+胁迫对花翅摇蚊幼虫化蛹率的影响
不同浓度的Hg2+-Cd2+联合胁迫对花翅摇蚊4龄幼虫化蛹率的影响如图6所示。在相同的实验室条件下,处理组的累计化蛹率明显低于对照组的累计化蛹率,且0.004 mg∙L−1、0.016 mg∙L−1、0.064 mg∙L−1、0.256 mg∙L−1处理组累计化蛹率分别为对照组的71.43%、71.43%、57.14%和42.86%,表明Hg2+-Cd2+对摇蚊幼虫化蛹率的抑制作用随浓度的增加而增强。
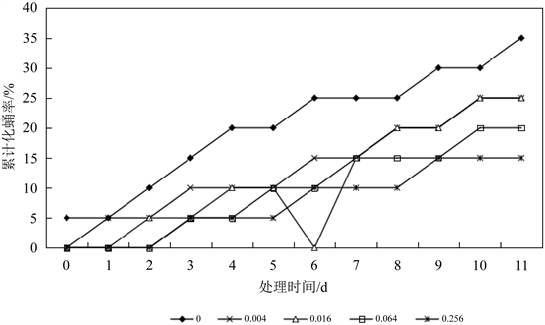
Figure 6. Effect of Hg2+-Cd2+ on pupation rate of 4th-instar larval Chironomus kiinensis
图6. 汞和镉联合作用下花翅摇蚊4龄幼虫化蛹率变化
4. 讨论
4.1. Hg2+-Cd2+胁迫对花翅摇蚊幼虫口器结构的影响
外源毒物对摇蚊幼虫生理学方面的影响主要表现为以下两点,一是对摇蚊幼虫的口器致畸作用,二是对生活史中变态发育过程的影响。口器的畸形会影响摇蚊幼虫的摄食,进而影响其生长发育,对水环境中重金属的污染进行早期诊断和生态风险评价有重要意义。许多研究已经证实,重金属如Cu和Cd可以诱导摇蚊幼虫口器的畸变 [25] - [30]。外源毒物诱导摇蚊幼虫的畸变主要发生于其颏部,同时,有研究表明经过重金属Ni、Hg胁迫的羽摇蚊幼虫大颚也会产生不同程度的畸变 [15]。目前,重金属对口器畸形的作用机理尚不明确,但是,有许多研究所证明的金属暴露浓度及暴露时间与致畸率之间存在线性关系,使得将致畸率成为评价水体环境的一种重要参数。
正常情况下的花翅摇蚊幼虫口器颏部包含个3中间齿和2组侧面齿,每组各有6个齿。本研究中,Hg2+和Cd2+在协同作用下诱导花翅摇蚊幼虫颏部的中间齿和侧齿发生了不同程度的缺失。但是,涉及的样本数少,并未验证暴露浓度和致畸率之间的关系。
4.2. Hg2+-Cd2+胁迫对花翅摇蚊幼虫体组织抗氧化酶活性的影响
Hg2+和Cd2+都属于外源毒物,会破坏机体内DNA、功能蛋白结构,使酶失活等 [1] ,从而间接反映环境中氧化应激物的存在,起到指示环境中存在污染物的作用 [12] [31] ,而且具有准确,痕量测量等优点,可以弥补传统理化方法测定污染物的不足。SOD和CAT都属于抗氧化酶系,SOD是一种普遍存在于动植物和微生物中的抗氧化金属酶,能催化生物体内超氧阴离子自由基(O2−)发生歧化反应,产生氧和过氧化氢,有利于机体内氧化和抗氧化的平衡 [32] [33]。CAT是一类普遍存在于动植物和微生物体内的末端氧化酶,参与其体内活性氧的代谢过程,与SOD在生物体内共同建立了一个功能一致且相互配合的抗氧化网络,可以清除机体内的O2−、H2O2和一些过氧化物,阻止或减少体内羟基自由基(OH−)的形成,有利于机体内氧化和抗氧化的平衡 [32] [33] [34]。
花翅摇蚊幼虫在Hg2+和Cd2+联合毒性的作用下可以引起机体内SOD活性和CAT活性的变化。在Hg2+和Cd2+的协同作用下,SOD和CAT活性均随浓度的升高而升高,但是在高浓度Hg2+-Cd2+组,抗氧化酶活性受到抑制,而逐渐下降,且超过其耐受极限而低于对照组的活性。刘清等 [35] 认为造成这种现象的原因是共同存在于生物体内的金属增加细胞膜的通透性,进入胞内的重金属离子增多,重金属毒性增强。Hg2+-Cd2+的SOD活性在0.016 mg∙L−1组开始下降,而其CAT活性从0.008 mg∙L−1组开始下降,与同等浓度下单独作用的Hg2+和Cd2+相比较,Hg2+-Cd2+对花翅摇蚊幼虫的抗氧化酶活性要高于单独的Hg2+或Cd2+作用下的活性,机体内的超氧阴离子更多 [36]。这也证明了Hg2+和Cd2+对花翅摇蚊幼虫的联合毒性作用属于协同作用。
摇蚊是水生态系统中数量丰富的底栖生物,其体内抗氧化酶作为生物标志物可对水体中痕量重金属(Hg2+和Cd2+)污染物的毒性效应进行监测与早期预警。本研究以花翅摇蚊4龄幼虫为受试昆虫,Hg2+和Cd2+联合作用测定摇蚊体内SOD和CAT活性,明确Hg2+和Cd2+对SOD和CAT活性的生物化学效应,为SOD和CAT作为检测水体污染物的生物标志物提供更可靠的依据。
4.3. Hg2+-Cd2+胁迫对花翅摇蚊幼虫生长发育的影响
半致死剂量常作为可信的毒性效应指标,而实际水体环境中Cd2+浓度通常达不到0.543 mg∙L−1 (24 h的EC50),而Hg2+的浓度通常也达不到1.731 mg∙L−1 (24 h的EC50),需要更敏感的指标来监测水中重金属污染程度。因此,环境指示生物在生理水平上的一些变化常作为慢性毒性的毒理学指标 [37]。许多研究者对摇蚊幼虫的生长发育作了大量的工作,研究发现生长环境可以影响摇蚊的体重、羽化率和性比等生长发育状况。
试验结果表明,Hg2+和Cd2+暴露对花翅摇蚊幼虫的生长状况及生活史均有显著影响,且随着浓度的升高,作用效果增强。在Hg2+-Cd2+浓度下的暴露组幼虫体重随浓度的升高而增加,可能是因为随着浓度增大,摇蚊幼虫的生理活动受到抑制,不能通过自身代谢将外源毒物全部排出体外,故而重金属在摇蚊幼虫体内累积量增多,重金属的累积重量大于摇蚊幼虫由于消耗能量而减少的重量,造成其体重的上升。
Pascoe等 [38] 研究显示在Cd2+刺激下,幼虫的生长发育过程受到抑制,脱皮及羽化过程所需的时间变长。PlanellÓ等 [39] 将羽摇蚊幼虫暴露在低浓度的镉中36 h后,研究发现该幼虫的细胞核活性及其构造发生显著变化,抑制了rRNA水平,其转录产物缩氨酸BR基因的活性也因此受到抑制,进而阻碍了正常筑巢行为的进行,因此,幼虫无法及时运行有效的防御措施来避免中毒风险。但本试验结果显示,在各Hg2+-Cd2+浓度下的暴露组幼虫均有化蛹个体产生,但对化蛹率也有抑制作用,随浓度的升高,化蛹率逐渐降低,这可能是重金属干扰花翅摇蚊幼虫体内蜕皮激素的正常代谢,导致幼虫化蛹过程受到抑制。因此,Hg2+和Cd2+在水体中的毒性小但是不可忽视的,从环境指示生物的角度来看,花翅摇蚊幼虫化蛹对重金属毒物Hg2+和Cd2+敏感,化蛹率可以用作慢性毒性效应的指标。
5. 结论
本研究发现Hg2+和Cd2+对花翅摇蚊幼虫的联合毒性作用为协同作用,并得出以下几点结论:
一、重金属污染物可以对花翅摇蚊幼虫口器产生畸变作用
在Hg2+和Cd2+的联合暴露下,摇蚊幼虫颏部的中间齿和侧齿均有不同程度的缺失。因此,可以将摇蚊幼虫口器畸变的类型作为水环境评价的重要参数之一。
二、重金属污染物可以影响花翅摇蚊幼虫抗氧化酶活性
经试验发现,Hg2+-Cd2+可以影响花翅摇蚊幼虫的SOD和CAT活性,SOD和CAT活力在受低浓度重金属刺激后,在不同浓度下表现出不同的激活水平,其活力的大小反映了外源毒物对于花翅摇蚊幼虫的致毒程度及其解毒过程,是一个合适的评价水体中Hg2+和Cd2+毒性的指标。
三、重金属污染物可以影响花翅摇蚊幼虫的生长发育
在不同浓度的亚致死剂量Hg2+-Cd2+暴露下,各处理组的花翅摇蚊4龄幼虫湿重和干重均增加,不适宜用其作为监测水体重金属污染的指标;摇蚊幼虫化蛹过程中对Hg2+-Cd2+敏感性高,虽然,各处理组均有幼虫化蛹成功,但是,化蛹率均明显低于对照组,表现为对化蛹率的抑制作用,且与浓度呈负相关关系(P < 0.05),因此,适宜将其作为慢性毒性效应的指标之一。
基金项目
本课题承蒙中央高校基本科研业务费专项基金资助,特致殷切谢意。
NOTES
*通讯作者。