1. 引言
近些年,随着近代医学和生物化学的发展,人们发现一些主族金属元素的一些配合物具有很好的抗肿瘤活性。通过对目前国内外生物无机配合物研究现状的了解,我们知道目前国内外对氨基酸金属配合物的研究主要涉及到过渡金属和稀土金属 [1] [2] [3] 。但是,对于主族金属元素尤其是第五主族金属元素氨基酸配合物的研究则很少。因此,进一步系统地合成和研究砷和氨基酸的生物配合物具有很重要的理论和实际意义。过去,合成金属氨基酸配合物均采用液相合成法,但是采用固相合成的方法没有文献报道过。该文致力于用固–固反应合成六次甲基四氨碘化砷配合物,通过X-射线衍射、远红外、差热热重及核磁共振分析对合成的配合物进行了表征,并证实了所合成的六次甲基四氨碘化砷配合物对HL-60白血病细胞具有生物活性。
2. 材料和方法
2.1. 仪器与药品
玛瑙研钵;日本Rigaku D/max-2550VB/PC转靶X射线衍射仪;Nicolet 5D-ft红外光谱仪;NETZSCH-STA-449C热分析仪;LCT-1 热天平;AVANCE 500型核磁共振仪;XRD图谱指标化计算采用Rietveld程序。
实验所用化学试剂均为化学纯;溶液均用去离子水配制。
2.2. 化合物的合成及其表征
称取六次甲基四氨1.4042 g (10 mmol)和碘化砷2.2811 g (5 mmol),将两者在玛瑙研钵中混合,在手套箱中仔细研磨反应0.5 h后,向反应物中加入几滴乙氰引发,此时反应混合物变为橙黄色,再继续研磨1.5~2 h,反应物又变成浅咖啡色,再加入少量乙氰,混合物局部变为深黄色,研磨以后混合物又变为咖啡色,继续研磨一直到所有混合物均变为咖啡色,研磨反应8小时后,将产物在50℃真空干燥1 h,最终得到的产物为土黄色。
配合物在水中完全溶解,在95%的乙醇中也溶解。在5℃时也能够溶解于三氯甲烷和丙酮中。
对该配合物做了粉末X-射线衍射分析,其图谱见图1。
用计算机程序对六次甲基四氨碘化砷配合物的粉末X射线衍射数据进行了指标化计算,结果见表1。

Figure 1. The X-ray of the complex urotropine-AsI3
图1. 六次甲基四氨碘化砷的粉末X-射线衍射图谱

Table 1. The experimental data and the calculated results for powder X-ray diffraction pattern of the resultant
表1. 六次甲基四氨碘化砷的粉末X-射线衍射数据及计算结果
Triclinic symmetry: a = 9.737 (Å), b = 11.769 (Å), c = 19.874 (Å), α = 96.690, β = 96.690, γ = 100.360.
计算结果表明:该配合物能够用同一套晶胞参数进行指标化,晶面间距的计算值和实验值之间的相对百分误差最大为0.45%。所以,该配合物是单一相的化合物,其晶体结构属于单斜晶系。
为了进一步了解配合物的配位情况,对配合物做了红外测试,为了进行比较,我们将配体的标准红外图谱和配合物的红外图谱分别示图于图2(a)、图2(b)。
 (a)
(a) (b)
(b)
Figure 2. (a) Standard infrared spectrum of hexamethylenetetramine; (b) Infrared spectrum of complex
图2. (a) 配体的红外图谱;(b) 配合物的红外图谱
从配体的红外图可以知道,在2871 cm−1,2952 cm−1,1457 cm−1和1439 cm−1处的吸收峰分别来自于亚甲基上的C-H键的对称和反对称伸缩振动和变形振动,而在1370 cm−1、1237 cm−1、1047 cm−1和1005 cm−1处的吸收峰分别来自于N(CH2)3基团中N-C键的对称和反对称伸缩振动和变形振动。在815 cm−1,671 cm−1和570 cm−1处的吸收峰分别来自六次甲基四氨分子的骨架振动。很显然,配合物与配体的红外光谱图有明显的不同,在配合物的红外谱图中,配体的一些特征吸收峰消失了或者峰的位置发生了移动。如:3871 cm−1处的吸收峰移到了2832 cm−1,1457 cm−1处的吸收峰移到了1458 cm−1,1370 cm−1处的吸收峰移到了1369 cm−1,而671 cm−1处的吸收峰移到了655 cm−1处。而且峰的强度也发生了变化。特别是配合物的吸收峰数目要比配体的吸收峰多了很多,这可能主要是因为砷和六次甲基四氨形成了配合物的缘故。为了进一步了解配合物的成键情况,对配合物做了远红外谱图分析,其图谱见图3。
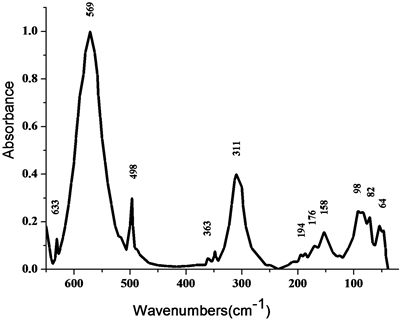
Figure 3. Far-infrared spectrum of complex
图3. 配合物的远红外图谱
图3与图2(a)的配体的图谱对比发现,有很大的差别。在569 cm−1处出现了As-N键的伸缩振动吸收峰,而且原配体在513 cm−1处的峰移到了498 cm−1,并且强度变的很小,是由于有As-N键生成对它造成的影响。311 cm−1处的峰归属于I-As-N的伸缩振动吸收峰,在194 cm−1和176 cm−1处出现的是As-I的对称和反对称吸收峰,在98 cm−1,64 cm−1处出现的是As-I键的对称和反对称变形振动吸收峰。在158 cm−1处出现了配合物的晶格振动吸收峰。As-N键和I-As-N峰的出现也证实了新配合物的合成。
为了验证配合物成键及组成情况,对配合物进行了差热热重分析,可能的热分解过程列在表2中。

Table 2. Thermal decomposition data of AsI3 [(CH2)6N4]2
表2. 六次甲基四氨碘化砷热分解过程
上面的分解过程中,第一步有肼放出。为了检验配合物的热分解产物,取少量配合物置于小试管中,将其用煤气灯小火加热,并在试管口放一小片湿的试纸进行检验,试纸含有HCl、KIO3以及淀粉指示剂。检验结果发现:试纸上的淀粉会变成蓝色,也就是说发生了下面的反应:
即因为生成了碘单质,使试纸中的淀粉变成蓝色。这就验证了热分解产物是肼分子。
从热分解的情况可以看出,在配合物的分解过程中,氮是以N2H4的形式分在三个温度下失重的,这就说明,氮原子的配位情况是不同的。最后一步失去的是与砷参与了配位的氮原子,结合远红外图谱分析,可以进一步说明在远红外图中出现的As-N键的吸收峰。所以证实了目标配合物的正确性。
对该配合物我们也做了核磁共振分析,六次甲基四氨碘化砷配合物的核磁共振图谱示于见图4。
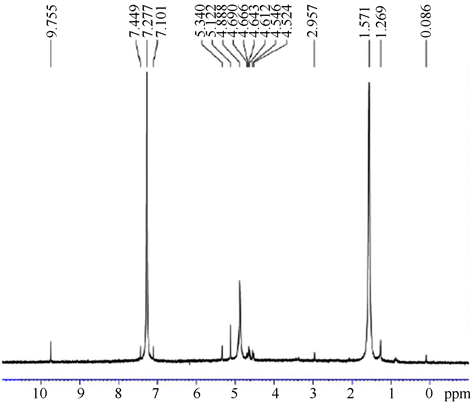
Figure 4. The NMR of the complex
图4. 六次甲基四氨碘化砷的核磁共振图

Figure 5. The probable structure figure of the complex for arsenic-urotropine
图5. 六次甲基四氨碘化砷可能的结构示意图
在配合物(可能的结构图示于图5)的1H NMR中,也可以证明两者发生了反应。六次甲基四氨不溶于丙酮,而配合物却能够在丙酮中溶解。在六次甲基四氨的CDCl3中仅在4.72 ppm有共振吸收,这是因为在六次甲基四氨是高对称性结构,即每个CH2基团都与两个氮原子相连,而每个氮原子都与三个CH2基团相连,即N-CH2-N,和N(CH3)3样的连接。所以CH2中的H的位置是高对称性的,H的化学环境仅有一种,所以在1H NMR中仅有一个峰出现。但是在配合物的1H NMR中,却复杂的多。这可能是因为生成配合物以后改变了原来单纯配体的高对称性,因为对称性越高表现在1H NMR中就是谱峰越简单。在配合物中出现的H的共振峰集中在两个位置,即从4.56 ppm到4.85 ppm区域和从5.02 ppm到5.48 ppm区域。这是因为在砷与六次甲基四氨生成配合物以后,H所处的环境发生了变化。由上面的配合物的结构图可以看出,生成配合物以后,CH2有了两种化学环境,也就是,氢有两种:一种就是和与砷配位的氮原子连接的CH2上的H;另一种就是与没有和砷配位的氮原子连接的CH2上的H,所以反映在1H NMR上面就是会出现在两个区域。在这种情况下,由于氮原子的一对孤对电子与砷作用,所以氮原子周围的电子云密度就会减小,由于氮的电负性比碳、氢都大,所以就对氢造成去屏蔽作用,使这种氢的位移会增加所以在5.02 ppm到5.48 ppm区域的峰应该归属于第一种氢。
2.3. 生物活性的测定
2.3.1. 细胞培养 [4]
将白血病细胞株HL-60细胞接种于含有10%灭活小牛血清的新鲜RPMI-1640培养液中,置于37℃,饱和湿度,5% CO2的培养箱中培养。3天传代一次。
2.3.2. MTT方法测定细胞毒性
将HL-60细胞悬浮液调整为20 × 104/ml,接种于96孔培养板中,每孔100 μL,然后在实验组加入上述的各种不同浓度药物稀释液100 μL,对照组不加药,另设空白组(只有培养液,无细胞),每组4个复孔。在CO2培养箱中培养72小时,然后加入5 μg/ml MTT 20 μL,继续在培养箱中培养4个小时。此时孔中会有紫色的沉淀。然后从每孔中吸出200 μL上层清液。然后在每孔加入DMSO 200 μL,振荡直至观察到甲臢结晶完全溶解成紫色的溶液,在酶标仪上检测530 nm处的吸光度值(A530)。
将碘化砷、六次甲基四氨碘化砷两种药物对HL-60白血病细胞所测定的吸光值做一对比,结果见表3。

Table 3. Comparison of the absorbance of AsI3 and the complex for HL-60 cell
表3. 两种药物对HL-60细胞的吸光值比较
将碘化砷、六次甲基四氨碘化砷两种药物对HL-60白血病细胞所计算的抑制率做一对比,结果见表4。

Table 4. Comparison of the inhibition rate of AsI3 and the complex
表4. 两种药物对HL-60细胞抑制率比较
为了直观的表达两种药物对白血病细胞的抑制率,以抑制率为纵坐标,药物浓度为横坐标,比较见图6 (括号内为当抑制率为50%时的药物浓度即IC50)。

Figure 6. The curve comparison of the restrain rate of AsI3 and the complex (Therein, Urotropine-AsI3: the complex; AsI3: Arsenic triiodide)
图6. 两种药物对白血病细胞的抑制率比较(其中Urotropine-AsI3:六次甲基四氨碘化砷(23.6);AsI3:碘化砷(42))
由以上对比我们发现上述药物对白血病HL-60细胞都有抑制作用,但是各种药物对细胞的IC50是不同的。其中在以含砷药物做比较我们发现砷生成配合物以后的IC50要明显比单独的碘化砷IC50要小。而且六次甲基四氨碘化砷配合物的IC50比单独的六次甲基四氨和单独的碘化砷的IC50要小。所以我们认为可能是生成配合物以后两者共同作用的结果,即协同作用使其对白血病HL-60细胞的抑制作用更好一些。
3. 结果
所合成的配合物经X-射线衍射分析、远红外谱图分析、差热热重分析及核磁共振分析证实为目标化合物,同时进行的细胞实验,砷的配合物对白血病细胞的凋亡有明显的生物作用,初步证实了砷的配合物对白血病细胞是有作用的。如果能够合成出更多种配体与砷的配合物,然后进行筛选,筛选出毒性小、对白血病细胞作用强的砷的配合物,这将在治疗白血病方面开辟一个新领域。
基金项目
上海市自然科学基金资助课题。
NOTES
*现工作地址:华东理工大学。