1. 引言
粒毛盘菌属(Lachnum sp.)是一种广泛分布于自然界的腐生性真菌,隶属于盘菌纲(Discomycetes)柔膜菌目(Helotiales)晶杯菌科(Hyaloscyphaceae) [1]。本课题组前期对多种粒毛盘菌的生物活性物质已经进行了诸多研究 [2] [3] [4]。粒毛盘菌胞外多糖(LEP)是粒毛盘菌通过深层发酵产生的多糖类生物活性物质。LEP具有多种生物活性,包括降血糖、降血脂、抗炎症、抗癌等 [3] [4] [5]。同时,LEP的分子量、单糖组成、糖苷键类型、空间构象等理化因素对其生物活性具有重要的影响。
随着生活水平的提高和饮食习惯的改变,高血糖、高血脂等各种慢性疾病的发病率日益提高,已经成为严重影响国人身体健康的疾病类型。由于高血糖和高血脂疾病一般都伴随出现,因此寻找开发具有同时降低血糖和血脂的天然药物具有重要的现实意义 [6]。
本文研究深层发酵粒毛盘菌YM240,从发酵液中分离获得LEP粗提物,并进行了初步的纯化处理,同时利用体外实验方法检测了LEP的降血糖和降血脂活性。研究结果显示LEP可以有效地抑制α-葡萄糖苷酶、α-淀粉酶和脂肪酶活性,同时有效结合胆酸盐,表现出较强的体外降血糖和降血脂活性,为进一步阐明其作用机理提供了一定的科学根据。
2. 材料与方法
2.1. 材料与试剂
菌株:粒毛盘菌YM240由合肥工业大学微生物资源与应用研究室分离。
葡萄糖、蛋白胨、酵母膏、氯仿购自天津市博迪化工有限公司;可溶性淀粉、3,5-二硝基水杨酸、四水合酒石酸钾钠、牛磺胆酸钠、甘氨胆酸钠、聚乙烯醇、橄榄油、胰脂肪酶、胃蛋白酶、α-淀粉酶、阿卡波糖购自国药集团化学试剂有限公司;α-葡萄糖苷酶、PNPG购自阿拉丁试剂公司;浓盐酸、浓硫酸、苯酚购自上海中成化学试剂有限公司;其他常规药品均为市售分析纯药品。
2.2. 仪器与设备
SW-CJ-ICU型超净工作台,上海博讯实业有限公司;250 D数显光照培养箱,江苏省正基仪器有限公司;TDL-50B型台式离心机,上海安亭科学仪器厂;RE-85旋转蒸发仪,上海青浦沪西仪器厂;冷冻干燥机FD-1B-50,北京博医康实验仪器有限公司;分光光度计,上海精密科学仪器有限公司;680 iMark 酶标仪;美国伯乐公司;100 L发酵罐,镇江东方生物工程设备公司。
2.3. 粒毛盘菌YM240发酵条件
2.3.1. 种子发酵液制备
发酵培养基:葡萄糖20 g/L,酵母膏5 g/L,蛋白胨5 g/L。配制1 L,分装于10个250 mL锥形瓶中,用高压蒸汽灭菌锅121℃下灭菌30分钟。待冷却至室温,在超净工作台内将保藏良好的YM 240菌种接种于装有活化培养液的锥形瓶中,置于摇床内在25℃条件下活化4天,摇床转速为160 r/min。
2.3.2. 大罐发酵
配置70 L的发酵液,发酵液配方与种子发酵液一致,称取定量的葡萄糖,酵母膏,蛋白胨于5 L量杯中溶解待定。
使用100 L自控发酵罐进行发酵。首先将发酵罐清洗干净,然后倒入发酵液,加入蒸馏水至70 L,倒入10 mL左右色拉油(消泡剂),于121℃高压灭菌30 min。灭菌结束后待发酵液冷却到30℃时,无菌条件下接种种子液。发酵条件设定为温度30℃、搅拌速度 180 r/min,发酵时间12天。
2.3.3. 生物量测定
于250 mL锥形瓶中接种一定量的粒毛盘菌,摇床培养。培养一定时期,将发酵液抽滤,菌丝体用蒸馏水清洗2~3次后于60℃干燥箱中烘干至恒重,称重换算为菌体干重,并记录不同发酵时间的生物量结果(生物量 = 菌体干重/发酵液体积)。
2.4. 粒毛盘菌YM240胞外多糖的提取纯化
2.4.1. LEP粗多糖分离
发酵结束后,将70 L发酵液抽滤后,滤液抽入旋转蒸发仪中,利用真空泵抽真空于50℃条件下浓缩,直至留下1 L左右的浓缩液。向发酵液浓缩液中加入3倍体积的95%乙醇溶液,在4℃条件下醇沉12 h。然后在室温条件在4000 r/min离心10 min,取沉淀物,为LEP粗多糖 [7]。
2.4.2. LEP的初步纯化
1) 脱蛋白
由于粗多糖含有一定量的蛋白质,需要进行脱蛋白处理,本研究采用Sevage法脱蛋白 [8]。取多糖溶液加入1/3体积的Sevage试剂(氯仿、正丁醇体积比5:1),将混合物剧烈振摇20 min,静止20 min。用分液漏斗分液,分去水层与溶剂层交界处的变性蛋白,重复以上操作至水相与溶剂相的交界面无胶状变性蛋白质时,最终将多糖液集中于干净烧杯。
2) 脱色
脱蛋白结束后,进行H2O2脱色处理 [9] ,向多糖溶解液中加入其体积10%的浓度30%的H2O2,50℃保温脱色2天,期间每隔12小时加一次H2O2,脱色最终得到淡黄色的溶液。
3) 多糖透析
将脱蛋白、脱色处理后的多糖水溶液置于透析袋(直径25 mm、截留分子量3500 Da)中,自来水逆向流动透析48 h,再用蒸馏水透析24 h。将透析后的多糖溶液倒入培养皿中分装,−80℃冷冻24 h,最后冷冻干燥即得粒毛盘菌YM240胞外多糖(LEP)。
2.5. 粒毛盘菌YM240胞外多糖的分级分离
过柱前对Sephadex G-100凝胶进行预处理 [10] ,使用玻璃层析柱(1.6 × 60 cm),填充高度50 cm,蒸馏水平衡过夜,平衡流速0.5~1 mL/min,上样量为15 mg,用双蒸水洗脱,层析柱上端进液口链接恒流泵,每2.5分钟收集一管,每管2 mL。分别用蒸馏水,0.1 mol/L,0.3 mol/L,0.5 mol/L NaCl进行洗脱。用苯酚-硫酸法逐管追踪检测,于490 nm下测定吸光度,以管数对吸光度值绘制其洗脱曲线,分离得到组分较多的单一组分。
2.6. 苯酚-硫酸法测多糖含量
采用苯酚-硫酸法测多糖含量 [11] ,取1 mL LEP溶液、5 mL浓硫酸、1 mL 6%的苯酚于试管中混匀,静置10 min,在25℃水浴中保温20 min,490 nm处测吸光值。对照葡萄糖标准曲线,求得多糖含量。
2.7. 发酵过程中发酵液多糖含量的测定
取发酵第7~11天的锥形瓶内的发酵液利用苯酚-硫酸法测多糖含量。
2.8. LEP对α-葡萄糖苷酶的抑制作用
参照相关文献并做一定的修改,检测LEP对α-葡萄糖苷酶的抑制活性 [12]。通过100 mM磷酸盐缓冲盐水(PBS, pH 5.0)制备不同浓度(0.1, 0.5, 1.0, 3.0, 5.0 mg/mL)样品溶液,α-葡萄糖苷酶(2 U/mL)和对硝基苯基-α-D-吡喃葡萄糖苷(PNPG, 1.5 mM)。将样品(10 μL)和α-葡萄糖苷酶(20 μL)的混合物在37℃下保持10 min。再加入20 μL的PNPG在37℃下温育20 min,最后加入200 μL Na2CO3(1 M)终止反应。不含样品的混合物作为对照,阿卡波糖(Acarbose)作为阳性对照,再做各自的空白实验。在400 nm读取吸光度,α-葡萄糖苷酶的抑制百分比按下式计算:抑制率(%) = [1 − (A样品实验组 − A样品空白组)/(A对照实验组 − A对照空白组)] × 100%。
2.9. LEP对α-淀粉酶的抑制作用
参照相关文献检测LEP对α-淀粉酶的抑制作用 [13]。在0.1 M PBS (pH6.9)中制备不同浓度(0.1, 0.5, 1.0, 3.0, 5.0 mg/mL)样品溶液、2 U/mL α-淀粉酶和1%可溶性淀粉。通过将10 mg/mL 3,5-二硝基水杨酸与120 mg/mL 酒石酸钠钾四水合物在0.4 M氢氧化钠中混合来制备定体积二硝基水杨酸(DNS)试剂。在500 μL样品中加入500 μL的α-淀粉酶,37℃下水浴10 min,随后加入500 μL的马铃薯淀粉,37℃下水浴10 min,加入1 mL DNS试剂终止反应,100℃保持5 min。冷却至室温后,用10 mL去离子水稀释混合物。没有样品的反应混合物作为对照,阿卡波糖作为阳性对照,再做各自的空白实验。在540 nm处测量吸光度,按下式计算α-淀粉酶的抑制百分比:抑制率(%) = [1 − (A样品实验组 − A样品空白组)/(A对照实验组 − A对照空白组)] × 100%。
2.10. LEP对脂肪酶抑制作用
脂肪酶抑制实验参照相关文献并做一定修改 [14]。取100 mL锥形瓶12个,每瓶加入5 mL 0.025 mol/L PBS和4 mL聚乙烯醇橄榄油乳化液,置于40℃水浴中保温5 min。实验过程如下:1) 在1个锥形瓶中各加人l mL脂肪酶溶液,从加入酶液开始计时,继续保温30 min;取出后立即各加入体积分数为95%的乙醇15 mL,以停止酶作用;再加入酚酞指示剂3滴,用0.05 mol/L氢氧化钠滴定至溶液呈粉红色为止,记录氢氧化钠消耗的量。另取1只锥形瓶设对照,不加入脂肪酶,按相同方法进行,再做各自的空白实验。2) 取5只锥形瓶,先加入多糖溶液1 mL,再加入l mL脂肪酶溶液,然后按(1)进行实验。另取5只锥形瓶设空白对照,不加入脂肪酶,按相同方法进行。
2.11. LEP胆酸盐结合能力实验(模拟肠道环境)
本研究通过检测LEP胆酸盐结合能力判断其降血脂活性,实验方法参照相关文献 [14]。首先利用甘氨胆酸钠和牛磺胆酸钠绘制胆酸盐标准曲线,然后在模拟肠道环境下检测LEP与胆酸盐结合能力,判断其体外降血脂活性。
1) 胆酸盐标准曲线的绘制
首先分别绘制胆酸盐标准曲线,取不同浓度的标准溶液(甘氨胆酸钠0.03、0.06、0.12、0.18、0.24、0.30 mmol/L,牛磺胆酸钠0.05、0.10、0.1 5、0.20、0.25、0.30 mmol/L) 2 mL于具塞试管中,加入6 mL质量分数60%的H2SO4。反应溶液于70℃水浴20 min,取出冰浴5 min,在387 nm波长处测定吸光度。以胆酸盐含量为横坐标,吸光度为纵坐标绘得胆酸盐含量标准曲线,由标准曲线求得样液中胆酸盐的浓度。
2) 模拟肠道环境下LEP与胆酸盐结合实验
分别移取3 mL不同浓度的LEP多糖溶液于100 mL具塞锥形瓶中,加入3 mL 10 mg/mL胃蛋白酶(用pH6.3的0.1 mol/L PBS配制),1 mL 0.01 mol/L的HCl溶液,在37℃条件下恒温振荡消化1 h,模拟肠道环境;以0.1 mol/L的NaOH溶液调节pH值至6.3,随后加入4 mL 10 mg/mL胰蛋白酶(用pH6.3的0.1 mol/L PBS配制),在37℃条件下,振荡速度为150 r/min,恒温振荡消化1 h,模拟肠道环境进行消化。每个样品中加入4 mL 0.4 mmol/L甘氨胆酸钠(用pH 6.3的0.1 mol/L PBS配制)、0.5 mmol/L牛磺胆酸钠(用pH6.3的0.1 mol/L PBS配制),在37℃条件下恒温振荡l h后混合物转移至离心管中,4000 r/min离心20 min,取上清液,比色法测定甘氨胆酸钠和牛磺胆酸钠含量,每个样品平行3次。甘氨胆酸钠和牛磺胆酸钠结合率按式(1)、(2)计算。
(1)
式中:C1为甘氨胆酸钠加入量/μmol;C2为甘氨胆酸钠剩余量/μmol。
(2)
式中:C3为牛磺胆酸钠加入量/μmol;C4为牛磺胆酸钠剩余量/μmol。
3. 结果与分析
3.1. 粒毛盘菌生物量增长曲线
本研究从培养第七天(培养七天之后生物量较为显著)开始检测发酵液中粒毛盘菌YM240生物量,并绘制其生长曲线(图1)。从图1中可以看出,随着发酵时间的延长,生物量逐渐提高,但是发酵后期的增长率逐渐降低,推测原因为发酵液中营养物质的浓度已经处于下降趋势,限制了粒毛盘菌的生物量的增加。同时,从图1中还可以看出在发酵第11天,粒毛盘菌YM240的生物量达到了最大值,为8.7 g/L。本课题组前期研究了不同的培养条件对萼状粒毛盘菌生物量和胞外多糖产量的影响,不同培养条件萼状粒毛盘菌的生物量为6~12 g/L [15]。赵天瑞等人研究了吲哚乙酸对冬虫夏草生物量的影响,结果显示吲哚乙酸对冬虫夏草的生长有一定的刺激作用,最大的生物量为18.3 g/L [16]。与之前的研究结果相比,本研究中获得的生物量稍低,可能的原因为不同的菌种和培养条件对生物量有一定的影响。

Figure 1. Biomass curve of YM240 during fermentation
图1. 粒毛盘菌YM240生物量变化曲线
3.2. 粒毛盘菌胞外多糖生产曲线
在发酵过程中,通过苯酚-硫酸法检测其发酵液中的胞外多糖含量。由图2可以看出,发酵液中的胞外多糖含量在发酵第7~9天内不断提高,在发酵第10天的时候胞外多糖的含量达到了峰值,为139.8 mg/L。之后,胞外多糖含量明显下降。可能的原因推测为随着发酵过程的进行,发酵液中的营养物质不断消耗,在第10天的时候发酵液中的营养物质已经达到了临界值,真菌开始通过降解胞外多糖来获得必须的营养物质,导致胞外多糖的浓度开始下降。和本课题组前期研究结果相比 [15] ,我们在这里报道的多糖产量较低,主要的原因可能是不同的菌种和发酵条件可能对多糖产量有影响。同时,本研究中的多糖含量是经过分离纯化之后的多糖量,在分离纯化过程中去除了蛋白质等杂质,并且透析过程中也会损失部分多糖,所以最终获得的多糖含量较低,而前期的报道中主要是测量粗多糖的含量,因此报道的数值较大 [17] [18]。
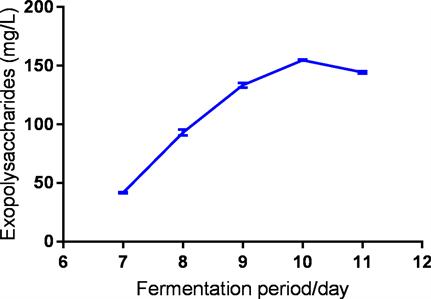
Figure 2. LEP production curve of YM240 during fermentation
图2. 粒毛盘菌YM240发酵液中胞外多糖(LEP)生产曲线
3.3. 胞外多糖(LEP)的分级分离
对LEP进行脱蛋白、脱色和透析处理后,进一步使用Sephadex G-100对LEP进行初步分离纯化。LEP经凝胶柱层析洗脱后得到四个主要的洗脱峰,分别是用蒸馏水,0.1 mol/L NaCl,0.3 mol/L NaCl,0.5 mol/L NaCl四种溶液洗脱得到的多糖曲线(图3)。由图3可知蒸馏水洗脱条件下所得多糖峰面积最大即洗脱含量最多,在0.1 mol/L NaCl洗脱条件下获得的多糖含量稍少,而0.3 mol/L NaCl和0.5 mol/L NaCl洗脱条件下获得的多糖组分最少,这和之前的研究报道结果较为相似 [19]。根据LEP的分级分离洗脱曲线可以判断LEP主要由不带电荷的中性多糖(蒸馏水洗脱部分)和带有部分负电荷的酸性多糖(0.1 mol/L NaCl洗脱部分)组成,且中性多糖的含量略多于酸性多糖的含量 [20]。
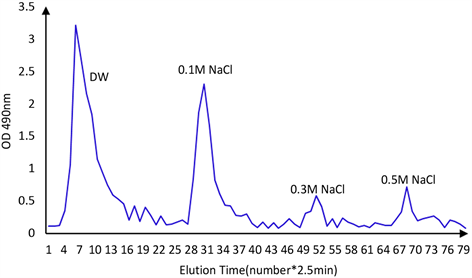
Figure 3. Elution curve of LEP using different elution phase
图3. 粒毛盘菌胞外多糖(LEP)的分级分离洗脱曲线
3.4. LEP对α-葡萄糖苷酶抑制率
消化道分泌多种消化酶,其中α-葡萄糖苷酶可以水解葡萄糖苷键,释放葡萄糖,提高血糖浓度,因此通过抑制α-葡萄糖苷酶能够有效抑制餐后血糖上升,这也成为筛选降血糖药物的常规检测方法 [21]。目前为止,α-葡萄糖苷酶抑制剂如阿卡波糖(Acarbose)是2型糖尿病常见的和有效的临床治疗剂之一。本研究中检测粒毛盘菌胞外多糖对α-葡萄糖苷酶的抑制作用,并且与降血糖药品阿卡波糖进行对比。由图4可知,粒毛盘菌YM240胞外多糖具有抑制α-葡萄糖苷酶的作用,但不如药品阿卡波糖抑制强烈;并且在一定范围内,随着多糖浓度增大,其抑制作用越强;由于随着浓度增加,其抑制增长率在下降,推测可能是由于多糖的抑制作用趋于稳定或者饱和造成。阿卡波糖对α-葡萄糖苷酶的抑制率最高可以达到80%作用,而同等浓度下LEP对α-葡萄糖苷酶的抑制率大约为40%左右。多种真菌多糖对α-葡萄糖苷酶都有一定的抑制作用。朱振元等人报道了蛹虫草多糖对α-葡萄糖苷酶活性的抑制作用,发现多糖的抑制作用低于阿卡波糖,半数抑制浓度为4.22 mg/mL,而且当浓度较高时其对α-葡萄糖苷酶活性的抑制作用趋于平缓,呈现出饱和的状态,这与我们的研究结果较为一致 [12]。而鲁梅芳等人研究了灰树花多糖对α-葡萄糖苷酶的抑制活性,他们报道的半数抑制浓度为35.79 mg/mL,远高于我们的实验结果,说明LEP对α-葡萄糖苷酶具有较强的抑制作用 [22]。
3.5. LEP对α-淀粉酶的抑制率
食物中的淀粉类物质通过肠道过程中经过α-淀粉酶和α-葡萄糖苷酶水解产生葡萄糖,随后会被小肠吸收进入血液。研究表明,抑制α-淀粉酶是治疗糖尿病重要的方法之一 [23]。本研究中检测了LEP对α-淀粉酶的抑制作用,并且与降血糖药品阿卡波糖进行效果对比。由图5可知,LEP具有抑制α-淀粉酶的作用,但不如药品阿卡波糖抑制强烈;并且在一定范围内,随着多糖浓度增大,其抑制作用越强;同图4中显示的结果相似,随着真菌多糖浓度的增加,其对α-淀粉酶的抑制增长率下降,这和之前的报道结果类

Figure 4. Inhibition rate of LEP to a-glucosidase
图4. LEP对α-葡萄糖苷酶抑制率
似,说明多糖对α-淀粉酶的活性抑制作用可能有饱和效应 [24]。影响多糖对α-淀粉酶抑制活性的因素较多,不仅包括其分子结构和空间构象,还包括多糖中杂质的含量。尤玲玲等人报道了黄秋葵多糖的对α-淀粉酶的抑制活性,研究结果表明相比于粗多糖,经过脱蛋白处理后的多糖其对α-淀粉酶的抑制活性显著降低 [13]。
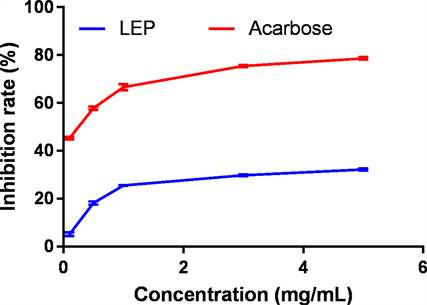
Figure 5. Inhibition rate of LEP to α-amylase
图5. LEP对α-淀粉酶的抑制率
3.6. LEP对脂肪酶抑制率
本研究中针对LEP的降血脂活性主要通过脂肪酶抑制率和胆酸盐结合实验来确定。脂肪酶抑制实验原理是脂肪酶水解油脂产生脂肪酸,游离脂肪酸再与NaOH结合,通过滴定来确定消耗NaOH的量间接确定脂肪酶的活性,多种活性多糖在脂肪酶水解甘油三酸酯反应中起抑制剂作用。由图6可知,在一定范围内,随着LEP浓度增大,其抑制作用也增强,在LEP达到3 mg/mL的浓度后,脂肪酶的抑制率达到44%以上,但是之后随着多糖浓度的提高,抑制率增长比较缓慢,推测可能的原因是LEP对脂肪酶的抑制作用达到饱和。何刚等人研究了黑木耳多糖对脂肪酶的抑制作用,其研究结果显示当黑木耳多糖对脂肪酶的最高抑制率为47%作用,之后即使提高多糖浓度亦不会降低脂肪酶的活性,他们推测黑木耳多糖可以改变脂肪酶的构象,从而影响其催化活性,但是不能使脂肪酶失活 [25]。

Figure 6. Inhibition rate of LEP to lipase
图6. LEP对脂肪酶的抑制率
3.7. LEP的胆酸盐结合率
胆酸盐是体内排泄胆固醇的主要途径,大部分胆酸盐经过肠道-肝脏进行回收,而通过结合胆酸盐,促进胆酸盐排泄可以有效排除体内胆汁酸,间接降低胆固醇含量,达到降低血脂的目标 [26]。本研究中以甘氨胆酸钠和牛磺胆酸钠作为标准物质,首先在387 nm波长下检测不同浓度的甘氨胆酸钠和牛磺胆酸钠标准溶液的吸光值,根据标准溶液的吸光值计算其回归方程,分别为y = 0.1919x + 0.0.0581和y = 0.1726x + 0.0588,相关系数分别为R2 = 0.9984和R2 = 0.9976。
然后分别制备1.6 μM和2.0 μM的甘氨胆酸钠和牛磺胆酸钠溶液作为检测LEP胆酸盐结合率的工作溶液,在不同LEP浓度情况下检测反应溶液的吸光值来判断LEP的胆酸盐结合率,具体结果整理在图7和图8中。从结果中可以看出,LEP对两种形式的胆酸盐都有一定的结合能力,当LEP浓度达到5 mg/mL的时候,对胆酸盐的结合率达到了30%和40%左右,说明其具有一定的降血脂活性。同文献报道的结果相比,LEP的胆酸盐结合率和赵艳等人报道的水溶性红雪茶多糖结合胆酸盐率比较接近 [27] ,但是低于王振宇等人报道的黑木耳多糖的胆酸盐结合率 [25]。
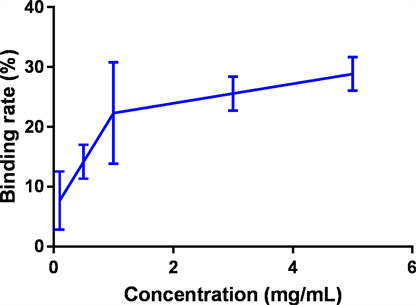
Figure 7. Binding rate of LEP to sodium glycocholate
图7. LEP对甘氨胆酸钠结合率

Figure8. Binding rate of LEP to sodium taurocholate
图8. LEP对牛磺胆酸钠酸钠结合率
4. 结论
活性多糖是一种重要的真菌资源物质,具有多种生理功能,包括降血糖,降血脂,抗氧化,抗癌,抗血栓等。开发新型真菌源活性多糖,解析其化学结构并阐释其作用机理具有重要的理论和应用价值。多年来,本课题组对多种粒毛盘菌多糖进行了深入的研究,解析了粒毛盘菌多糖的化学结构,检测了其多种生物活性并阐述了其作用机理。前期研究显示,粒毛盘菌多糖是一种生物活性显著,具有较大潜在开发价值的多糖资源物质。
高血糖、高血脂等慢性病已经成为现代社会的较为普遍的慢性疾病,但是大部分药物只针对某一种症状进行治疗,作用靶点单一,同时毒副作用较大,对于同时具有多种症状的“代谢综合征”症状的病人效果较差。因此,有必要挖掘同时针对多种症状,毒副作用较小的天然活性物质。
本研究中我们利用体外实验方法检测了粒毛盘菌YM240胞外多糖(LEP)的降血糖和降血脂活性。结果显示,LEP主要由中性多糖和酸性多糖构成,发酵过程中胞外多糖的产量在第10天达到最大值,说明粒毛盘菌YM240可以产生大量的胞外多糖物质;LEP可以有效地抑制α-葡萄糖苷酶和α-淀粉酶的活性,显示出一定的降血糖活性;同时,LEP可以抑制脂肪酶活性,有效结合胆汁酸,显示出一定的降血脂活性。
粒毛盘菌YM240通过深层发酵法可以获得大量的胞外多糖,生产和提取工艺简单,便于大规模生产,同时LEP具有显著的体外降血糖和降血脂活性,这也为后续的深入研究提供了一定的科学基础。
参考文献
NOTES
*通讯作者