1. 引言
在植物中,谷胱甘肽转移酶(Glutathione S-transferases, GSTs)可分为8类,如tau (GSTU)、phi (GSTF)、theta (GSTT)、lambda (GSTL)、zeta (GSTZ)、脱氢抗坏血酸还原酶(DHAR)、微粒体GST和四氯代氢醌脱卤素酶(TCHQD) [1] [2]。各种类型的GSTs在植物生长发育中发挥着重要的功能。一些类型的GSTs能有效消除杀虫剂和除草剂等物质对植物的毒性 [3]。有些GSTs的表达响应逆境胁迫,并且其过量表达会提高植物对逆境胁迫的耐受性;有些GSTs的表达还受到细胞分裂素、生长素、茉莉酸、水杨酸等的诱导 [4] [5] [6]。此外,GSTs还可能参与了植物器官衰老等过程 [1]。相对于其他类型的GSTs,植物中编码GSTZ的基因相对较少。拟南芥中编码GSTZ的基因只有两个,即AtGSTZ1和AtGSTZ2 [7]。AtGSTZ2几乎不表达 [7]。目前关于GSTZ的研究不多。有研究者发现,水稻中GSTZ过表达会增加水稻种子在低温时的发芽率,并且抗冻性不同的水稻中GSTZ酶活有差异 [8] [9]。这些结果说明GSTZ对植物的生长也有重要的影响。
启动子是一段位于基因5’端的能够被RNA聚合酶及反式作用因子识别和结合的DNA序列,是调控基因表达的重要顺式元件 [10]。对启动子表达特征进行分析有助于揭示相应基因的功能和表达模式。目前常用的分析启动子表达特征的方法是将启动子与报告基因如GUS基因融合,构建成目的启动子驱动的报告基因植物表达载体,再转化植物细胞,通过检测转基因植物中报告基因的表达特征,从而确定目的启动子的表达特征 [11] [12]。
本实验克隆了拟南芥AtGSTZ1基因启动子,并构建了该启动子驱动的GUS基因表达载体,将重组载体转入拟南芥中,获得了稳定遗传的转基因株系。GUS组织化学染色结果表明,AtGSTZ1基因启动子驱动了GUS基因在拟南芥中表达。
2. 材料与方法
2.1. 实验材料
拟南芥哥伦比亚、质粒载体pCAMBIA1301、大肠杆菌DH5α和根癌农杆菌GV3101由细胞生物学实验室保存。DNA提取、质粒提取和凝胶回收试剂盒均购自天根生化科技有限公司。内切酶PstI和NcoI、PCR所需试剂均购自Takara公司。ClonExpress lI重组试剂盒从Vazyme公司购买。
2.2. 植物的培养和生长条件
拟南芥种子用消毒液(20% 84消毒液和0.1% Tritonl00)处理10 min后,于超净工作台上用无菌水清洗4~5次,然后播种于MS培养基上。4℃黑暗处理3 d后,于培养室中培养7 d,再移栽至营养土(东北黑土与蛭石1:1混合)中生长。实验材料的培养温度为22℃,光周期为16 h光照/8 h黑暗,光照强度为150 μmol/m2/s。
2.3. AtGSTZ1基因启动子的克隆
取生长1周的拟南芥幼苗,采用DNA提取试剂盒提取拟南芥DNA。根据Genebank中拟南芥AtGSTZ1基因和载体pCAMBIA1301序列设计引物Forward 1: 5′-TCCTCTAGAGTCGACCTGCAGGAAGCTCATG TGCTCAT-3′ (下划线处为酶切位点PstI)和Reverse 1: 5′-TTACCCTCAGATCTACCATGGGATAAACAAG GAATTTGTTG-3' (下划线处为酶切位点NcoI),以提取的DNA为模板,PCR扩增AtGSTZ1基因启动子。PCR产物经1.0%琼脂糖凝胶电泳检测后,切胶回收并纯化。
2.4. AtGSTZ1基因启动子与GUS融合表达载体的构建
将含pCAMBIA1301质粒的大肠杆菌接种于含卡那霉素(50 mg/l)的LB液体培养基中培养过夜,采用质粒提取试剂盒提取pCAMBIA1301。PstI和NcoI双酶切pCAMBIA1301,凝胶电泳检测酶切结果后,切胶回收并纯化酶切产物。酶切后的载体与克隆的AtGSTZ1基因启动子经ClonExpress 1I试剂盒重组后,再热激转化至大肠杆菌DH5α中,菌落PCR检测重组载体。重组载体于华大基因公司进行测序。测序正确的重组质粒命名为GSTZ1-GUS (图1)。采用电击转化法将重组载体转入农杆菌GV3101中,菌落PCR检测阳性克隆。
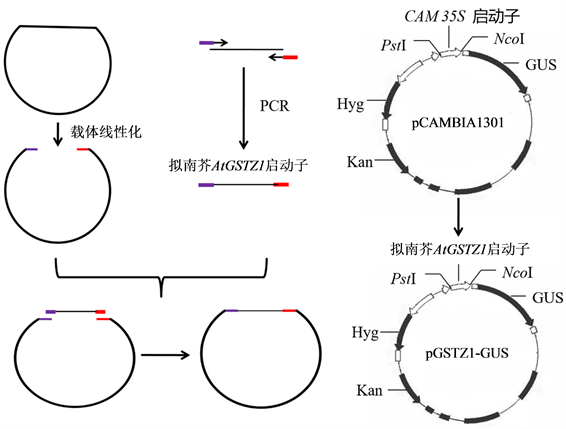
Figure 1. Schematic diagram of pGSTZ1-GUS vector
图1. pGSTZ1-GUS表达载体示意图
2.5. 拟南芥的遗传转化及鉴定
将含重组载体pGSTZ1-GUS的农杆菌接种于含卡那霉素(50 mg/l)、庆大霉素(50 mg/l)和利福平(50 mg/l)的YEB液体培养基中,28℃振荡培养2 d,5000 g离心2 min,收集菌体。菌体悬浮于含0.02% Silwet-L77和0.01% 6-BA的5%蔗糖溶液中,用于侵染拟南芥。拟南芥的转化采用浸花法 [13]。单株收集转化植株种子,将其培养在含潮霉素(25 mg/l)的MS培养基上,筛选潮霉素抗性植株。潮霉素抗性植株移栽至营养土中继续生长一段时间后,取叶片提取DNA。以叶片DNA为模板,Forward 2 (5′-GTCTAGTGTC GTCGTCGTCGT-3′)和Reverse 2 (5′-TAGAACGGTTTGTGGTTAATCA-3′)为引物,PCR进一步鉴定转基因植株,同时采用组织化学法检测转基因植株中GUS的表达。GUS染色按照刘佩琳等的方法进行 [14]。将材料放入1.5 ml的Eppendorf管中,加入GUS染色液,37℃保温过夜,叶片用体积分数75%乙醇脱色,照相记录结果。
3. 结果与分析
3.1. 拟南芥AtGSTZ1基因启动子的克隆
根据NCBI中AtGSTZ1基因和载体pCAMBIA1301序列,设计引物,以拟南芥叶片DNA为模板,PCR扩增AtGSTZ1启动子,获得了2000 bp大小的预期带(图2)。
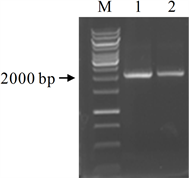 注:M为DNA分子量标准,Line1~2为AtGSTZ1启动子片段
注:M为DNA分子量标准,Line1~2为AtGSTZ1启动子片段
Figure 2. PCR amplification of AtGSTZ1 promoter
图2. AtGSTZ1启动子的扩增
3.2. pGSTZ1-GUS表达载体的构建
AtGSTZ1启动子驱动的GUS表达载体pGSTZ1-GUS的构建如图1所示。pCAMBIA1301经PstI和NcoI酶切后,与克隆的AtGSTZ1启动子连接重组。重组后的载体转化大肠杆菌DH5α。随机挑选单菌落进行PCR检测,部分转化菌中检测到了大小为2000 bp的预期带(图3)。培养含预期条带的转化菌,提取质粒进行测序。测序结果表明,AtGSTZ1启动子按正确的方向与pCAMBIA1301进行了连接,说明pGSTZ1-GUS表达载体构建成功。
 注:M为DNA分子量标准,Line 1为阳性对照,Line 2为阴性对照,Line 3~11为不同菌落模板
注:M为DNA分子量标准,Line 1为阳性对照,Line 2为阴性对照,Line 3~11为不同菌落模板
Figure 3. Identification of colonies by PCR
图3. 菌落PCR检测重组菌
3.3. 转基因拟南芥的筛选和鉴定
将pGSTZ1-GUS表达载体通过电击法转入根癌农杆菌GV3101后,随机挑取单菌落,进行菌落PCR反应,电泳结果显示,部分菌中扩增出约2000 bp的目的带(图4),而对照农杆菌中没有预期带的出现,说明表达载体已经成功转入农杆菌GV3101。培养含pGSTZ1-GUS表达载体的农杆菌,采用农杆菌介导的浸花法转化拟南芥。转化植株的种子在含潮霉素的MS培养基上培养,非转基因幼苗会因潮霉素的作用而不会长出真叶,转基因植株因对潮霉素具有抗性而正常生长(图5)。选择生长正常的植株移栽至营养土中。提取转化植株叶片DNA,采用PCR法对转基因植株进行分子鉴定。结果表明,潮霉素抗性植株中均能扩增出预期带(图6),说明目的带已转入至拟南芥基因组中。
 注:M为DNA分子量标准,Line 1为阴性对照,Line 2~6为不同菌落模板
注:M为DNA分子量标准,Line 1为阴性对照,Line 2~6为不同菌落模板
Figure 4. Identification of GV3101 colonies by PCR
图4. 菌落PCR检测重组菌GV3101
 注:A箭头所示为转基因潮霉素抗性植株,B为非转基因对照植株
注:A箭头所示为转基因潮霉素抗性植株,B为非转基因对照植株
Figure 5. Hygromycin resistance of transgenic plant
图5. 转基因幼苗的潮霉素抗性
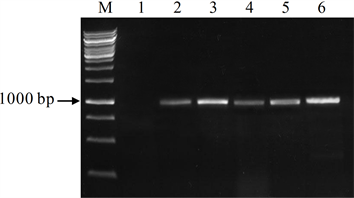 注:M为DNA分子量标准,Line 1为对照植株,Line 2~6为转基因植株
注:M为DNA分子量标准,Line 1为对照植株,Line 2~6为转基因植株
Figure 6. PCR identification of transgenic Arabidopsis
图6. 转基因拟南芥的PCR鉴定
3.4. 转基因拟南芥的GUS染色鉴定
为了检测AtGSTZ1启动子是否能驱动GUS的表达,对T2代转基因植株中的GUS表达进行了检测,结果见图7。由图7可以看出,GUS在转基因植株的根、子叶和下胚轴中都表达,说明AtGSTZ1启动子能驱动GUS在转基因植株中表达。
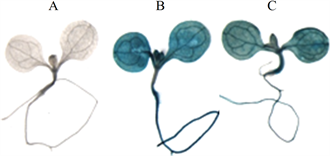 注:A为阴性对照植株,B为阳性对照植株,C为转基因植株
注:A为阴性对照植株,B为阳性对照植株,C为转基因植株
Figure 7. Stain identification of GUS
图7. GUS染色检测结果
4. 结论与讨论
启动子是调控基因表达的重要元件 [10]。对其功能进行研究,有助于进一步了解基因表达与调控的机制。启动子对其下游基因没有选择性。因此,可以将目的启动子与易检测的报告基因相连后,再转化植物细胞,通过观察转基因植物中报告基因的表达来研究启动子的功能 [11] [12]。目前常采用的报告基因是GUS基因。GUS基因来自于大肠杆菌,编码β-葡萄糖苷酸酶;在GUS酶氨基末端融合其它基因编码的蛋白不会改变GUS的活性;并且绝大多数植物细胞内不存在GUS基因 [12]。β-葡萄糖苷酸酶可分解5-溴-4-氯-3-吲哚葡萄糖苷酸,使之产生无色的吲哚衍生物,此产物经过氧化二聚化作用形成不溶解的5,5-二溴-4,4′-二氯深色的靛蓝色物质,使得具有GUS活性的部位呈现蓝色,所以很容易观察启动子的表达特征 [15]。
本实验构建了拟南芥AtGSTZ1基因启动子与GUS融合表达载体,经测序检测,证实启动子与pCAMBIAl301按正确的方向连接。采用农杆菌介导法将重组载体转化拟南芥,通过潮霉素抗性筛选和分子检测,证明重组分子已转入拟南芥中。GUS染色结果表明,AtGSTZ1基因启动子能驱动GUS基因在拟南芥中表达。实验结果为深入研究拟南芥AtGSTZ1基因的表达特征奠定了基础。
基金项目
本论文由湖南农业大学创新性实验计划项目XCX17066和XCX18102支助。