1. 引言
藻蓝蛋白是由开链四吡咯和辅基蛋白通过共价键连接的盘状蛋白质大分子,广泛存在于蓝藻体内 [1] 。人们对藻蓝蛋白功能和应用的研究已经进行了20多年,发现其具有良好的抗氧化、抗病毒、抗肿瘤、增强免疫力和抗炎作用,因此,作为生理活性物质的藻蓝蛋白具有广阔的药物应用前景 [2] 。此外,由于藻蓝蛋白的荧光强度比普通的荧光试剂强30倍,且在可见光谱区有很宽的激发及发射范围和吸收系数,被越来越多用作抗肿瘤研究中的荧光探针 [3] 。
不同纯度的藻蓝蛋白有不同的应用方向,决定了其应用价值大小。根据藻蓝蛋白的光谱学特性,一般采用A620/A280的比值来表征其纯度。纯度 ≥ 0.7为食品级;纯度 ≥ 3.0可作为药品级;纯度 ≥ 4.0为试剂级藻蓝蛋白,价格随着纯度的增高而成倍的增加 [4] 。因此,寻找简易的方法提高藻蓝蛋白的纯度已成为推广藻蓝蛋白药用和作为荧光试剂亟待解决的重要问题之一。此外,国内外大多以培养的螺旋藻为原料提纯藻蓝蛋白,成本相对较高,限制了市场的进一步推广。
由于藻蓝蛋白的粗提液的浓度纯度均相对较低,需要进一步提纯以提高藻蓝蛋白的纯度和浓度。一般采用的方法是先用硫酸铵分段盐析初步纯化 [5] ,再采用柱色谱分离法 [6] 、双水相萃取法 [7] 或电泳法等精致纯化藻蓝蛋白,以达到所需要的纯度,最后通过超滤 [8] 浓缩达到所需要的浓度或冷冻干燥制成固体粉末样品 [9] 。因此,本文直接将从富营养化湖泊中打捞的蓝藻作为提取纯化试剂级藻蓝蛋白的原料,开展柱色谱单因素优化实验,并结合红外光谱分析其纯化机理。
至今为止,对从湖泊等自然水体中打捞的蓝藻直接提纯至试剂级藻蓝蛋白的研究及其相关纯化机理的分析较少。因此本研究开展的对巢湖水华蓝藻的藻蓝蛋白纯化实验将会为今后多维度广角度深层次综合利用水华蓝藻对人体疾病的预防及治疗作用以及将传统的蛋白质纯化等生物技术与环保事业结合提供一定的思路和参考。
2. 实验材料与方法
2.1. 实验样品采集
巢湖水华藻泥,采集自位于合肥市滨湖区的巢湖西湖区水体,距水体表层0.15 m处。直接打捞,经四层纱布过滤除去大量水分后,带回实验室于−20℃条件下冷冻保存备用。
2.2. 实验仪器与试剂
TU-1950型紫外–可见分光光度计,北京普析通用公司;BrukerVertex70型傅里叶变换红外光谱仪,德国布鲁克公司;85-2A型恒温磁力搅拌器,江苏金城国胜仪器厂;KDC-160HR型高速冷冻离心机,安徽中科中佳科学仪器有限公司;DHG-9140型电热恒温干燥箱,上海跃进医疗器械厂;BC/BD-718DTF型冷柜,天长市天一电器有限公司;FA2004N型电子天平,上海民桥精密科学仪器有限公司。
常用试剂:PBS、NaCl、NaOH、(NH4)2SO4、盐酸(以上所用试剂均为分析纯);CellufineA-500,GE公司。
2.3. 实验工艺流程
2.3.1. 藻蓝蛋白粗提液的制备
将含水率为96.4%的巢湖藻泥自冷库内取出,于室温下水浴解冻,如此反复冻融3次后,经4层纱布过滤除去不溶物质。所得上清液再于低温高速(−4℃,8000 r/min)条件下离心20 min除去变性蛋白,得到藻蓝蛋白粗提液。
2.3.2. 两步分段盐析
向上述藻蓝蛋白粗提液中缓慢加入1.2 mol∙L−1 (NH4)2SO4 (饱和度为22.75%),并用恒温磁力搅拌器不断搅拌直至全部溶解,静置10 min后低温高速(−4℃,8000 r/min)离心20 min,分离一步盐析的上清液和沉淀,以达到去杂的目的。再向收集的上清液中追加(NH4)2SO4至1.8 mol∙L−1 (饱和度为34.12%),搅拌直至全部溶解,静置10 min后低温高速(−4℃,8000 r/min)离心20 min,分离二步盐析的上清液和沉淀,以达到沉淀分离纯化的目的。
2.3.3. 透析脱盐
将分离的二步盐析沉淀溶解于10 mmol∙L−1的PBS中,转移进透析袋中并保证密封性,然后放入10 mmol∙L−1的PBS透析液中,低温透析24 h,期间更换透析液3次以上以保证脱盐效果。
2.3.4. 柱色谱分离纯化
预先将CellufineA-500充分溶胀脱气后装柱,柱型为1.6 cm × 50 cm,柱床高22 cm。再用20 mmol∙L−1、pH为7的磷酸盐缓冲液冲洗色谱柱柱床,以使填料达到阴阳离子平衡。将脱盐后的样品上样,先后以不同浓度梯度(0.1 mol∙L−1 NaCl、0.3 mol∙L−1 NaCl、1.5 mol∙L−1 NaCl)的洗脱液进行阶段洗脱,洗脱速度为5 mL∙min−1,收集洗脱的组分,测量藻蓝蛋白的纯度和浓度。
2.3.5. 单因素实验
采用控制变量法,每组分别单独改变洗脱液的pH、离子强度、洗脱速度与进样浓度,进行单因素优化实验。每组实验重复三次,取平均值,使用origin软件进行数据分析。
2.4. 表征方法
根据藻蓝蛋白的光谱学特性来表征藻蓝蛋白的纯度与浓度:藻蓝蛋白不仅在620 nm处有典型的特征吸收峰,而且与一般蛋白质一样在280 nm处也有相应吸收峰。
藻蓝蛋白纯度 [10] :P = A620/A280
藻蓝蛋白质量浓度 [11] (g/L):
藻蓝蛋白的回收率(%):
式中:A280、A620、A650分别为280、620、650 nm波长处的吸光度;Vt为各步盐析后藻蓝蛋白溶液的体积,[PC]0为藻蓝蛋白粗提液的质量浓度,V0为藻蓝蛋白粗提液的体积。纯化的藻蓝蛋白纯度 ≥ 3.0可作为药品级,其回收率简称为3.0回收率;纯度 ≥ 4.0为试剂级藻蓝蛋白,其回收率简称为4.0回收率。
根据藻蓝蛋白的紫外可见与红外吸收光谱特性来定性表征藻蓝蛋白在纯化过程中分子结构的变化以及杂质的去除。
3. 结果与讨论
3.1. 藻蓝蛋白纯化单因素实验
3.1.1. 洗脱液pH对柱色谱纯化藻蓝蛋白的影响
图1为洗脱液pH对藻蓝蛋白纯度和回收率的影响图。由图1可知,纯度随着pH的增加,有先略微增大趋势后减小,在pH 7.0时达到最大为4.20;试剂级藻蓝蛋白回收率(4.0回收率)随着pH的增加先增大后减少,在pH 7.0时达到最大为39.80%;藻蓝蛋白总回收率随着pH的增加先基本不变后降低。由于pH决定藻蓝蛋白在溶液中的电荷特性,从而影响填料对藻蓝蛋白吸附效果。结果表明在pH 7.0时,藻蓝蛋白所带的负电荷与杂蛋白有更多的性质差异(电荷正负、数量)。在考察纯化效果时,鉴于藻蓝蛋白价格随着纯度的增高而成倍地增加,随着回收率的增高而线性增加,故指标优先级应为:纯度 > 4.0回收率 >总回收率 [4] 。综合比较,最适pH应为7.0。
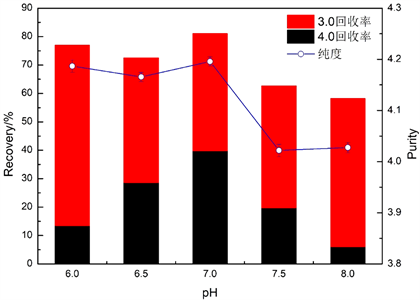
Figure 1. Effect of pH on the purity and recovery of phycocyanin
图1. pH对藻蓝蛋白纯度和回收率的影响
3.1.2. 离子强度对柱色谱纯化藻蓝蛋白的影响
图2为洗脱液的离子强度对藻蓝蛋白纯度和回收率的影响图。由图2可知,纯度随着离子强度的增加而先波动后减小,在离子强度0.20 mol/L~0.30 mol/L时相差不大,均在4.20以上;试剂级藻蓝蛋白回收率随着离子强度的增加先增大后减少,在0.25 mol/L时达到最大为53.22%;藻蓝蛋白总回收率随着离子强度的增加先增加后减少,在0.25 mol/L时达到最大为90.65%。由于离子强度大小影响离子对藻蓝蛋白的竞争作用,从而决定填料对藻蓝蛋白的吸附容量。结果表明离子强度为0.25 mol/L时,藻蓝蛋白、杂蛋白与填料的结合作用在此时会相差较大,因而能够相对较多地解吸洗脱下来。综合比较,最适离子强度应为0.25 mol/L。
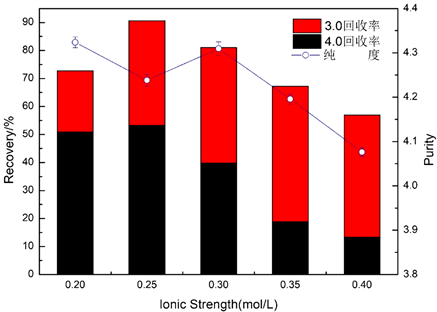
Figure 2. Effect of ionic strength on the purity and recovery of phycocyanin
图2. 离子强度对藻蓝蛋白纯度和回收率的影响
3.1.3. 洗脱速度对柱色谱纯化藻蓝蛋白的影响
图3为洗脱速度对藻蓝蛋白纯度和回收率的影响图。由图3可知,纯度随着离子强度的增加而先增大后减小,在洗脱速度为5 mL/min时纯度达到最高为4.25;试剂级藻蓝蛋白回收率随着洗脱速度的增加先增大后减少,在5 mL/min时达到最大为57.41%;藻蓝蛋白总回收率随着离子强度的增加先增加后减少,在4mL/min时达到最大为85.62%,但总体相差不大。由于洗脱速度影响色谱柱的柱效,过慢会降低分离速度,增加样品过柱时间,增加样品分散度,导致峰宽增加;过快会降低分离效果和容量。结果表明洗脱速度为5 mL/min时,色谱柱柱效与分离速度适当,洗脱峰不会过宽或过尖,纯度与回收率比较高,分离效果较好。综合比较,最适洗脱速度应为5 mL/min。
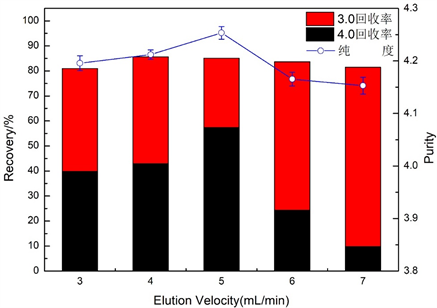
Figure 3. Effect of elution rate on the purity and recovery of phycocyanin
图3. 洗脱速度对藻蓝蛋白纯度和回收率的影响
3.1.4. 进样浓度对柱色谱纯化藻蓝蛋白的影响
图4为样品浓度对藻蓝蛋白纯度和回收率的影响图。由图4可知,纯度随着样品浓度的增加而先增大后减小,在样品浓度为1 mg/mL时纯度达到最高为4.19;试剂级藻蓝蛋白回收率随着洗脱速度的增加先增大后减少,在1 mg/mL时达到最大为39.80%;藻蓝蛋白总回收率随着离子强度的增加先略微减少后增加,在8 mg/mL时达到最大为86.98%,但总体相差不大。由于样品浓度会通过样品黏度影响分离效果,过低会影响富集效果,难以分离出高浓度的藻蓝蛋白;浓度过高则会超过色谱柱的负荷能力,会降低分辨率、增加峰宽,难以分离出高纯度的藻蓝蛋白,甚至会降低色谱柱的使用寿命。结果表明样品浓度为1 mg/mL时,藻蓝蛋白的浓度和纯度均较高,分离效果较好。综合比较,最适样品浓度应为1 mg/mL。
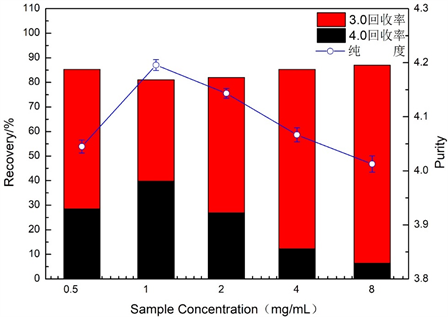
Figure 4. Effect of injection concentration on the purity and recovery of phycocyanin
图4. 进样浓度对藻蓝蛋白纯度和回收率的影响
3.2. 藻蓝蛋白纯化过程的机理分析
3.2.1. 纯化过程中藻蓝蛋白的紫外-可见光谱特征分析
图5为实验工艺流程中各工艺阶段中藻蓝蛋白样品的紫外–可见吸收光谱图。由图5可知,一步盐析工艺与粗提液的峰形基本相同,但强度略低,这表明一步盐析工艺会去除部分杂蛋白及少量藻蓝蛋白,使得藻蓝蛋白的纯度略有上升。二步盐析工艺会伴随有红移现象:蛋白质吸收峰由264 nm红移至276 nm处;藻蓝蛋白副吸收峰由332 nm红移至360 nm处;这表明二步盐析将藻蓝蛋白从溶液中沉淀,在此过程中去除了大量核酸,因此会出现上述红移现象 [12] 。同时蛋白质吸收峰强度下降,藻蓝蛋白典型吸收峰(620 nm处)强度上升,杂蛋白也被大量去除,藻蓝蛋白的纯度显著上升。柱色谱工艺使得蛋白质吸收峰强度进一步下降,藻蓝蛋白典型吸收峰与副吸收峰强度显著上升,同时峰形由对称变为非对称,这表明柱色谱工艺进一步去除大量杂蛋白,使得藻蓝蛋白纯度达到试剂级。
3.2.2. 纯化过程中藻蓝蛋白的红外光谱特征分析
图6为实验工艺流程中各工艺阶段中藻蓝蛋白样品的红外吸收光谱图。由图6可知,1658 cm−1处为νC=O的吸收峰,1537 cm−1处为反式酰胺构型中N-H的吸收峰,1400 cm−1为顺式酰胺构型中N-H的吸收峰 [13] ,这表明粗提液中蛋白质具有α-螺旋和β-折叠两种结构。一步盐析工艺由于加入大量硫酸铵,νN-H导致3421 cm−1峰频率向低频方向移动,1400 cm−1峰强度大幅度增加,表明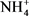 对样品红外吸收的干扰;同时出现νS=O的吸收峰(1112 cm−1)和νS-O的吸收峰(617 cm−1),对应
对样品红外吸收的干扰 [14] ;硫酸铵的大量加入会扰乱蛋白质的二级结构。二步盐析工艺后,藻蓝蛋白溶液中硫酸铵浓度下降。经过柱色谱工艺后,已充分脱盐;从C=O 基团所在峰的位置、形状(1658 cm−1处)表明藻蓝蛋白主要以缔合体形式存在,1537 cm−1处的吸收峰表明藻蓝蛋白二级结构以α-螺旋为主。
对样品红外吸收的干扰;同时出现νS=O的吸收峰(1112 cm−1)和νS-O的吸收峰(617 cm−1),对应
对样品红外吸收的干扰 [14] ;硫酸铵的大量加入会扰乱蛋白质的二级结构。二步盐析工艺后,藻蓝蛋白溶液中硫酸铵浓度下降。经过柱色谱工艺后,已充分脱盐;从C=O 基团所在峰的位置、形状(1658 cm−1处)表明藻蓝蛋白主要以缔合体形式存在,1537 cm−1处的吸收峰表明藻蓝蛋白二级结构以α-螺旋为主。
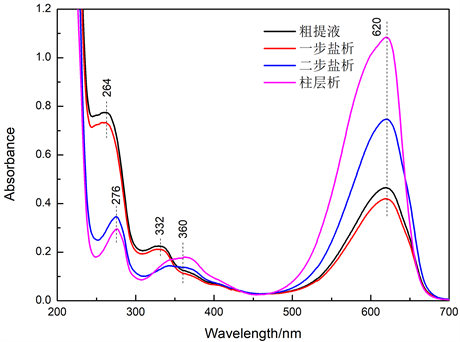
Figure 5. UV-visible absorption spectrum of each process
图5. 各工艺紫外–可见吸收光谱图
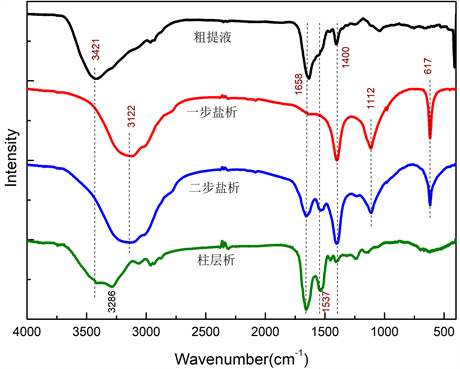
Figure 6. Infrared absorption spectrum of each process
图6. 各工艺红外吸收光谱图
4. 结论
CellufineA-500纯化藻蓝蛋白实验的最适单因素条件分别为pH 7.0、离子强度0.25 mol/L、洗脱速度5 mL/min、进样浓度1 mg/mL,藻蓝蛋白纯度最高可达4.25,试剂级藻蓝蛋白回收率最高为57.41%。
紫外–可见吸收光谱表明一步盐析工艺去除了少量杂蛋白和藻蓝蛋白,吸收峰强度降低;二步盐析工艺去除了大量核酸和杂蛋白,吸收峰发生红移现象;柱色谱工艺进一步去除杂蛋白,得到试剂级藻蓝蛋白,620 nm处吸收峰形发生改变。红外吸收光谱表明整体工艺去除的杂蛋白二级结构以β-折叠为主,硫酸铵的大量加入会扰乱蛋白质的二级结构,但最终硫酸铵等添加物会被有效去除。
基金项目
感谢国家“十二五”科技重大专项(2012ZX07103-004)与博士专项科研基金(JZ2018HGBZ0145)资助。
NOTES
*通讯作者。