1. 引言
CO2作为含量最大的温室气体,其产生“温室效应”越来越被人们所关注。目前相当一部分排放源(工业废气、汽车尾气、动植物呼吸等)所排放的CO2浓度较低,然而小部分基于化石燃料的工业源排放浓度却非常高 [1] 。近期统计数据表明,91%的人类活动CO2排放来自化石燃料燃烧和水泥制造行业,约合334亿吨。由2013年国际能源机构IEA更新的CO2排放量数据显示,中国以29%的全球碳排量份额“领跑”2012年世界CO2排放量,份额呈逐年增长态势。由此可见,中国在碳减排方面面临前所未有的国际压力。另一方面,虽然CO2是引起温室效应的主要气体之一,但同时也是一种潜在的碳资源,作为化工原料、致冷剂、油田增产剂、惰性介质、溶剂和压力源等在国民经济各部门有着广泛的用途 [2] 。因此,开发经济高效的CO2捕集技术并进行分离回收利用,对于实现经济可持续发展和营造良好的全球环境具有重要意义。
目前处于应用和研发阶段的CO2捕集方法主要有吸收分离法、膜分离法、低温蒸馏法和吸附分离法等 [3] [4] [5] [6] 。相对于其它方法而言,吸附分离用于碳捕集有诸多优点:1) 吸附剂较大的比表面积能脱除低浓度碳,还能脱除微量的杂质;2) 种类众多的吸附剂或经改性的吸附剂有很高的CO2选择吸附性能;3) 吸附剂可通过脱附再生从而重复使用、使用周期长,且固体吸附剂不存在溶剂损失、溶剂回收和腐蚀问题;4) 对于大批处理的装置还有投资小、能耗低、工艺条件容易调节、操作灵活方便等优点。由于工业排放气中CO2含量较低,所以综合各碳捕集方法的适用条件,用吸收分离法、膜分离法和低温蒸馏法对工业排放气进行碳捕集都是不太经济的。在这种情况下,吸附分离法突显出其竞争力;而且随着对吸附剂研究的深入,吸附分离法将能更好地适用于类似烟道气类的低CO2浓度、中低压、较宽温度范围的工业气体碳捕集。
吸附分离法进行CO2捕集的核心是高效低成本的吸附剂材料,目前国内外研究人员已开展了广泛的研究工作,其中包括传统的炭材料、沸石分子筛等,以及新型的金属有机框架材料(MOF)、咪唑酯骨架结构材料(ZIFs)等 [7] [8] [9] 。研究结果表明,上述材料的吸附量可以达到4~20 wt%,选择性在5~50之间。但是工业排放气源普遍是低压、低浓度的情况,其中大部分是N2为主要成分的其它组分,这就使得吸附剂对CO2的吸附量显著下降。因此,开发更高选择性的吸附剂是目前研究的重点。
本文针对CO2和N2的分子动力学直径差异(CO2为0.330 nm、N2为0.364 nm),以位阻效应为分离机理,通过不同程度的K+离子交换对4A沸石分子筛进行改性,从而调整吸附剂的孔道结构,获得高选择性的Na/K A型CO2吸附材料。
2. 实验
2.1. 吸附剂制备
取一定量的4A沸石分子筛放入浓度为0.250~3.251 mol/L的KCl溶液,在298.15 ± 1 K恒温条件下,以搅拌速率800 r/min进行磁力搅拌,搅拌时间为0.5 h,使其形成悬浮液,具体条件见表1,其中样品1到样品5的交换率逐渐增加;进而使用TDL-80-2B式离心机对其进行离心分离,离心时间设定2 min,转速为3500 r/min;得到的清液过滤后使用ICP-MS检测其离子浓度,确定交换率;得到的分子筛沉淀使用蒸馏水进行充分润洗后,放入马弗炉进行焙烧,温度为773.15 K,焙烧时间8 h,然后取出立即放入干燥器中冷却至常温待用。

Table 1. Modified Na/KA zeolite with different preparation conditions
表1. 不同条件下制备Na/KA型改性沸石分子筛
2.2. 吸附平衡及动力学测试
采用基于容积法的全自动吸附仪器PCTPro2000 E&E,测试CO2、N2纯气体在上述吸附剂样品的吸附平衡和吸附动力学数据。其中,平衡吸附量数据测试压力在0~1 MPa之间,温度为293.15 ± 0.1 K;动力学测试的平衡压力控制在0.02~0.07 MPa内,温度为293.15 ± 0.1 K。
3. 结果与分析
3.1. 吸附平衡
图1和图2分别给出了293.15条件下,CO2、N2纯气体在5组不同交换条件下制备的改性沸石分子筛样品上的吸附平衡数据。可以看出,所得到的吸附等温线均属于典型的I型等温线。随着交换率的增加,纯CO2和N2气体的吸附量呈下降趋势,其中样品3、样品4和样品5对N2的吸附量显著降低,说明此时吸附剂的孔径调节已具备了择形吸附的功能。
本文采用Langmuir-Freundlich (L-F)模型对其进行拟合
(1)
其中n为给定压力p下的平衡吸附量,n0是对应温度下气体的饱和吸附量,b、q为L-F模型参数,b可以表征吸附剂表面与吸附质分子之间的相互作用,q可以表征吸附剂表面势场的不均一性,通常在0~1之间。
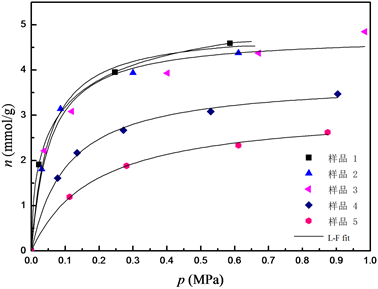
Figure 1. Adsorption isotherms of pure CO2 on sample 1 to sample 5
图1. 纯CO2在吸附剂样品1至样品5上的吸附等温线
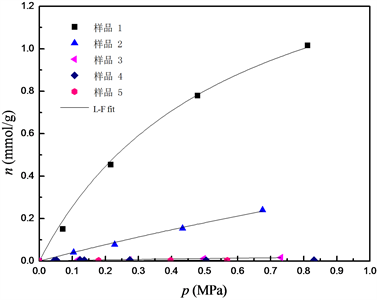
Figure 2. Adsorption isotherms of pure N2 on sample 1 to sample 5
图2. 纯N2在吸附剂样品1至样品5上的吸附等温线

Table 2. The L-F model fitting of pure CO2 and N2 on various zeolites
表2. L-F模型拟合纯CO2和N2在各样品上的吸附等温线
表2给出了L-F模型的拟合结果。可以看出,各吸附剂饱和吸附量n0和参数b均随K+交换率的逐渐增大而减小,特别是当交换率超过14.7%时,N2的饱和吸附量呈显著下降趋势。这是因为对4A分子筛进行K+交换时,K+离子直径大于Na+,故随着样品中Na+逐步被交换,分子筛孔口尺寸逐渐缩小,从而表现出对CO2和N2分子的择形筛分性质。当4A分子筛中K+含量大于40%时,其有效孔径将由最初的0.4 nm左右下降到接近于0.3 nm,即为3A型分子筛 [10] 。而模型参数q基本上都接近于1,表明各吸附剂均不存在较宽的孔径分布 [11] 。利用上述数据,考察了不同样品的吸附选择性,并加入商品4A和3A分子筛(Linde公司,其中K+交换率4A和3A分别为0%和85%)的数据进行对比,见图3。可以看出,由于4A孔径较大,会同时吸附CO2和N2,其吸附选择性ϕ (ϕ = (x1×y2)/(x2×y1),xi和yi分别为组分i在吸附相和气相的摩尔分率)最低,在15以下;K+交换率为10.2%和12.8%的分子筛吸附选择性有一定增加,但低于100;K+交换率为14.7%的分子筛选择性最佳,0.1 MPa和0.5 MPa平衡压力时分别为627和567;随着K+交换率继续上升,N2已近似不吸附,但CO2吸附量也随孔径变小而减少,使得选择性呈下降趋势。
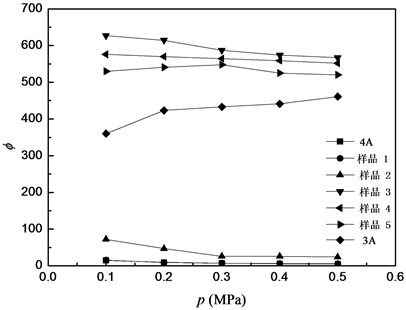
Figure 3. TheCO2/N2 selectivity on various zeolites at 293.15 K
图3. 293.15 K下不同沸石上CO2/N2吸附选择性
3.2. 吸附动力学
吸附分离过程中吸附速率也是一个重要的吸附剂性能指标。本文测定了纯组分CO2在室温293.15 K、进气压力在0.1 MPa条件下的不同K+交换率A型沸石分子筛的动力学实验数据,如图4所示。
由图4可以看出,CO2在不同吸附剂上的吸附速率存在显著差异,达到平衡的时间则在10 min到120 min不等。当K+交换率 ≤ 14.7%时,CO2的吸附速率较快,其瞬时吸附量在短时间内显著增长,10 min后已基本接近于平衡吸附量;而当K+交换率 > 14.7%时,例如样品5的K+交换率为29.3%,此时100 min内仍未达到吸附平衡。因此当吸附剂孔径过小时,虽然吸附剂对CO2-N2体系具有位阻效应且N2的吸附量很低,但CO2的吸附速率也受到较大影响。
本文采用Fick扩散理论模型分析上述吸附速率数据 [12] :
(2)
其中r为吸附剂的颗粒半径,Dc为颗粒上的气体扩散系数,q(r, t)为吸附相的浓度。通过最小二乘拟合得到了不同样品上的扩散系数数据,见表3。
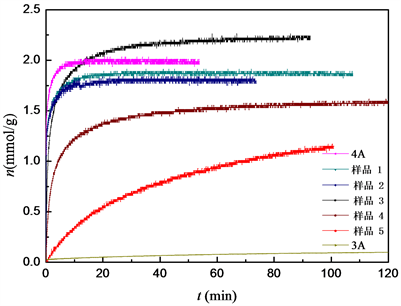
Figure 4. The kinetic adsorption of CO2 on various zeolites
图4. CO2在不同沸石分子筛上的吸附动力学

Table 3. Kinetic adsorption data simulation of CO2 by the Fick Law
表3. Fick模型拟合CO2在改性沸石上的吸附动力学
由Fick模型的定义,扩散系数Dc代表了气体分子在吸附剂孔道内的扩散程度,其与吸附剂微观结构和温度有关。Dc的数值越大,表明扩散速率越快,传质阻力越小。从表3中可以看出,在相同温度下,随着K+交换率的上升,Dc的数值逐渐减小,特别是当K+交换率 > 14.7%时,其数值下降幅度较大,从而会对分离的效果产生不利影响。
4. 结论
本文通过离子交换法对4A沸石分子筛进行改性,制备一系列高选择性的CO2吸附剂。吸附平衡和吸附动力学的实验研究和理论分析表明,利用K+离子交换Na+离子,缩小分子筛的孔径,可使4A分子筛具有对CO2和N2分子择形筛分的作用,其中交换率为14.7%的改性分子筛综合性能最好,吸附选择性可以达到600左右并具备较好的动力学性能。
基金项目
本工作由江苏省低维材料化学重点建设实验室开放研究基金(JSKC17006)资助。
NOTES
*通讯作者。