1. 引言
油菜是世界各地栽培的四大油料作物之一 [1] (大豆、油菜、花生、葵花籽),也是我国主要种植且具有代表性的食用油料作物之一,在我国占据极其重要的地位,种植面积和总产量在世界名列首位 [2] [3] 。随着杂交种产量优势不断被挖掘与应用,越来越多的种植户青睐杂交种,而杂交种子的纯度是有效保障农户收入和权益的前提。商品杂交种纯度主要受以下因素影响:大田制种时隔离条件不严或田间杂株去除不彻底导致不同品种间串粉 [4] ;去雄不彻底导致母本自交或者不育系受温度、光照的影响产生微量花粉自交 [5] ;父本砍除不彻底导致混杂父本种子;收种、晒种时机械混杂其他种子等。SSR分子标记技术因其易于操作、特异性强、共显性遗传、稳定性高 [6] [7] [8] 等方面的优点,可有效区分上述商品杂交种中混杂的父本、母本等植株,被运用于多种作物的种子纯度检测,如油菜 [9] [10] 、水稻 [4] 、玉米 [11] [12] [13] 、苦瓜 [14] 、榨菜 [15] 。近年来,为响应国家绿色高效、减施化肥的可持续农业发展政策,广西自治区利用水稻冬闲田大力发展冬季绿肥,甘蓝型油菜因其生物量大、翻耕后茎叶易沤烂等优点得到大力推广。甘蓝型油菜利油杂3号于2018年6月获得农业农村部种子管理局登记,本课题组在广西经过连续2年引种观察,甘蓝型油菜利油杂3号适合晚稻–绿肥–早稻的耕作制度,有在广西自治区推广应用的潜力,因此,有必要开发适合鉴定甘蓝型油菜利油杂3号种子纯度的分子标记,为绿肥种子纯度测定提供技术保障。
本试验以利油杂3号及其父母本为材料,利用SSR分子标记技术鉴定甘蓝型油菜利油杂3号种子纯度,筛选出稳定性高、特异性强的SSR引物,以建立稳定、可靠的利油杂3号纯度鉴定体系,为后续大田推广应用奠定基础。
2. 材料与方法
2.1. 实验材料
利油杂3号及其亲本种子均由湖北利众种业科技有限公司提供。其母本T21为细胞质雄性不育系,父本P12-7为恢复系。筛选出的两对共显性分子标记引物均为课题组前人设计合成,序列分别为:BN12A (F: GCCGTTCTAGGGTTTGTGGGA R: GAGGAAGTGAGAGCGGGAAATCA);CB10099 (F: CTTCCCCTTTCATCGAACT R: TAGAAGCATTTGGAAACGCA)。
2.2. DNA提取及浓度检测
取F1、父本及母本种子,均匀放入发芽盒置于种子发芽箱中萌发,早晚各浇水一次保湿,发芽7天后取单株幼芽上半部分放入研钵中,加入0.8 ml CTAB裂解液(100 mmol/LTris HCl,pH = 8.0;50 mmol/L EDTA,pH = 8.0;500 mmol/L NaCl),磨成匀浆后转入2.0 ml离心管;65℃水浴30 min;冷却后加入等体积氯仿:异戊醇(24:1),4℃、10,000 r/min离心10 min,收集上清液约800 μl;加入等体积的24:1,10,000 r/min离心10 min,收集上清液500 ul,加入2倍体积预冷的无水乙醇,−20℃沉淀DNA 1 h以上;10,000 r/min离心10 min,弃上清液后加入75%乙醇漂洗两次;倒扣干燥后加入50 ul ddH2O溶解;4℃保存。
用超微量紫外分光光度计(Thermo NANODROP 2000,USA)测定样品DNA浓度并观察260 nm和280 nm波长吸光度比值,稀释至25 ng/ul保存于−20℃备用。
2.3. SSR反应体系
反应液总体积为10 ul,Green Taq Mix包括Taq DNA Polymerase、dNTPs,PCR反应体系:Green Taq Mix 5 ul,左右引物(5 um)各0.25 ul, 50 ng DNA模板,加ddH2O至10 ul。Green Taq Mix购自南京诺唯赞生物科技有限公司(Vazyme Biotech Co., Ltd.),引物由华大基因(深圳)合成。
2.4. SSR反应程序
SSR 反应程序为:94℃预变性 5 min;94℃变性45 s,51℃/59℃退火45 s,72℃延伸1 min,32个循环;72℃延伸10 min,4℃保存。
2.5. 7%非变性聚丙烯酰胺凝胶电泳
在每管扩增产物中加入2 ul 6 × loading Buffer,在1 × TBE电泳缓冲液进行聚丙烯酰胺凝胶电泳(600 V,200 mA,100 W 30 min/①600 V,200 mA,100 W 10min;②130 V,80 mA,50 W 60 min)。银染显色读取条带,拍照保存。
2.6. 引物筛选
随机选取母本、父本20株单株DNA等量混合,构建父、母本DNA样品混合基因池,按照上述PCR反应程序及扩增产物检测方法进行亲本差异引物筛选。再用筛选出来的引物进一步在少量杂交种群体中进行验证,在亲本间表现出差异条带且在杂交种中表现为共显性的引物即可用于利油杂3号纯度鉴定。
2.7. 杂交种纯度鉴定
利用筛选获得的在杂交种及双亲间表现稳定,且杂交种带型表现为亲本互补带型的引物BN12A、CB10099,鉴定分析杂交种材料的纯度。根据扩增带型,与母本条带相同的记为母本带型,与父本条带相同的记为父本带型,综合父、母本条带的记为杂交种带型。
杂交种纯度 = (样本总数 − 母本带型样本数 − 父本带型样本数)/检测样本总数 × 100%。
于初花期至盛花期调查大田植株育性与株型,进行鉴定、记录分析,计算大田杂交种纯度。
大田调查杂交种纯度 = (调查样本总数 − 不育株数)/调查样本总数 × 100%。
3. 结果与分析
3.1. SSR引物筛选
利用43对筛选自前人实验结果中表现较好的SSR引物在亲本中进行扩增,所有引物均能扩增出条带,仅有BN12A、CB10099在亲本间扩增出的带型具有明显差异,进一步利用F1植株进行验证发现BN12A、CB10099在F1中出现双亲特异互补带型(图1),这2对引物可用于利油杂3号纯度鉴定。

Figure 1. Amplification results of Liyouza No. 3 hybrids and their parents with two SSR primers. P1: Sterile line T21; P2: Restorer line P12-7; F1: Liyouza No. 3 hybrids
图1. SSR引物在利油杂3号及其亲本中的扩增图谱。P1:母本T21;P2:父本P12-7;F1:利油杂3号不同单株
3.2. 杂交种纯度SSR分子标记鉴定
利用引物BN12A与CB10099分别对137株利油杂3号杂种群体进行PCR扩增(图2)。结果表明,BN12A在137株杂交种样本出现父母本特异互补的杂交种带型共117株,父本带型4株,母本带型16株,杂交种纯度为85.40%;CB10099则出现父母本特异互补的杂交种带型共121株,父本带型2株,母本带型14株,杂交种纯度为88.32% (表1)。

Table 1. Purity of hybrid Liyouza No. 3 identified by SSR markers
表1. 利油杂3号杂种纯度的SSR分子标记结果
*:综合两对引物的跑胶结果,同一个油菜单株下,如果两对引物所呈现的带型一致为P1或者P2,则统一记录为P1或者P2;如果其中一对引物呈现出F1带型,另一对是P1或者P2带型,则统一记录为F1。
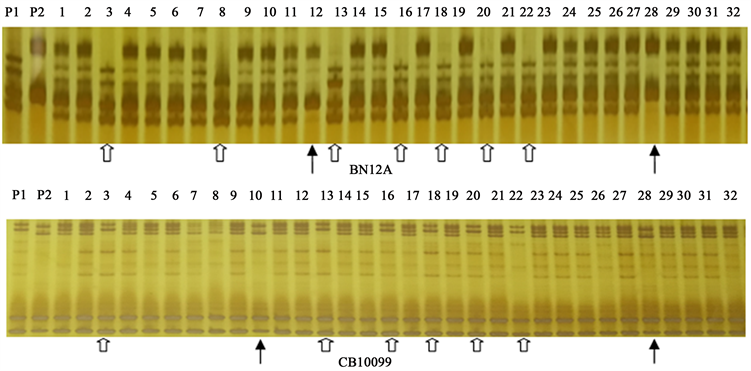
Figure 2. PCR results of partial Liyouza No. 3 amplificated by two SSR primers. P1: Sterile line T21, P2: Restorer line P12-7, F1: hybrid Liyouza No. 3,: Band of Sterile line;: Band of Restorer line; Unlabeled: hybrids
图2. 部分F1植株利用引物BN12A与CB10099进行PCR扩增的效果。P1:母本T21;P2:父本P12-7;1-32:利油杂3号杂种群体; :母本带型株; :父本带型株;未标注:杂交种
在137个单株中,两对引物鉴定出的杂株,部分结果一致,如图2中3、13、16、18、20、22共6个单株带型均为母本带型,而12和28号单株为父本带型;另外一共有12个单株在两对引物中呈现出不同的结果:106、107号单株在引物CB10099中的带型同F1,在BN12A中同P2;8、10、38、43、72、86、94、111、112、113号单株在引物CB10099中的带型分别是F1、P2、F1、F1、P1、P1、F1、P1、F1、F1,在BN12A中的带型分别是:P1、F1、P1、P1、F1、F1、P1、F1、P2、P1 (图2、图3)。
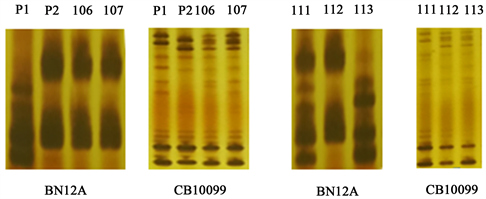
Figure 3. Partial plants identification results of Liyouza No. 3 detected by two s SSR primers. P1: Sterile line T21; P2: Restorer line P12-7; 106-107, 111-113: Five plants of Liyouza No. 3
图3. 两对SSR引物鉴定出的利油杂3号部分单株结果。P1:母本T21;P2:父本P12-7;106-107、111-113:5个利油杂3号单株
比较2对SSR引物纯度鉴定结果,两者均存在单一引物鉴定为母本或父本,而另一引物鉴定为杂交种的现象。将在同一个油菜单株两对引物所呈现的带型一致为母本带或父本带,则统一标记为P1或者P2,如图2中3、13、16、18、20、22、28号单株等;如其中一对引物呈现出F1带型,另一对是母本带或父本带,统一记为F1,如图3中106-107和111-113。综合比较2对引物鉴定结果,合计杂交种带型125株,父本带型1株,母本带型11株,杂交种纯度为91.24%。
3.3. SSR标记室内鉴定结果与大田鉴定结果比较
本研究中BN12A和CB10099等2对引物对利油杂3号纯度鉴定结果相对大田鉴定93%的纯度分别低了7.6%和4.68%,两引物结合的杂种纯度则低1.76%。如再加上父本带型单株,三者相对大田鉴定的纯度分别低了4.68%,3.22%和1.03%。说明不同引物鉴定的标记位点在亲本群体中的纯合度对杂种纯度鉴定结果存在不同的影响。所有分子标记鉴定结果均表明该批次甘蓝型油菜利油杂3号杂种纯度符合商品种质量标准。同时,鉴定结果中的母本带型比率均大于父本带型比率,说明影响该批次利油杂3号大田制种纯度的主要影响因素是母本微粉自交,后续可进一步控制母本微粉提高种子纯度。
4. 讨论
4.1. 影响利油杂3号杂交种纯度的原因
从鉴定结果可以看到,不管是2对SSR分子标记鉴定结果还是田间调查结果均发现不育株占较大比例,分别是11.68%、10.22%和7%,同时2对引物的不育系比率均比恢复系比率高出8.76%,说明不育系微粉自交结实和少许父本杂种混入是导致该批次种子纯度降低的主要原因,这与前人 [16] 所得结论一致。后续大田制种时可调整母本播期,促使不育系在高温时段开花,降低其微粉自交结实,若发现其雄蕊带有花粉应及时人工去雄或者化学杀雄 [10] ,确保母本高度不育,如母本比父本花期早,可及时打顶。此外,可酌情增加父本比例,提高父本花粉比例。收种时注意与父本隔离,避免混入恢复系种子,影响种子纯度。
4.2. 引物鉴定结果与引物的选择
本次研究发现2对引物纯度鉴定结果(85.40%、88.32%)均低于田间纯度鉴定结果(93%),与卢虹等 [10] 、王同华等 [17] 研究结果相符。根据扩增图谱发现,利油杂3号纯度鉴定的假杂种主要来自母本自交种子和少许父本种子混杂;而大田鉴定从育性与形态上较难区分父本与杂交种,主要通过统计不育株数计算大田纯度结果,因此田间鉴定的假杂种主要是母本自交结实,没有父本种子混杂,此外鉴定人的经验水平也会影响大田纯度调查结果,因此大田纯度调查结果高于分子标记室内鉴定结果。这说明利用SSR分子标记鉴定的纯度结果比田间表型鉴定结果更加真实可靠。
由于亲本繁殖过程中也可能存在机械混杂、田间滋生苗等各种因素影响亲本的纯度,或亲本群体个别单株某些位点尚未完全纯合,从而使得最终大田制种的杂交种群体在某些分子标记位点表现为杂合,而这种杂合的程度与亲本及亲本混杂株间的遗传差异有关,通常不同引物揭示的标记位点间的杂合度是不一致的,这就导致本研究中两条单引物纯度鉴定结果不一致,且均明显低于大田纯度调查结果。实际研究过程中可通过多引物联合鉴定矫正。如本研究中综合二对SSR引物的带型结果,杂交种纯度矫正为91.24%,父本带型株与杂交种带型株总计91.97%,与大田调查结果93%基本一致,可以预见,如果再增加1~2对甚至更多的SSR引物进行鉴定,在不存在父本混杂的情况下可将结果矫正至大田鉴定的水平。总之,只用一对引物来检测种子纯度会存在很大误差,因为单位点单引物检测不育系率与恢复系率会偏高,最后会误判种子的真实纯度。为了能够更科学、严谨地检测种子纯度,避免出现因为不同引物的检测位点不一致以及其他花粉或者自然因素干扰,导致在一对引物上检测为真杂种,在其他引物中则是假杂种的情况,至少需要两对SSR位点来共同检测 [18] ,综合判断种子纯度。
5. 结论
本试验利用2对条带清晰且均为共显性的SSR引物(BN12A、CB10099)对利油杂3号进行种子纯度鉴定。BN12A在137株杂交种样本出现父母本特异互补的杂交种带型共117株,父本带型4株,母本带型16株,杂交种纯度为85.40%;CB10099则出现父母本特异互补的杂交种带型共121株,父本带型2株,母本带型14株,杂交种纯度为88.32%。比较2对引物纯度鉴定结果,两者均存在单一引物鉴定为母本或父本,而另一引物鉴定为杂交种的现象。综合二者的带型结果杂交种带型共125株,父本带型1株,母本带型11株,杂交种纯度为91.24%。父本带型株与杂交种带型株总计比例为91.97%,与大田调查结果93%基本一致。说明该批次甘蓝型油菜利油杂3号杂种纯度符合商品种质量标准。同时,利用分子标记进行室内杂种纯度鉴定时,需要综合两对及以上SSR标记扩增的结果对杂交种纯度进行综合评价。
基金项目
广西水稻冬闲田利用开发研究(桂科协[2016]Z-36)。
NOTES
*通讯作者。