1. 引言
随着生物医学科技的发展,生物医学显微测量需求越来越大。在显微测量方面,对于生物组织及细胞样本的观测长期停留在定性观察的基础上。定性测量虽能直观地表达动态变化,但是从测量的角度出发,定量测量能够更加精准地反映变化的过程,为生物医学的发展提供更精准的依据。数字全息显微术是一种基于数字全息成像原理发展出的新型显微技术。利用数字全息显微技术能够快速获得样本三维动态定量形貌信息,并且不会对样本造成损害。在生物医学显微测量方面,定量相位数字全息显微已经应用于多种细胞类型的成像,其中包括个体化治疗卵巢癌细胞 [1] [2] 、成纤维细胞 [3] 、有壳变形虫 [4] 、硅藻骨架 [5] 、血红细胞 [6] 。它也应用于各种细胞动力学的研究,例如在胰腺肿瘤细胞中各种药物引起的变化 [7] 。数字全息显微镜用来对血红细胞、大鼠袋鼠肾上皮细胞(PTK2)和金鱼视网膜杆细胞进行监测,能够定量评定损伤,实时修复细胞和细胞器 [8] ,测量折射率 [9] 。
以上的测量研究结果证实,数字全息显微在生物显微动态测量领域有定量、非接触的优点,但测量对象着眼于厚度与折射率。实际上,生物细胞是较为复杂的样本,对于折射率的测量既使测量过程复杂,又不能进行标定溯源,因此其准确性有待考量;而厚度的测量准确性又依赖于折射率的准确性。
因此本文提出用光程长作为定量标定生物细胞动态过程的参考量。数字全息显微技术对相位的变化具有亚纳米级的分辨力,光程长与相位成线性比例,利用数字全息显微技术测量光程长,测量精度亦能达到亚纳米,可实现纳米生物学、纳米生物医学的测量要求。本文针对活体生物细胞,以定量的光程长信息作为反映生命状态标志,对生物细胞的实时动态进行测量与分析。利用搭建的透射式数字全息显微系统对海拉细胞和大肠杆菌进行动态观察,获取光程长,分析光程长与细胞生命状态的关系,了解细胞的生命过程。
2. 测量系统与测量原理
图1所示为透射式数字像面全息显微系统光路示意图。激光光源(XPERAY,波长选择为690 nm)发出的光束通过中灰镜NF调节到合适光强后,被分光棱镜BS1分为两路,物光和参考光,物光束被反射镜M1折转后照射样本,透射后携带有样本的信息被显微物镜MO1 (Mitutoyo, 50×, N.A. = 0.42)放大。参考光路设置与物光路相同的显微物镜MO2,使其放置在与MO1相对一致的位置,使畸变相位易于校正。分光棱镜BS2将两路光汇合,在CCD (PX-2M30-L, Imperx)上发生干涉。BS2的轴线与光轴成一定角度,此为离轴角度,使干涉图易于分离实像与零级像的频谱。
 Laser:激光光源;NF:中灰镜;BS1,BS2:分光棱镜;M1,M2:反射镜;MO1,MO2:显微物镜。
Laser:激光光源;NF:中灰镜;BS1,BS2:分光棱镜;M1,M2:反射镜;MO1,MO2:显微物镜。
Figure 1. Schematic of transmission digital holographic microscope
图1. 透射式数字全息显微系统光路示意图
物光波与参考光波在CCD面上形成干涉图,即为数字全息显微图,其强度为
(1)
是全息面的坐标。
和
分别是传播到全息面的物光波和参考光波的复振幅。*代表复共轭。因此重构物光波的复振幅过程为
(2)
式中
代表傅立叶变换,通过傅立叶变换得到记录全息图的频谱,
为逆傅立叶变换计算。
是一个窗函数,用低通滤波的方法在频谱面上将
的频谱滤出,所用窗函数的大小与位置与频谱图上的频谱能量分布有关。
是一个相位校正函数,d是重构距离。
,
是测量光源的波长。
,
,M和N是全息图x向和y向的像素数,
和
是全息图x向和y向的像素大小。重构面上的相位
为
(3)
光程长可根据相位获取:
(4)
式中,
是相位,
是测量光源的波长,
是光程长。
3. 实验系统与测量结果
图2为透射式数字全息显微系统实物图。
利用图2所示的透射式数字全息显微系统对海拉细胞进行动态观测,观察生长及死亡的过程。
对已经在培养皿培养成长成熟的细胞进行脱壁、分散、离心之后重新分装到新的培养皿中,加入新

Figure 2. Setup of transmission digital holographic microscope
图2. 透射式数字全息显微系统实物图
鲜的培养液(DMEM)和双抗(青霉素和链霉素),在二氧化碳培养箱中继续培养。是将细胞离心出来之后加入冻存液在8摄氏度20分钟,−20摄氏度30分钟之后在−80摄氏度冻存,使得细胞可以长期保存。
利用微流控芯片对海拉细胞进行捕捉与控制。由于海拉细胞直径在15 μm以上,而普通的血细胞是在6 μm,所以从医学应用角度出发,设计圆柱阵列。圆柱阵列中圆柱与圆柱之间的距离设计为5 μm,圆柱直径为30 μm,以保证在血细胞能通过的前提下海拉细胞能够被捕捉在芯片当中。
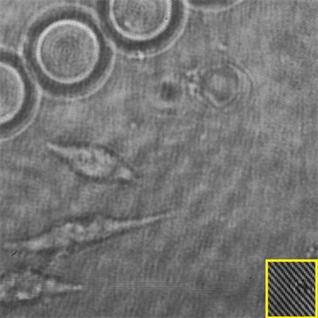 (a)
(a) 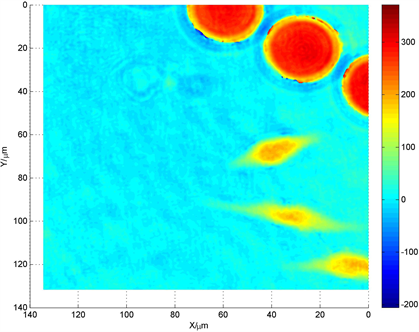 (b)
(b)
Figure 3. (a) Digital hologram; (b) The reconstructed optical path length of Hela cells in the micro-fluid chip
图3. 微流控芯片中海拉细胞的(a)数字全息显微图;(b)重构的光程长图,单位为纳米
图3(a)为微流控芯片中海拉细胞的数字全息显微图。根据透射式数字全息显微术的测量理论,可以重构出全息图的光程长分布。由于海拉细胞内部较为复杂,其折射率不是一个准确的数值,所以我们用光程长分析它的形貌与生长变化同样可以得出相应的结论。
 (a)
(a)  (b)
(b)
Figure 4. The image-plane hologram of (a) Living and (b) Dead Hela cells
图4. (a)生长与(b)死亡的海拉细胞像面全息图
由于海拉细胞具有一定的生长周期,当培养液中营养耗尽时就会死亡,因此我们记录了其生长与死亡两种状态的全息图。图4(a)为样品制备好,经过一段时间培养后,生长较好的海拉细胞。图4(b)为经过3.5小时后,已经死亡的海拉细胞全息图。
根据重构计算,得到生长与死亡的海拉细胞光程长分布图5(a)与图5(b)。从重构的光程长分布图中可以看出,原本生长时的海拉细胞为梭形,当3.5小时死亡后,海拉细胞变为球形,且光程长值明显增大,发生了形貌变化。例如图5(a)中生长中的海拉细胞最大相对光程长值221.3 nm,但死亡后的海拉细胞(图5(b))最大相对光程长值为248.7 nm。通过光程长值的变化可以定量说明海拉细胞的生命状态。
 (a)
(a)  (b)
(b)
Figure 5. Reconstructed optical path length of (a) Living and (b) Dead Hela cells
图5. 重构的海拉细胞(a)生长与(b)死亡的光程长分布图,单位均为纳米
对大肠杆菌进行测量,采用E. coli DH5α,在LB溶液中培养12h,37℃,细菌悬液的浓度为1*106 cells/ml. 收集对数期细菌,加入β内酰胺类抗生素诱导大肠杆菌增长。最后将长成的菌落放在玻片上,利用透射式数字全息显微系统对其进行观察,得到光程长图以及相位图(图6)。
 (a)
(a) 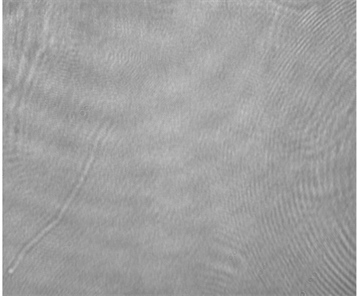 (b)
(b)
Figure 6. (a) Reconstructed optical path length and (b) phase of Escherichia coli.
图6. (a) 大肠杆菌光程长图和(b)相位图
4. 结论
本文利用透射式数字全息显微系统对海拉细胞进行动态测量,观察其生命动态,并利用光程长这一定量参量的变化反映海拉细胞的生命状态,对生物细胞动态测量提供了一种精确的定量测量方法。
NOTES
*通讯作者。