1. 前言
呼吸道合胞病毒(respiratory syncytial virus,RSV)可在世界范围内引起婴幼儿、老年人、免疫受抑者严重的下呼吸道感染 [1] [2],且可造成院感爆发 [3] [4],具有较高的致病率和死亡率 [5] [6]。
病毒分离培养是鉴定病毒感染的“金标准”,同时针对病毒的防控预警、临床诊治、药物研发、疫苗研制等方面研究均需要分离培养的单克隆毒株,然而分离培养效率低下严重制约了病毒性疾病的各项研究。
M2-1由RSV基因组编码,前期研究表明M2-1是一种重要的转录延长因子,可提高转录效率,增加全长mRNA产量,且体外实验证实其对RNA序列没有特异性要求 [6] [7]。本研究利用Hep-2细胞构建稳定表达RSV M2-1蛋白的细胞株,以期获得在细胞增殖速度及RSV易感性高于原始细胞株的新细胞,为RSV临床病毒样本的分离培养提供备选细胞株。
2. 材料与方法
2.1. 病毒与细胞株
本研究中使用的RSV Long株(VR26)、人喉癌上皮细胞Hep-2 (CCL-23)均为本研究室保存。
2.2. 主要试剂
本研究使用胎牛血清、RPMI 1640培养基、0.25%胰酶-EDTA、PBS均来自Gibco公司;G418购自sigma公司;RT-PCR相关试剂以及转染试剂Lipofectamine 2000购Thermo Fisher Scientific公司;逆转录PCR试剂及荧光定量PCR检测试剂购自TAKARA公司;Taqman荧光定量PCR试剂购自广州呼研所医药科技有限公司;M2-1单克隆抗体购置Abcam公司;pcDNA3.1(+)载体由本研究室保存。
2.3. pcDNA3.1-M2-1真核表达载体构建
本研究从RSV Long株中通过RT-PCR获得M2-1基因,并通过BamHI、XbaI酶切、连接、测序鉴定等操作将其克隆至pcDNA3.1(+) (5428 bp)质粒中获得 pcDNA3.1-M2-1 (5957 bp)。
正向引物:5’-AAAGGATCCATGTCACGAAGGAATCCTTGCA-3’
反向引物:5’-AAATCTAGATCAGGTAGTATCATTATTTTTGGCATG-3’
G418耐受性分析
将细胞均匀铺到24孔板中(105个细胞/孔),细胞培养液为含终浓度100、200、300、400、500、600、700、800、900 μg/ml G418的培养基,于37℃ 5% CO2环境中培养10~14天,以细胞全部死亡的最低浓度作为 G418筛选浓度,稳定细胞系维持浓度减半。
2.4. 稳定表达株筛选
将pcDNA3.1-M2-1载体转染至Hep-2细胞,G418筛选14天,得到抗性克隆。有限稀释法得到单细胞悬液,继续使用G418筛选,得到疑似阳性克隆。
2.5. 荧光PCR鉴定M2-1的转录情况
分别配制检测Hep-2 2F5和Hep-2 RNA的RSV M2-1和内参GAPDH的mRNA的qRT-PCR 25 μl反应体系,使用下列引物序列及反应条件分析M2-1的转录情况。
反应条件如下:42℃ 5 min;95℃ 10 sec;95℃ 5 sec、60℃ 30 sec (读值)循环40个;熔解95℃ 15 sec、60℃ 30 sec、95℃ 15 sec (读值)。
2.6. Western Blot分析M2-1蛋白表达情况
培养Hep-2 2F5及Hep-2细胞(60 mm培养皿)各一皿,使用SDS裂解液充分裂解细胞;充分裂解后,13000 rpm离心5 min,加入6× SDS PAGE上样缓冲液,100℃水浴5 min,用于SDS-PAGE蛋白电泳;使用抗RSV M2-1单克隆抗体及抗GAPDH单克隆抗体进行Hep-22F5及Hep-2中M2-1 (分子量约22 KD)和内参GAPDH (分子量约36 KD)的蛋白表达检测。
2.7. MTT分析细胞增殖情况
2 × 104个细胞/孔接种24孔板,每天中午12时每孔加入5 mg/ml MTT溶液100 μl,37℃孵育4小时;吸去孔内培养基,加入200 μL DMSO,室温震荡裂解10分钟;取50 μl × 3加入96孔板,于OD490测定吸光值。
3. 结果
3.1. M2-1 稳定表达株Hep-2 2F5的建立
Hep-2细胞经G418耐受性实验,获取其筛选浓度为200 μg/ml,稳定系维持所用的浓度则减半为100 μg/ml。pcDNA3.1-M2-1真核表达载经线性化转染至Hep-2细胞后,经过G418筛选后,初步得到2F5和2C6株;经RT-PCR筛选,得到2F5株较2C6株具有明显的213 bp目标条带(图1),后续实验都使用Hep-22F5株进行。

Figure 1. RT-PCR test for M2-1 gene expression of Hep-2 2F5
图1. Hep-2 2F5细胞M2-1基因表达RT-PCR检测
经过连续20代培养后,分别使用染料法qRT-PCR (引物序列见表1)和Western blot对Hep-2 2F5中的M2-1 mRNA (图2)和蛋白进行检测(图3),证明Hep-2 2F5中稳定表达M2-1,获得稳定细胞系。
3.2. Hep-2 2F5细胞增殖速度高于Hep-2细胞
2 × 104个细胞/孔接种24孔板,经过连续6天的培养,通过MTT法分析细胞的增殖情况,得到Hep-2 2F5细胞的生长曲线(图4)。Hep-2 2F5细胞的增殖速度高于Hep-2细胞。

Table 1. Primers for real-time PCR test
表1. 荧光定量PCR检测引物序列
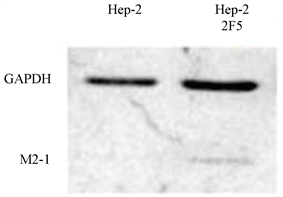
Figure 3. Western Blot test for M2-1 protein expression of Hep-2 2F5 cell
图3. Western blot检测Hep-2 2F5细胞表达的M2-1蛋白

Figure 4. The growth curve of Hep-2 2F5 detected by MTT assay
图4. MTT法检测Hep-2 2F5生长曲线
3.3. Hep-2 2F5感染RSV的特征分析
为了分析改造细胞对RSV感染与增殖特性,实验设计了使用从1000 TCID50 (E1) (RSV核酸定量为1.2 × 106 copies/ml)到10−2 TCID50 (E6) 6个梯度的病毒感染实验,时间分0 h、12 h、1天(1 D)、2天、3天、4天、5天。通过实验观察,细胞增殖方面在细胞培养24 h和36 h可见Hep-2 2F5要明显快于Hep-2 (图5),而细胞在培养总时间至5天(4 D接种病毒 + 24 h贴壁时间)时产生气泡样的空泡,并在第6天(5 D接种病毒 + 24 h贴壁时间)更明显(图6)。

Figure 5. Culture Hep-2 2F5 and Hep-2 cell for 24 h and 36 h (Optical microscope, 200×)
图5. Hep-2 2F5与Hep-2培养24 h、36 h的细胞增殖。可见光镜下(200×)
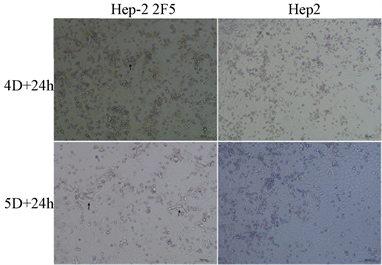
Figure 6. The vacuoles developed in Hep-2 2F5 cell after 5 and 6 days culture (Optical microscope, 200×)
图6. Hep-2 2F5培养5天和6天产生的空泡。可见光镜下(200×)
在感染RSV中,1000 TCID50 (E1) (RSV核酸定量约1.2 × 106 copies/ml) RSV接种时,Hep-2 2F5与Hep-2都能在1天内产生CPE,但前者CPE更加明显(图7)。较低滴度下RSV感染两种细胞时,攻毒两天时间后,Hep-2 2F5产生CPE的时间比原始细胞早且明显(E2~E3),而在E4及更低浓度下,Hep-2未发现CPE,而E5下Hep-2 2F5仍可见少量CPE (图8)。
E1-E4攻毒12 h后RSV在Hep-2 2F5和Hep-2两种细胞中的核酸定量平均值分别为3.41 × 105和1.34 × 105 (E1) (图9(a))、4.91 × 104和1.27 × 104 (E2) (图9(b))、2.09 × 102和1.45 × 102 (E3) (图9(c))、10和23 copies/ml (E4) (图9(d)),E5~E6在12 h未检测到RSV病毒核酸(图9(e)、9(f))。随着时间延长,高浓度E1~E2的Hep-2中RSV含量高于Hep-2 2F5,在E4及之后RSV在Hep-2 2F5中的增殖优于Hep-2 (图9)。通过对细胞中RSV核酸的定量,Hep-2 2F5在E1~E2之间RSV含量低于Hep-2;在低浓度E3-E6中则总体高于Hep-2 (图9)。
Figure 7. Development of CPE of Hep-2 2F5 and Hep-2 with RSV infection for 12 hours and 1 day under the titer of 1000 TCID50 (Optical microscope, 200×), N: Hep-2 2F5 and Hep-2 cells without RSV infection
图7. Hep-2 2F5与Hep-2感染1000 TCID50 RSV后12 h和1天的CPE。可见光镜下(200×),N为未加病毒的细胞对照

Figure 8. Development of CPE of Hep-2 2F5 and Hep-2 with RSV infection for 2 days under the titer of 100 TCID50 (E2) to 10−2 TCID50 (E6) (Optical microscope, 200×), N: Hep-2 2F5 and Hep-2 cells without RSV infection
图8. Hep-2 2F5与Hep-2感染100TCID50 (E2)至10−2 TCID50 (E6) RSV后2天的CPE。可见光镜下(200×),N为未加病毒的细胞对照
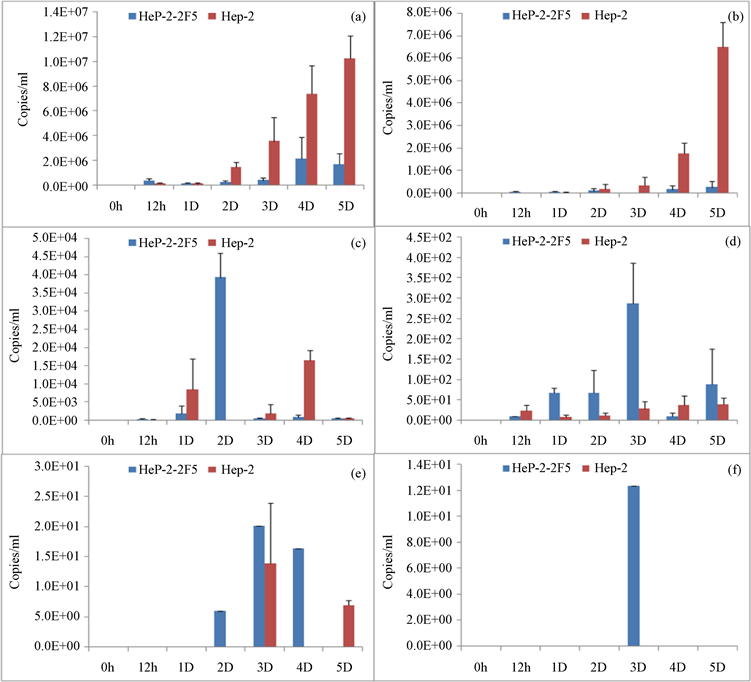
Figure 9. Detection of virus proliferation after Hep-2 2F5 infection with RSV virus by real-time PCR. (a)-(f): RSV nucleic acid content of cells with RSV infection for 0 to 5 days under the titer of 1000 TCID50 (E1)~10−2 TCID50 (E6) titer testing with real-time PCR. *Only one sample detected in total three parallels
图9. 荧光定量PCR检测 Hep-2 2F5感染RSV病毒后病毒增殖情况。(a)-(f):1000 TCID50 (E1)~10−2 TCID50 (E6)六个梯度RSV感染细胞0~5天后使用荧光定量PCR检测结果细胞中RSV核酸含量;*三个平行孔实验只一孔检出
4. 讨论
RSV是一个世界范围内引起婴幼儿严重下呼吸道感染的最常见的病原体 [1] [2],全球每年有约四百万儿童受其感染,具有较高的致病率和死亡率 [3] [4] [5]。M2-1蛋白是由RSV基因组M2基因的第一个开放阅读框编码,全长194aa [6] [7] [8]。M2-1蛋白与核蛋白N、磷酸化蛋白P和大聚合酶复合体L形成螺旋核衣壳结构与RSV基因组紧密结合 [9] [10]。对于M2-1,以往的研究主要集中在转录调控方面。M2-1蛋白与核蛋白N、磷酸化蛋白P和大聚合酶复合体L形成螺旋核衣壳结构与RSV基因组紧密结合 [10] [11] [12]。
M2-1被命名为转录抗终止因子(transcription antitermination factor),其抗终止作用主要体现在两个方面 [8] :1) M2-1可以促进单顺反子全长mRNA的合成(intragenic antitermination)主要体现在M2-1存在的情况下,长基因的转录产物全长mRNA的产量明显增加;2) M2-1还可以促进多顺反子的通读(polycistronic readthrough),其功能体现在M2-1存在的情况下,帮助RNA聚合酶跳过转录终止点(Gene-End signal)继续转录。
我们利用M2-1蛋白在RSV基因组转录中的转录抗终止作用,构建M2-1稳定表达的Hep-2细胞株Hep-2 2F5。通过RT-PCR鉴定可确定M2-1的表达(图1)。经过20代传代后,qRT-PCR以及Western blot分析(图2、图3),M2-1仍有较高的表达水平。通过显微镜观察以及细胞生长曲线的绘制,发现Hep-2 2F5细胞的生长速率较Hep-2高(图4、图5)。通过病毒的灵敏性检测,发现低Hep-2 2F5细胞比起原始细胞株Hep-2具有更高的灵敏性。较低滴度的病毒感染后,Hep-2 2F5更早出现CPE (图7、图8),且RSV核酸含量高于Hep-2,但在高滴度病毒感染中,Hep-2细胞中的病毒核酸量高于Hep-2 2F5 (图9)。
5. 小结
综上,本研究团队成功构建稳定表达M2-1蛋白的Hep-2 2F5细胞株,在用于RSV病毒培养中具有更高的灵敏度,为RSV临床病毒样本的分离培养提供灵敏度更高的细胞株。
基金项目
本研究获得广东省科技计划项目(2016A020215001)、广东省自然科学基金纵向协同项目(2018A030310401)以及国家自然科学基金青年基金(31900877)的资助。
参考文献
NOTES
*通讯作者。