1. 引言
多糖是由十个以上单糖通过糖苷键结合形成的大分子物质,广泛存在于动物、植物、微生物中。和DNA、蛋白质等大分子一样,多糖是植物维持正常生理活动必不可少的重要物质。有大量关于多糖的研究显示出植物多糖具有广泛的药理作用,如免疫调节、抗肿瘤作用、抗氧化、抗病毒、降血糖、降脂和抗辐射作用。比如,啤酒花(Humulus lupulus)多糖能显著促进MC3T3-E1细胞的增殖、分化和矿化,具有成骨作用 [1]。灰树花(Grifola frondosa)多糖通过TLR4-MyD88-IKKβ-NF-κBp65信号途径激活巨噬细胞 [2]。野生仙人掌(Opuntia dillenii Haw)多糖能抑制SK-MES-1细胞的生长,诱导细胞周期S期阻滞,还可引起细胞凋亡 [3]。凹顶藻(Laurencia obtusa)多糖对丙型肝炎病毒(HCV)的抑制率达82.36%,马尾藻(Sargassum vulgare)多糖对自由基的清除剂能力高达81.5% [4]。西府海棠(Malus micromalus)多糖对羟自由基、DPPH自由基和超氧阴离子均有不同程度的清除作用,还能提高抗氧化酶系统的活性,发挥一定的抗衰老作用 [5]。桑树(Morus alba L.)枝多糖可通过调节胰内JNK/p38途径发挥明显的降血糖作用 [6]。芦荟(Aloe vera)多糖可能通过Keap1/Nrf2/ARE信号通路对NGF激活的皮肤神经细胞PC12的UVB损伤具有修复作用 [7]。
莼菜(Brasenia schreberi)属睡莲科莼属,多年生水生植物,是中国历史悠久的药食兼用的珍贵蔬菜。莼菜嫩芽外裹有一层厚厚的透明胶质,其中的主要成分多糖 [8],也是莼菜嫩芽药用价值的主要来源。莼菜味甘性寒,具有清热、利水、消肿、解毒的功效。治热痢、黄疽、痈肿、疔疮,胃病(包括慢性胃炎,胃溃疡,胃癌等)。《医林纂要》载“除烦,解热,消痰”。《本草纲目》记载,莼菜可以消渴热痹,和鲫鱼作羹时下气止呕,补大小肠虚气,治热疸,厚肠胃,安下焦,逐水解毒。研究表明,莼菜多糖具有降血糖 [9] 、降血脂 [10] 以及抗氧化活性 [11],而莼菜多糖对癌症的抑制作用未见详实报道。本实验以湖北省利川市莼菜嫩芽为原材料,提取粗多糖,初步探究了莼菜粗多糖对Hela细胞生长的影响,提高莼菜综合利用的可能途径。
2. 材料和方法
2.1. 实验材料
新鲜莼菜嫩芽于2018年7月在湖北省利川市佛宝山基地和凉雾基地采摘,冰盒保鲜运回。Hela细胞(GDC009)购自中国典型培养物保藏中心武汉大学保藏中心。
2.2. 莼菜嫩芽粗多糖提取
新鲜莼菜嫩芽,用自来水缓流冲洗3 min,灭菌超纯水洗涤三次。放入0.1 mol/L NaOH溶液中,料液比1:2 (w/v),60℃搅拌提取1.5 h;提取液冷却至室温,过200目网筛,去除大块残渣。抽滤,取上清,用HCl调节溶液pH至7.0。Sevag法 [12] 除蛋白,用分液漏斗分离有机相和无机相,重复至离心后无蛋白层。收集上层水相,12,000 rpm常温离心10 min,留取上清,得莼菜粗多糖蛋白质层,加入四倍体积95%乙醇,4℃醇析过夜,然后12,000 rpm,4℃离心,取沉淀。用超纯水溶解沉淀,12,000 rpm,4℃离心,取上清,分装,冷冻干燥,得莼菜粗多糖固体(BSP)。
2.3. Hela细胞复苏与传代培养
取出冻存于液氮中的Hela细胞,迅速37℃水浴融化,将1 mL冻存液转至T25细胞培养瓶,加4 mL DMEM培养基,在37℃的5% CO2气氛中培养。次日用5 mL PBS轻柔洗涤细胞,换新鲜DMEM培养基。待细胞长至约106个/mL时(占瓶底85%左右),吸弃旧培养基,5 mL PBS轻柔洗涤细胞,加入1 mL胰酶(含EDTA) 37℃消化约2 min,吸弃胰酶,加入2 mL DMEM培养基,吹匀,根据所需比例留存细胞悬液,补新鲜DMEM培养基至5 mL。
2.4. MTT法测定Hela细胞生长曲线
待细胞密度长至106个/mL左右时,吸弃旧培养基,5 mL PBS轻柔洗涤细胞,加入1 mL胰酶(含EDTA) 37℃消化约2 min,吸弃胰酶,加入2 mL DMEM培养基,吹匀。对细胞悬液进行计数,将细胞悬液稀释成1000个/mL、2500个/mL、5000个/mL、7500个/mL、1 × 104个/mL、2 × 104个/mL、2.5 × 104个/mL、5 × 104个/mL、1 × 105个/mL,96孔板每孔200 µL细胞稀释液,每个浓度六个重复孔。培养24~168 h后,每孔加入20 µL MTT (5 mg/mL)。37℃孵育4 h后,吸净培养上清液,每孔加入150 µL二甲基亚砜(DMSO),90 rpm震荡10 min,用酶标仪测定490 nm处吸光度。
2.5. MTT法测BSP对细胞生长抑制率
细胞活力的测定按照Zhang et al.的方法进行 [13]。Hela细胞长至106个/mL左右时,吸弃旧培养基,5 mL PBS轻柔洗涤细胞,加入1 mL胰酶(含EDTA) 37℃消化约2 min,吸弃胰酶,加入2 mL DMEM培养基,吹匀。对细胞悬液进行计数,根据需要体积稀释细胞悬液至2 × 104个/mL。将细胞分为以下4组:1) 零对照组,只含培养基;2) 阴性对照组,加入细胞,不加多糖;3) 阳性对照组:加入细胞,50 µg/mL 5'-Fu (5'-氟尿嘧啶);4) 实验组,加入细胞和不同浓度多糖溶液。除零对照组100 µL DMEM培养基外,96孔板每孔加入100 µL细胞稀释液,6个重复孔。周围一圈填200 µL PBS溶液。4~6 h细胞贴壁,零对照组和阴性对照组每孔加100 µL 2 × 多糖溶液。每隔12 h测一组490 nm处吸光值。用以下公式计算细胞的抑制率:
细胞抑制率 = (Ac − A1)/(Ac − A0) × 100%;A0:空白组吸光度;A1:实验组(包含阳性对照组)吸光度;Ac:阴性对照组吸光度。
2.6. 吖啶橙–碘化丙啶(AO-PI)双染
吖啶橙(AO)用PBS配制5 mg/mL储存液,过滤除菌。同样方法配制3 mg/mLPI储存液。使用时,将 1 μL AO和1 μL PI储存液加入1 mL PBS混匀。用培养皿(3 cm, Nest)培养细胞,BSP处理一定时间后,吸净培养皿上清,加入500 μL染液,立即在荧光显微镜下观察细胞,蓝光激发。
2.7. RT-qPCR
细胞总RNA的提取按照总RNA小量制备试剂盒的方法进行。用反转录试剂盒对提取的总RNA进行逆转录,获得用于实时荧光定量PCR的cDNA。实时荧光定量PCR采用2xT5 Fast qPCR Mix (SYBR Green I)试剂盒,按照说明书进行操作,引物见表1。RT-qPCR采用三步法,反应程序为:95℃预变性1 min;95℃变性10 s,53℃退火15 s,72℃延伸10~15 s,40次循环。用
计算相对表达量。
3. 结果
3.1. 生长曲线确定2000个/孔作为Hela细胞培养的起始密度
Hela细胞在初始密度低于2000个/孔时,72小时内吸光值低于0.3,初始密度大于2000个/孔时,吸光值在72小时时超过0.7,均不能使吸光值与细胞密度保持良好的线性关系(图1)。初始密度为2000个/孔时,处理时间24~72 h范围内,吸光值和培养时间能呈良好的线性关系,且吸光值在0.3~0.7的范围内,能够保证吸光值和细胞密度呈较好的线性关系初始浓度(图1)。所以后续的细胞实验选用2000个/孔作为起始密度。
3.2. BSP对Hela细胞生长的抑制呈现时间和剂量依赖效应
细胞活力测定结果表明,BSP对Hela细胞的生长抑制作用,呈时间和浓度依赖性,随BSP浓度升高,处理时间增加,抑制率升高(图2)。在BSP浓度为500 µg/mL时,开始有抑制作用,处理72 h,抑制率达13.58%;BSP浓度为1500 µg/mL时,相同处理时间较1000 µg/mL抑制率提高一倍左右;2000 µg/mL BSP处理12 h时,抑制率已经达到24.60%,处理72 h抑制率高达96.88% (图2)。实验结果表明,所有浓度BSP处理Hela细胞12 h~48 h抑制率增长明显,48 h后抑制率增长缓慢。
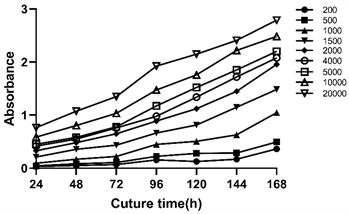
Figure 1. Growth curve of Hela cells
图1. Hela细胞生长曲线

Figure 2. Inhibition of BSP on Hela cells
图2. BSP对Hela细胞生长抑制率
3.3. BSP导致Hela细胞皱缩变圆
用2000 µg/mL BSP处理Hela细胞48 h,含10%胎牛血清DMEM高糖培养基处理48 h的Hela细胞作为对照组。用AO-PI双染料对细胞进行染色处理,绿色的为活细胞,红色的为死细胞。可以看到对照组细胞均为绿色(图3(A)),绝大部分细胞形态都为清晰的梭形;用BSP处理后的83%的细胞被染成红色,已完全失去梭形形态,变为圆形,少量被染成绿色的细胞也呈圆形,17%的细胞被染成绿色,且保持梭形(图3(B))。
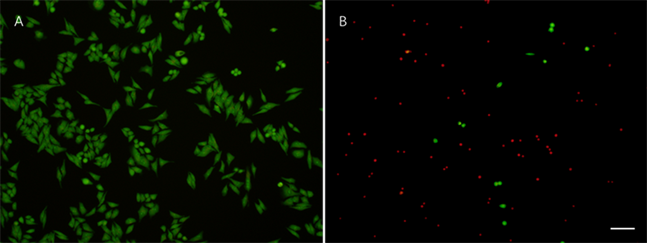 (A) 对照组;(B) 实验组Bar = 50 µm。
(A) 对照组;(B) 实验组Bar = 50 µm。
Figure 3. AO-PI Staining
图3. AO-PI双染
3.4. BSP诱导Hela产生四种非正常形态细胞
BSP处理Hela后,在10×物镜下观察到大量细胞皱缩变圆,在40×物镜下观察变圆的细胞,按形态可分为四种。第一种是细胞变圆,但细胞膜光滑完整(图4(A)),记为I。第二种是细胞膜出现少量突起(图4(B)),细胞内部密度不均匀,记为II。第三种是有许多突起伸出细胞膜(图4(C)),记为III。第四种是细胞皱缩成不规则形状,呈现小泡形态(图4(D)),记为IV。BSP系列浓度(500~2000 µg/mL)处理48 h后的Hela后,细胞形态统计分析表明,随着BSP浓度从500 µg/mL上升到2000 µg/mL,I型细胞从48.04%下降到8.62%,II型细胞从20.59%上升到31.19%,III型细胞从20.00%上升到38.72%,IV型细胞从11.37%上升到21.47% (n > 500) (图4(E))。
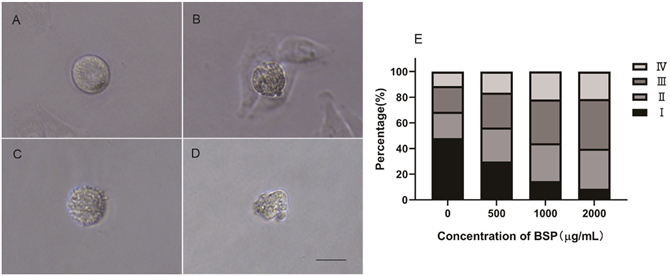 (A) I型;(B) II型;(C) III型;(D) IV型;(E) BSP处理48 h后对四种非正常细胞类型的数量统计。Bar = 20 µm。
(A) I型;(B) II型;(C) III型;(D) IV型;(E) BSP处理48 h后对四种非正常细胞类型的数量统计。Bar = 20 µm。
Figure 4. Four types of abnormal morphology induced by BSP
图4. BSP诱导的四种非正常形态细胞
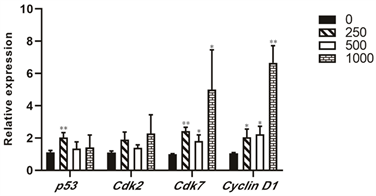
3.5. BSP诱导部分癌症相关基因表达上调
分别用250 µg/mL、500 µg/mL、1000 µg/mL浓度BSP处理Hela细胞12 h后,用RT-qPCR检测细胞p53,Cyclin D1,CDK2,CDK7的相对表达水平,用GAPDH作为内参基因。所用引物见表1。在三个浓度下,p53和CDK2均保持2倍左右相对表达水平。在250 µg/mL和500 µg/mL时,Cyclin D1和CDK7的表达水平是对照的2倍,但是BSP浓度上升到1000 µg/mL后,Cyclin D1相对表达水平上升到7倍,CDK7相对表达水平上升到5倍(图5)。
 *P < 0.05, **P < 0.01.
*P < 0.05, **P < 0.01.
Figure 5. Relative expression level of some cancer related genes
图5. 部分癌症相关基因相对表达水平
4. 讨论
本研究的结果初步表明,BSP对Hela细胞的抑制作用呈时间和浓度依赖性,浓度越高,处理时间越长,抑制作用越强。AO-PI双染和非正常形态统计结果显示,BSP处理后,Hela细胞的形态发生改变,由正常的梭形皱缩变圆,细胞膜也有一定程度改变。
BSP处理Hela细胞12 h就有一定的抑制作用,到48 h抑制率增长趋于平缓,说明在12 h甚至之前就已经有相关基因发生变化。p53基因编码一种包含转录激活、DNA结合和寡聚结构域的肿瘤抑制蛋白。这种基因的突变与多种人类癌症有关,包括遗传性癌症,如李·弗劳门尼综合征 [14]。有研究发现灵芝多糖对大肠癌细胞突变型p53抑癌作用有恢复作用 [15]。BSP在250 µg/mL浓度处理12 h,p53基因相对表达水平增加1倍,说明BSP确实能够刺激p53基因的表达,从而抑制癌细胞增殖。
Cyclin D1基因编码的蛋白质属于高度保守的细胞周期蛋白家族,是CDK激酶的调节因子。该基因编码的细胞周期蛋白与CDK4或CDK6形成复合物,并作为其调节亚单位发挥作用,其活性是细胞周期G1/S转换所必需的。大英素通过Cyclin D1/CDK4介导的途径抑制MCF-7和MDA-MB-468乳腺癌细胞的增殖 [16]。Cyclin D1的表达水平显示BSP对Hela的抑制作用可能与细胞周期相关蛋白积累有关。
CDK2基因编码细胞周期蛋白依赖性激酶2 (CDK2),该蛋白是细胞周期蛋白依赖性蛋白激酶复合物的催化亚单位,它调节整个细胞周期的进展。这种蛋白的活性在G1到S期转变过程中尤为重要。CDK2通过DNA损伤、细胞内转运、蛋白质降解、信号转导、DNA和RNA代谢和翻译等途径与蛋白质相互作用并磷酸化。CDK2及其调节亚单位在许多人类癌症中被解除调节,研究表明CDK2抑制在具有明确遗传特征的肿瘤子集中引起抗肿瘤活性 [17]。所以CDK2的表达水平提高也显示了BSP对Hela的抑制作用。
CDK7基因编码的蛋白是细胞周期蛋白依赖性蛋白激酶(CDK)家族的成员,是细胞周期进程的重要调控因子。该蛋白与细胞周期素H和MAT1形成三聚体复合物,发挥CDK激活激酶(CAK)的作用。CDK7的抑制扰乱了小细胞肺癌(SCLC)的细胞周期进程,诱导DNA复制应激和基因组不稳定,同时触发免疫应答信号。这些肿瘤的内在事件激发由T细胞诱导的强大的免疫监视程序,而通过增加免疫检查点阻断,免疫监视程序进一步增强 [18]。BSP处理后,Hela细胞内CDK7表达水平增高正是其通过增加免疫检查点阻断发挥抑制作用的体现之一。
本研究初步证实了BSP对Hela细胞的生长具有抑制作用,但作用浓度偏大,可能是因为粗多糖中多糖组分多导致,后期还需对BSP进行分离纯化,筛选出抑制作用贡献最大的组分,并详细探究BSP对癌细胞发挥抑制作用的机理。
基金项目
中央高校基本科研业务费专项基金项目莼菜综合开发利用关键技术(CZP17051)。
NOTES
*通讯作者。