1. 引言
鼻咽癌在中国南方发病率较高,特别是在广西,其鼻咽癌的发病率及死亡率明显高于其他地区 [1]。鼻咽癌经过规范的治疗后,多数患者可以得到临床缓解,但远处转移常常是鼻咽癌治疗失败的主要原因 [2]。因此,进一步明确肿瘤转移相关子并加以干预,是提高鼻咽癌患者生存率的关键环节。
我们前期研究发现水通道蛋白1 (AQP1)在高转移潜能鼻咽癌细胞株中的表达高于低转移潜能的细胞株,提示AQP1的表达水平可能与人鼻咽癌细胞的转移潜能密切相关 [3]。为了进一步明确AQP1在鼻咽癌浸润转移中的作用,本研究拟通过慢病毒干扰载体特异性沉默高AQP1表达的鼻咽癌细胞5-8F的AQP1基因,检测AQP1干扰后癌细胞迁移、侵袭能力变化的情况。
2. 材料与方法
2.1. 材料
鼻咽癌细胞株5-8F购自中国科学院上海细胞库。RPMI1640培养基、胎牛血清和胰蛋白酶购自BI公司。双抗(链霉素、青霉素)购自上海翊圣生物科技公司。LipofectamineTM 2000及Trizol均购自Invitrogen公司。鼠抗人AQP1单克隆抗体购自Santa Cruz公司,鼠/兔通用二抗检测试剂盒购自福州迈新生物技术有限公司。兔抗人β-actin抗体购自Abcam公司。
2.2. 鼻咽癌细胞培养及shRNA质粒转染
鼻咽癌细胞培养于含小牛血清(10%)的RPMI 1640培养基中,并在其内加入青霉素(100 U/mL)和链霉素(100 μg/mL)。细胞在于温育箱(37℃、5% CO2)中培养,当细胞处于对数生长期时,可用于实验。质粒转染步骤按照Invitrogen公司LipofectamineTM2000试剂的使用说明书施行。将转染了靶向AQP1的shRNA (AQP1-shRNA)的5-8F细胞作为AQP1干扰组,而未转染的5-8F细胞设置为空白对照组。AQP1-shRNA参考李卓等 [4] 报道构建,核心序列为:CCATTATGCTGGTGTATGT。
2.3. Western Blot法分析鼻咽癌细胞转染前后AQP1蛋白表达的差异
将处于对数生长期的5-8F细胞裂解离心(1000 rpm 5分钟)后,得到对照组及AQP1干扰组细胞的总蛋白,并对两组细胞的蛋白含量进行测定(bradford比色法)。两组细胞的蛋白通过SDS PAGE电泳法各自分离出40 μL样本,并将蛋白样本转移至PvDF膜上(电转印法)。将蛋白封闭后置于4℃冰箱并过夜,再加入一抗孵育2小时,然后用TBST洗涤3次,加入辣根过氧化物酶标记的二抗进行孵育(37℃, 1 h),孵育结束后TBST再次洗涤3次,最后曝光显影。将两组AQP1蛋白光密度值比上相应内参β-actin光密度值,得到各组细胞的AQP1蛋白相对表达量。
2.4. Transwell实验分析鼻咽癌细胞转染前后垂直迁移及侵袭能力的差异
迁移实验:
将空白对照组与AQP1干扰组的鼻咽癌细胞5-8F消化,制成细胞悬液。将200 µL细胞悬液(内含1 × 105细胞)加入上室,下室加入1640培养基(含10% FBS)共750 µL,空白对照组与AQP1干扰组均设3个复孔,置于温育箱中培养,培养环境设定为37℃、5% CO2。细胞培养48 h后取出小室,将上室的培养基用吸管吸取弃除,再用棉签将上室细胞轻轻拭去,后用4%多聚甲醛固定15分钟,再用结晶紫染色10 分钟,最后PBS洗涤3次,于100倍倒置显微镜下随机选取5个视野进行拍照计数。
侵袭实验:
将50 mg/L的Matrigel预先用无血清的1640培养基以1:4比例稀释后,包被Transwell小室的底部膜,置于4℃温度下风干,水化基底膜。其余步骤同迁移实验。
2.5. 统计学分析
图片数据的采集及处理用Graphpad + Prism 5和Image J软件进行。应用SPSS 22.0统计软件进行统计学检验,组间比较用两样本t检验,以P < 0.05认为差异有统计学意义。柱形图用Excel软件描绘,误差线为各个复孔的标准偏差SD。3次以上独立重复实验。
3. 结果
3.1. 鼻咽癌细胞AQP1-shRNA干扰后AQP1蛋白表达水平的变化
Western blot分析显示,与未进行AQP1-shRNA干扰的对照组细胞对比,干扰组鼻咽癌5-8F细胞的AQP1蛋白表达水平明显降低(P < 0.05),见图1。
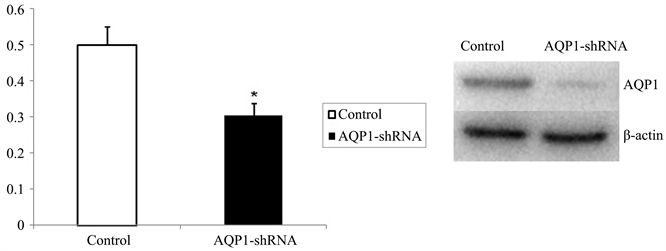
Figure 1. AQP1 expression in nasopharyngeal carcinoma cell is inhibited by sh-AQP1 (*P < 0.05)
图1. 鼻咽癌细胞经sh-AQP1干扰后AQP1表达下降(*P < 0.05)
3.2. 鼻咽癌细胞AQP1-shRNA干扰后迁移能力的变化
Transwell迁移实验显示,鼻咽癌细胞5-8F经AQP1-shRNA干扰后(干扰组),其细胞迁移个数明显低于空白对照组(P < 0.05),见图2。
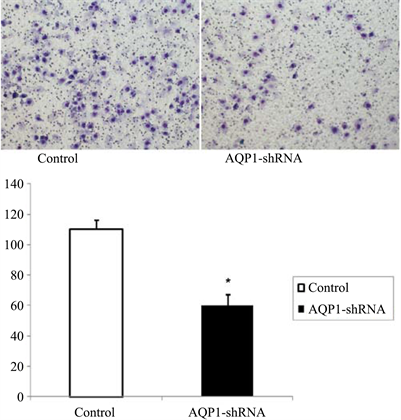
Figure 2. Downregulation of AQP1 inhibits cell migration in nasopharyngeal carcinoma cells
图2. 下调AQP1表达抑制鼻咽癌细胞迁移能力(×100). *P < 0.05
3.3. 鼻咽癌细胞AQP1-shRNA干扰后迁移能力的变化干扰AQP1对鼻咽癌细胞侵袭能力 的影响
Transwell侵袭实验显示,鼻咽癌细胞5-8F经AQP1-shRNA干扰后(干扰组),其细胞侵袭个数明显低于空白对照组(P < 0.05),见图3。
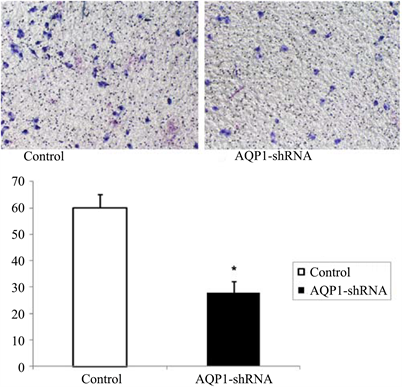
Figure 3. Downregulation of AQP1 inhibits cell invasion in nasopharyngeal carcinoma cells
图3. 下调AQP1表达抑制鼻咽癌细胞侵袭能力(×100). *P < 0.05
4. 讨论
AQP1是介导组织内水的被动跨膜转运的重要工具,对维持细胞内环境的稳定平衡具有重要作用。除了维持人体的正常生命活动外,AQP1与恶性肿瘤的生长及转移可能也有着密切的联系。研究发现恶性肿瘤(如乳腺癌、宫颈癌、肺癌、结肠癌等 [5] [6] [7] [8])中AQP1的表达水平高于正常组织或其他良性病变。在鼻咽癌的研究中也发现了类似的结果 [9],而且AQP1与肿瘤血管生成存在相关性,提示其可以通过倡导肿瘤血管生成促进鼻咽癌的生长和转移 [9]。
转移是恶性肿瘤的一个重要特征,也是恶性肿瘤患者死亡的主要原因。转移的建立是一个多步骤的过程 [10] [11],其中肿瘤细胞的迁移侵袭能力是影响肿瘤转移的重要影响因素。下调肿瘤细胞AQP1的表达,可以显著减少肿瘤细胞迁移的能力,从而降低其转移的风险 [12] [13]。本研究利用AQP1干扰慢病毒载体转染高AQP1表达鼻咽癌细胞株5-8F,使细胞株的AQP1表达降低,结果发现细胞株的迁移侵袭能力也随之降低,提示AQP1是促进鼻咽癌细胞迁移的重要影响因素。研究表明AQP1促进肿瘤细胞迁移的能力,是驱动依赖AQP1的水分子渗透到细胞突起中,为迁移的肿瘤细胞前缘为肌动蛋白聚合创造更多空间 [14] [15] [16]。
5. 结论
综上所述,本研究结果提示AQP1除了通过影响组织血管生成促进鼻咽癌转移外,还可以直接影响鼻咽癌细胞本身的迁移侵袭能力。下调鼻咽癌的AQP1可以降低其转移风险,AQP1可能成为鼻咽癌治疗的潜在靶点。
基金项目
广西高校中青年教师基础能力提升项目(2017KY0129)。
参考文献
NOTES
*通讯作者。