摘要:
目的:分析肝段切除患者术前的血清学指标并建立血清诊断模型,评价血清诊断模型对肝纤维化的应用价值。方法:回顾性收集我院2017年6月至2019年12月肝段切除患者术前的血清学指标,计算天冬氨酸转氨酶/血小板比值指数(aspartate aminotransferase to platelet ratio index, APRI)、γ谷氨酰转肽酶/血小板比值指数(γ-glutamyltranspeptidase to platelet ratio, GPR)、基于四因子的纤维化指数(fibrosis index based on the four factors, FIB-4)以及AST/ALT比值(AST/ALT ratio, AAR)四种肝纤维化诊断模型,使用ROC曲线评价每种诊断模型对≥S1、≥S2、≥S3以及≥S4四种肝纤维化分组的诊断能力。结果:APRI、GPR、FIB-4三种模型对于四种肝纤维化分组均有统计学意义,P值范围为(0.000~0.049),AAR对每种分组均没有意义。FIB-4模型诊断不同分期肝纤维化性能最佳,其中对于≥S1期肝纤维化诊断价值最大,AUC达0.960,以约登指数最大值计算临界值为0.850。结论:APRI、GPR、FIB-4三种血清诊断模型可以提示不同分期肝纤维化,FIB-4模型对≥S1期肝纤维化价值最佳。
Abstract:
Objective: To analyze the preoperative serological indexes of patients with segmental hepatectomy and establish serum diagnostic models, and to evaluate the application value of serum diagnostic model in liver fibrosis. Methods: Serological indexes of patients undergoing segmental hepatectomy in our hospital from June 2017 to December 2019 were collected retrospectively. Four hepatic fibrosis diagnostic models of aspartate aminotransferase/platelet ratio index (APRI), gamma glutamyl transpeptidase/platelet ratio index (GPR), fibrosis index based on four factors (FIB-4) and AST/ALT ratio (AAR) were calculated. ROC curve was used to evaluate the diagnostic ability of each diagnostic model for ≥S1, ≥S2, ≥S3 and ≥S4 liver fibrosis groups. Results: The three models of APRI, GPR and FIB-4 had statistical significance for the four groups of liver fibrosis with the range of P value (0.000~0.049); AAR was not significant for each group. FIB-4 had the best diagnostic performance in different stages of liver fibrosis, in which the diagnostic value of ≥S1 stage was the highest with the AUC 0.960. The critical value calculated by the maximum value of Jordan index was 0.850. Conclusion: Three serum diagnostic models of APRI, GPR and FIB-4 can indicate different stages of liver fibrosis, and FIB-4 model is the best for ≥S1 stage of liver fibrosis.
1. 引言
肝纤维化(Liver Fibrosis, LF)是致病因子导致细胞外基质(Extracellular matrix, ECM)异常沉积的病理反应,是慢性肝病进展为肝硬化甚至肝癌的关键步骤 [1]。我国是肝病大国,乙型肝炎病毒、非酒精性脂肪性肝病等是肝纤维化常见致病因素。研究表明,及时诊断并进行临床干预,可以缩短肝纤维化进程,早期肝纤维化甚至可以逆转 [2] [3]。肝纤维化的“金标准”是穿刺活检,由于其有创并且重复性差,临床难以将其作为监测肝纤维化变化的监测手段 [1]。肝纤维化的无创性诊断标准成为目前研究的热点。
本研究回顾性收集各种肝脏疾病需要手术切除患者的血清学检查结果,计算四种无创血清诊断模型,评估四种模型对于不同纤维化分期的效能。
2. 材料与方法
2.1. 一般资料
回顾性收集青岛大学附属医院2017年6月至2019年12月肝脏术后获得准确肝纤维化病理分期的患者共272名。其中男性197人,平均年龄53.1 ± 13.3岁;女性75人,平均年龄47.3 ± 14.8岁。所有患者血清学检查结果为术前并且进行放化疗之前获取。本研究已获得青岛大学附属医院医学伦理委员会许可。
2.2. 血清诊断模型计算
天冬氨酸转氨酶/血小板比值指数(aspartate aminotransferase to platelet ratio index, APRI)、γ谷氨酰转肽酶/血小板比值指数(γ-glutamyltranspeptidase to platelet ratio, GPR)、基于四因子的纤维化指数(fibrosis index based on the four factors, FIB-4)以及AST/ALT比值(AST/ALT ratio, AAR)计算公式如下所示:
[4] (1)
[5] (2)
[5] (3)
[5] (4)
2.3. 肝纤维化分期
按照中华医学会 [6] 肝纤维化分期分为五期:将≥S1定义为出现肝纤维化,≥S2为显著纤维化,≥S3为进展期肝纤维化,≥S4为肝硬化,具体分期标准见表1。

Table 1. Staging criteria of liver fibrosis
表1. 肝纤维化分期标准
2.4. 统计学分析
使用SPSS23.0计算患者临床及血清学特征。使用独立样本t检验比较计量资料、χ2检验比较计数资料,组间比较使用单因素ANOVA检验,使用ROC曲线及曲线下面积评价血清诊断模型的诊断能力,Delong检验检测ROC曲线。P < 0.05表示差异有统计学意义。
3. 结果
患者临床参数性别、年龄在不同分组间差异具有统计学意义,血清学指标在五种分期间也有意义,患者临床血清学特征见表2。基于临床及血清学指标计算的四个血清学诊断模型APRI、GPR、FIB-4以及AAR鉴别不同分组肝纤维化效能如表3所示,APRI、GPR、FIB-4在四种分组差异均有意义,AAR在任一分组中差异均没有统计学意义。


Table 2. Clinical serological characteristics of different stages of hepatic fibrosis
表2. 不同肝纤维化分期的临床血清学特征

Table 3. Serum models of different groups of liver fibrosis
表3. 不同肝纤维化分组的血清模型
对于不同分组的肝纤维化,我们使用ROC曲线分析APRI、GPR、FIB-4三种血清诊断模型的诊断效能。对于≥S1、≥S2、≥S3以及≥S4四种分组,APRI、GPR、FIB-4均具有较好的诊断效能,其中FIB-4性能最佳,AUC范围为(0.811~0.960),对于≥S1期肝纤维化诊断最佳,AUC达0.960,以约登指数最大值(0.814)计算临界值为0.850,当FIB-4 < 0.850时可以排除肝纤维化。其他模型的AUC及95% CI如表4所示。不同分组的血清模型的ROC曲线如图1所示,Delong检验示P小于0.05。

Table 4. ROC curve analysis of serum models in different groups of liver fibrosis
表4. 不同肝纤维化分组血清模型的ROC曲线分析
4. 讨论
肝纤维化是肝脏由于各种致病因素细胞外基质过度沉积的病理性修复反应,其致病因素多种多样 [1] [7]。常见的为慢性肝炎病毒感染、非酒精性脂肪肝病、酒精性肝病等,肝纤维化是慢性肝病进展为肝硬化的关键步骤 [7] [8]。目前,诊断肝纤维化的“金标准”是肝脏穿刺活检,但穿刺手术术后存在并发症并且价格昂贵,难以多次进行。因此,临床迫切需求一种无创性、可重复性的肝纤维化评估方法 [9] [10]。
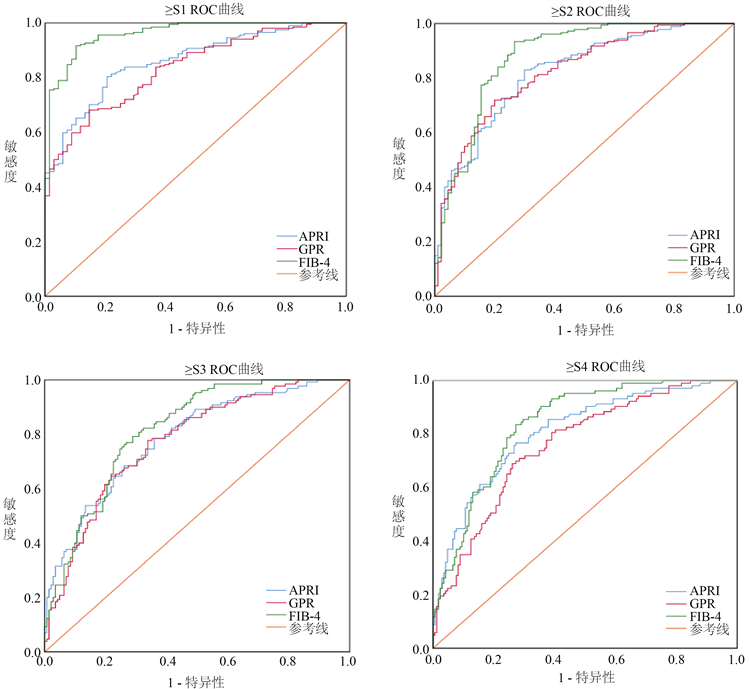
Figure 1. ROC curve of serum models in different groups
图1. 不同分组血清模型的ROC曲线
肝纤维化常用的血清标志物分为直接标志物和间接标志物两种 [11] [12]。直接标志物包括透明质酸(Hyaluronic Acid, HA)、层粘连蛋白(Laminin, LN)等,研究表明肝纤维化的直接标志物与肝纤维化水平呈正相关 [13]。间接标志物如血小板计数、天门冬氨酸氨基转移酶、丙氨酸氨基转移酶等可以反映肝脏细胞损伤,间接反应肝纤维化。然而上述血清标志物指标受自身代谢影响,当其他脏器损伤也会造成这些标志物水平的升高,肝脏的特异性低 [9] [14]。
以单一血清学指标为基础联合临床参数计算的无创诊断模型如APRI、FIB-4、GPR、AAR、S指数等可以提高纤维化诊断准确率 [15] [16]。本研究回顾性分析我院肝脏疾病需手术患者,术后获取肝纤维化病理学分期,相比穿刺患者肝纤维化分期更为精确。基于我院常用的血清学指标计算APRI、FIB-4、GPR、AAR四种血清诊断模型,t检验证明APRI、FIB-4、GPR三种模型对≥S1、≥S2、≥S3以及≥S4四种肝纤维化不同分组均有意义(P值范围0.001~0.049),AAR对于肝纤维化不同分组没有统计学意义。三种模型中,FIB-4指数诊断性能最佳,AUC范围为(0.811~0.960),诊断≥S1期肝纤维化,即出现肝纤维化的性能最佳,AUC为0.960 (95% CI: 0.936~0.985),符合文献报道 [4]。FIB-4指数联合了AST、ALT、GGT三种单一指标,Sonnevel [17] 研究表明,FIB-4指数诊断排除30岁以上的乙型肝炎肝硬化的敏感性为90.9%。本研究证明APRI、FIB-4、GPR三种血清模型可以提示肝纤维化,其中FIB-4诊断效能最佳,并且当FIB-4 < 0.850时可以排除肝纤维化。一项研究认为 [15],GPR比APRI和FIB-4更准确,可以用于肝纤维化分期。张旭 [5] 等研究表明联合APRI、FIB-4在内的五种血清模型诊断肝纤维化的性能与病理结果趋近。这些诊断模型大多为慢性乙型肝炎或慢性丙型肝炎所致肝纤维化样本,目前对每种模型的临界值尚未达成一致 [6]。
本研究也存在一定的局限性,本研究样本量有限,不同分期肝纤维化分布不均匀,S1、S3期肝纤维化样本量较小,可能导致分组误差,希望今后能够增大样本量,改进测量标准,用血清模型的量化数值进一步准确预测不同分期的肝纤维化。
NOTES
*通讯作者。