1. 引言
分子标志物(molecular markers)又称为“分子过程探针”(molecular process probes),系指所有能提供有机物成因及其所经历的生物、化学、物理和地质过程的有机分子,可以构成当代和古代环境中有机物质的示踪指标体系,不仅适用于现代海洋、湖泊水域的环境沉积学演化、古今气候的变迁规律、区域性环境地球化学景观与人类健康的关系等理论问题的研究,而且为环境有机地球化学研究提供了重要的追踪手段,在资源环境的合理开发和利用、环境质量的有效控制以及人类生存、健康等诸方面展示出广阔的应用前景。目前,分子标志物的概念已经得到新的发展,已经成为有机地球化学家们用于了解有机污染物的来源、迁移以及归宿的一种指标体系。
直链烷基苯(Linear alkylbenzenes, LABs)是工业上合成阴离子洗涤剂链状烷烃基苯磺酸盐(linear alkylbenzene sulfonates,简称LAS)的原料(图1),但在合成过程中会有部分未被磺化的链状烷烃基苯混入产品LAS中 [1] [2]。LAS型洗涤剂的使用及随后的处理将LABs带入水生环境中。
LABs可以看作是含有10~14个碳的正烷烃碳链上一个氢原子被苯基取代的烷烃衍生物,苯基取代位置的不同构成系列同系物,统称直链烷基苯,主要用于工业合成长链烷基苯磺酸盐(LAS)——自1960年以后广泛使用的阴离子洗涤剂的主要成分 [1] [2]。由于在合成过程中LAS型洗涤剂会有少量的LABs残留,因此,LABs会随着该型洗涤剂的使用及随后的处置而进入水环境。鉴此,LABs可以用作指示来源于民用污水的污染物质的环境分子标志物,也常被作为指示工具来研究市政管道排出水体中颗粒物或其
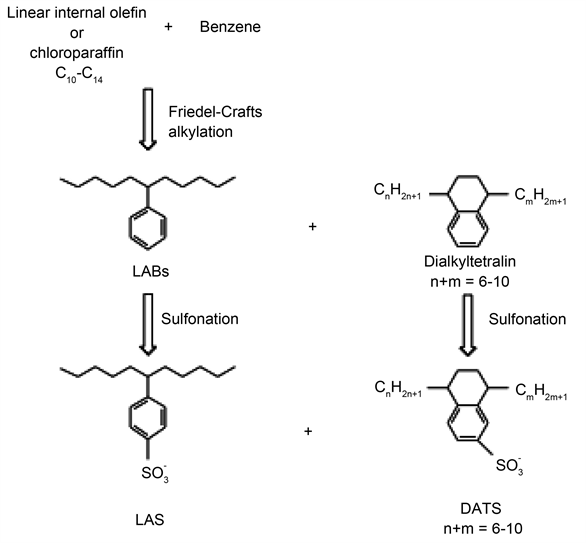
Figure 1. The reaction process of synthesizing linear alkylbenzene sodium sulfonate from linear alkylbenzene
图1. 直链烷基苯合成直链烷基苯磺酸钠的反应过程
它憎水性有机污染物的来源及其随后的传输过程。自从1983年首次在环境中发现LABs的存在,并提出其作为分子标志物使用的可能性以来,LABs就在全世界许多地区被广泛地作为环境分子标志物,用以研究人类活动与环境污染之间的相关性 [3]。
目前水体中LABs的分析方法尚未有标准,仅有的方法仅限于科学研究,其主要采用XAD树脂吸附–多层层析柱净化–气相色谱质谱分析法 [4],该方法中XAD树脂价格昂贵,且易于穿透,目标物质流失,在实验过程中难以把握。同时所采用硅胶–氧化铝多层层析柱进行净化,填充材料复杂而且消耗溶剂量大。文献报道的用顶空单液滴微萃取–气相色谱法测定水中卤代烃和烷基苯的含量 [5],适合于低分子量的烷基苯类化合物,不适合于本文所测定的癸基苯、十一烷基苯、十二烷基苯、十三烷基苯。
同时,由于LABs疏水性强,易于吸附在土壤和底部沉积物中,因此在环境中,土壤环境中为其主要富集介质。尤其受到污水灌溉或者居民较为聚集的区域土壤/沉积物中含有较高浓度LABs。目前土壤或沉积物中LABs的分析方法尚未有标准,仅有的方法仅限于科学研究,主要采用快速溶剂萃取仪提取–多层层析柱净化–气相色谱质谱分析法 [6]。该方法所用加速溶剂萃取仪价格昂贵,仪器操作复杂,管道容易堵塞,由于在高温高压下进行萃取,易造成目标污染物降解,也不适合含有机碳或者脂肪高的样品,同时所采用硅胶–氧化铝多层层析柱方法进行净化,填充材料复杂而且消耗溶剂量大,且回收效率不高。张婷等 [7] 使用传统索氏提取方法对岩石样品进行了提取,提取时间为72 h,耗时较长,不适用于大批量样品分析。
本研究通过对水体和土壤/沉积物样品中直链烷基苯的前处理方法进行优化,建立一种简单快捷且低消耗的适合于水体及土壤沉积物中LABs前处理方法和仪器定量方法。
2. 实验方法
2.1. 仪器与材料
分析仪器:7890B-5977B气相色谱质谱联用仪(美国Agilent公司)。
土壤/沉积物样品提取仪器:ST255全自动索氏脂肪抽提仪(福斯FOSS)。
色谱柱:HP-5MS,30 m × 0.25 µm × 0.25 mm。
标准溶液:癸基苯、十一烷基苯、十二烷基苯、十三烷基苯(纯度分别99.8%、99.2%、99.3%、99.5%,质量均为100 mg),市售有证标准物质,AccuStandard。
正己烷,HPLC,CNW。
二氯甲烷,HPLC,CNW。
无水硫酸钠,优级纯,国药,400℃烘4 h以上。
玻璃纤维膜,孔径0.7 μm,400℃烘4 h以上。
玻璃纤维滤膜,直径110 mm,孔径0.45 μm,400℃烘4 h以上。
100~200目柱层析用硅胶,沪试。
100~200目柱层析用中性氧化铝,沪试。
硅胶和中性氧化铝使用前需在甲醇中超声清洗3次后,再用二氯甲烷超声清洗3次,自然晾干后在烘箱里以180℃烘烤24小时,冷却后密封保存。
水体样品来自巢湖流域。
2.2. 溶液配制
用正己烷将4种直链烷基苯标准溶液混合配制成10,000 mg/L混合标准储备液,稀释标准储备液,配制标准曲线系列浓度,各点浓度分别为5、50、100、500、1000、5000 µg/L。供GC-MS分析使用。
2.3. 样品前处理步骤
2.3.1. 样品萃取与提取
1) 水样的萃取
用孔径为0.7 µm滤膜过滤水样,通过真空抽滤或者溶剂过滤器过滤,取过滤后的水样进行液液萃取。量取1.0 L的过滤水样加入到分液漏斗中,用100 mL二氯甲烷萃取,振摇5 min,静置3 min后,收集下层萃取液,重复萃取步骤3次,合并萃取液。
2) 土壤/沉积物样品的提取
将土壤/沉积物样品置于搪瓷或玻璃托盘中,除去枝棒、叶片、石子等异物。自然风干后称取10.0 g风干样品,将称好的样品用直径110 mm,孔径0.45 μm玻璃纤维滤膜包裹起来,放入自动索氏提取器的套筒内,在不锈钢量杯中加入80 mL二氯甲烷溶剂,沸腾60 min,淋洗60 min,溶剂回收10 min,完成提取,收集提取液。
2.3.2. 萃取液的浓缩与溶剂交换
将收集到的萃取液与提取液使用旋转蒸发仪进行浓缩,设定加热温度低于35℃,真空度保持>260 Pa。当浓缩至2 mL左右时,加入10 mL正己烷进行溶剂替换,继续浓缩至约1.0 mL。
2.3.3. 净化
将浓缩液转移至净化柱。净化柱由3 g硅胶及0.5 g无水硫酸钠填充,转移前,用20 mL正己烷润洗净化柱。然后将浓缩液转移至净化柱,并用2 mL正己烷润洗3次,后加入25 mL正己烷淋洗净化柱,收集淋洗液。
2.3.4. 浓缩与定容
净化后的试液再次按照氮吹浓缩或旋蒸浓缩的步骤进行浓缩,用正己烷浓缩定容至1.0 mL,转移至进样瓶中,上机待测。
2.4. 仪器分析与定量
色谱条件:
进样口温度:290℃,不分流。
进样量:1.0 µL,柱流量:1.2 mL/min。
柱温:80℃保持0 min;以10℃/min速率升至160℃,保持0 min;以3℃/min速率升至210℃,保持0 min;再以10℃/min速率升至290℃,保持0 min。
质谱条件:
离子源温度:230℃;
接口温度:280℃;
四级杆温度:150℃;
扫描模式:选择离子模式(SIM)模式;
定量方式:外标法。
3. 结果与讨论
3.1. 净化实验条件的影响
3.1.1. 净化柱填充方式的影响
净化柱填充方式1:水样过滤后,取1 L液液萃取,浓缩后通过层析柱净化,其净化柱填充方式为3.0 g硅胶及0.5 g无水硫酸钠填充,用25 mL正己烷淋洗层析柱,收集浓缩定容,仪器分析。
净化柱填充方式2:水样过滤后,取1 L液液萃取,浓缩后通过层析柱净化,净化柱填充方式为由1.5 g氧化铝、6 g硅胶及0.5 g无水硫酸钠填充,用15 mL正己烷层析柱淋洗并弃去,再用15 mL正己烷淋洗收集,浓缩定容,仪器分析。
分别做实际样品加标实验,结果显示:净化柱填充方式1所获得的癸基苯、十一烷基苯、十二烷基苯和十三烷基苯回收率分别为(76.5% ± 4.2%),(81.4% ± 3.5%),(90.2% ± 2.9%),(101.0% ± 4.4%),而采用净化柱填充方式2所获得的4种LABs的回收率分别为(53.2% ± 8.0%),(56.8% ± 7.5%),(57.4% ± 7.9%)和(60.9% ± 11.7%) (图2),净化柱填充方式1所获得的回收率显著高于净化柱填充方式2 (p < 0.05)。由此可见,较净化柱填充方式2,净化柱填充方式1不仅处理步骤简单,容易操作,节约溶剂和耗材,同时也具有较好的回收效率。
因而最终实验选择净化柱填充方式为3.0 g硅胶及0.5 g无水硫酸钠填充。
3.1.2. 淋洗溶剂体积的影响
为了优化净化过程的实验条件,在保证最好的回收效率的前提下,能节约淋洗溶剂,共设置了4组不同体积淋洗方案:

Figure 2. Comparison of the effect of purification column packing method 1 and purification column packing method 2
图2. 净化柱填充方式1与净化柱填充方式2效果比较
方案1:1 mL正己烷中含1000 ppb的标准溶液转移至3.0 g硅胶层析柱中,淋洗条件如下:先加入5 mL正己烷淋洗层析柱,并弃去;后加入5 mL正己烷淋洗,收集液组分1;再加入5 mL正己烷淋洗,收集组分2;再加入5 mL正己烷淋洗,收集组分3。浓缩上机测定。
方案2:1 mL正己烷中含1000 ppb的标准溶液转移至3.0 g硅胶层析柱中,加入5 mL正己烷淋洗,收集组分1;后加入15 mL正己烷淋洗,收集组分2;再加入5 mL正己烷,收集组分3。浓缩上机测定。
方案3:1 mL正己烷中含1000 ppb的标准溶液转移至3.0 g硅胶层析柱中,加入25 mL正己烷淋洗,收集组分1;后加入5 mL正己烷淋洗,收集组分2。浓缩上机测定。
方案4:1 mL正己烷中含1000 ppb的标准溶液转移至3.0 g硅胶层析柱中,加入30 mL正己烷淋洗,收集组分1;后加入5 mL正己烷淋洗,收集组分2,再加入5 mL正己烷,收集组分3,浓缩上机测定。

Figure 3. The recovery rate of different linear alkylbenzenes under elution conditions in silica gel chromatography column
图3. 不同直链烷基苯在硅胶层析柱中淋洗条件下回收率
通过图3可以看出,方案1中先淋洗5 mL层析柱,并弃去,会导致回收率降低,四种LABs的回收率均接近于60%,可见前面5 mL淋洗液中含有一定量的LABs。方案2中,将前5 mL淋洗液保留,第二组分采用15 mL的正己烷作为淋洗液,两组分的回收率共计可以达到90%以上,再增加5 mL正己烷淋洗,获得第三组分,其含有的LABs仅占总回收率的3%左右。尽管继续增加萃取溶剂(方案3和4),其回收效率基本保持在80%~90%之间,同时,增加淋洗液体积,回收率呈现下降的趋势,可能因为淋洗液体积增加,浓缩时间加长,导致污染物挥发损失。
因此最终淋洗溶剂体积选为25 mL正己烷。
3.2. 空白及空白准确度分析
3.2.1. 水样空白及加标
取一级纯净水分别做水体样品空白实验及空白加标实验,空白加标量为1000 ppb。通过1实验方法步骤进行过滤、液液萃取、浓缩、净化、浓缩定容和仪器分析。4次空白实验和3次空白加标实验结果如下:
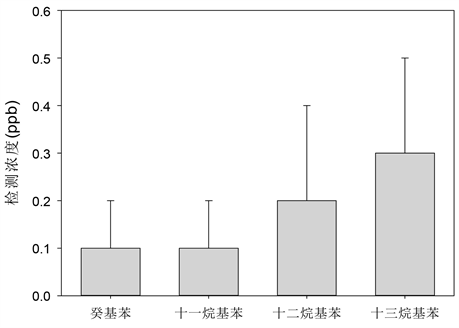
Figure 4. The detection results of LABs of 4 blank samples
图4. 4次空白样品的LABs的检出结果
4次空白样品中均检出LABs,其中癸基苯、十一烷基苯、十二烷基苯和十三烷基苯的检出浓度分别为0.1 ± 0.1,0.1 ± 0.1,0.2 ± 0.2和0.3 ± 0.2 ppb (图4),反映了本实验过程的实验空白较低,引入的目标污染物较少,为后期实际样品的分析提供能力。
空白加标实验结果显示,3次重复样品中癸基苯、十一烷基苯、十二烷基苯和十三烷基苯的回收率分别为(89.0% ± 14.2%),(94.0% ± 14.7%),(90.7% ± 14.5%)和(96.3% ± 15.2%) (图5)。由此可见,本方法对目标污染物的回收效率较好,能很好地处理水体样品中LABs的处理净化和分析。
3.2.2. 土壤/沉积物空白及加标
取石英砂分别做土壤/沉积物空白实验及空白加标实验,空白加标量为1000 ppb。通过1实验方法步骤进行提取、浓缩、净化、浓缩定容和仪器分析。3次空白实验和13次空白加标实验结果如下:
3次空白样品中均检出LABs,其中癸基苯、十一烷基苯、十二烷基苯和十三烷基苯的检出浓度分别为4.8 ± 1.2,3.3 ± 0.4,2.0 ± 0.2和3.5 ± 0.4 ppb (图6),反映了本实验过程的实验空白较低,引入的目标
图5. 空白加标样品LABs的回收率
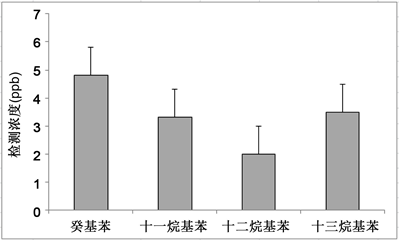
Figure 6. LABs detection results of 3 blank samples
图6. 3次空白样品的LABs的检出结果
污染物较少,为后期实际样品的分析提供能力。
空白加标实验结果显示,13次重复样品中癸基苯、十一烷基苯、十二烷基苯和十三烷基苯的回收率分别为(79.1% ± 13.3%),(83.5% ± 13.4%),(89.0% ± 17.2%)和(108.7% ± 32.2%) (图7)。由此可见,本方法对目标污染物的回收效率较好,能很好地处理土壤样品中LABs的处理净化和分析。
Figure 7. The recovery rate of blank spiked LABs
图7. 空白加标样品LABs的回收率
3.3. 样品及样品准确度分析
量取实际水样样品做加标实验,加标量为1000 ppb,结果显示:实际样品所获得的癸基苯、十一烷基苯、十二烷基苯和十三烷基苯回收率分别为(76.5% ± 4.2%),(81.4% ± 3.5%),(90.2% ± 2.9%),(101.0% ± 4.4%) (图8)。

Figure 8. The recovery rate of LABs of water sample spiked sample
图8. 水样加标样品LABs的回收率
称取实际土壤样品进行加标实验,加标量为1000 ppb。通过1实验方法步骤进行提取、浓缩、净化、浓缩定容和仪器分析,结果如下。土样加标实验结果显示,6次重复样品中癸基苯、十一烷基苯、十二烷基苯和十三烷基苯的回收率分别为(85.7% ± 11.2%),(89.4% ± 17.9%),(91.7% ± 23.1%)和(99.5% ± 38.1%) (图9)。
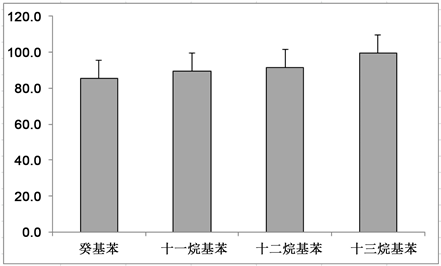
Figure 9. Recovery rate of LABs in soil spiked samples
图9. 土壤加标样品LABs的回收率
由此可见,本方法对目标污染物的回收效率较好,能很好地处理水体样品和土壤沉积物中LABs的处理净化和分析。
3.4. 样品重复性分析
取实际水样,按照1实验方法进行前处理,进行3次重复实验,结果如下。测得的实际河水水体中四种LABs的浓度分别为0.99 ± 0.22 ng/L,1.31 ± 0.30 ng/L,1.49 ± 0.13 ng/L和3.31 ± 0.64 ng/L,相对标准偏差分别为22.5%,22.6%,8.8%和19.5% (图10)。

Figure 10. The concentration and relative standard deviation of LABs in 3 replicate samples of actual river water
图10. 实际河水3个重复样品中LABs的浓度与相对标准偏差
取实际土壤样品,按照1实验方法步骤进行前处理,进行3次重复实验,结果如下。测得的实际土壤中四种LABs的浓度分别为1.33 ± 0.47 µg/kg,1.06 ± 0.14 µg/kg,0.79 ± 0.24 µg/kg和7.30 ± 2.69 µg/kg,相对标准偏差分别为17.7%,6.5%,15.4%和18.5% (图11)。

Figure 11. The concentration and relative standard deviation of LABs in 3 replicate samples of actual river water
图11. 实际河水3个重复样品中LABs的浓度与相对标准偏差
由此可见,本方法用于实际样品的分析中,具有较好的重复性。
4. 结论
通过优化水体及土壤/沉积物中LABs的前处理和仪器定量方法,建立了一种以液液萃取–硅胶净化–气相色谱质谱法定量的方法,可以用于水体中LABs的定量分析,以全自动索氏脂肪抽提仪提取–硅胶净化–气相色谱质谱法定量的方法可以用于土壤沉积物中LABs的定量分析,相对于先前报道的分析方法而言,不仅简单易于操作,而且节约溶剂,且回收效率高,适合于实际分析检测中批量水体及土壤/沉积物样品分析。