1. 引言
痤疮是一种全球性的疾病,是最常见的一种累及毛囊皮脂腺的慢性炎症性皮肤病 [1],痤疮的发病率很高,据调查12~24岁青少年的痤疮发病率高达85%,而且发病年龄逐渐向儿童 [2] 和中年两极扩展,患病人数有逐年增加的趋势。痤疮发生的部位常为额头、面部、背部、胸部等皮脂腺丰富的地方,一般表现为粉刺,严重时则表现为丘疹、脓疱、结节、囊肿、瘢痕和色素沉着,甚至会造成患者毁容,因此痤疮对患者身心健康、生活、社交、学习也会造成极大的困扰 [3]。痤疮最主要的发病原因是皮脂分泌旺盛 [4]。皮脂腺的发育以及皮脂的合成与分泌均受到雄性激素的调控 [5] [6] [7],因此抑制皮脂腺雄性激素水平是治疗痤疮的途径之一。
在皮肤中5α-还原酶(5α-Reductase, 5α-R)是十分重要的雄性激素代谢酶,睾酮(testosterone, T)在皮脂腺5α-R的作用下可以转化为活性更强的双氢睾酮(Dihydrotestosterone, DHT),它与雄性激素受体(Androgen receptor, AR)的亲和性比T高2~5倍,诱导AR信号传导的效力比T高10倍 [8]。被DHT激活的AR与固醇调节元件结合蛋白(Sterol-regulatory element binding proteins, SREBPs)裂解活化蛋白的内含子上结合 [9],促进SREBPs的活化,接着SREBPs将通过影响更多脂质合成酶基因以及相关调控因子进一步刺激皮脂分泌,增强诱发痤疮的能力。Rosignoli [7] 等的研究表明雄性激素可以激活并上调SREBPs的表达。SREBPs能够调控脂肪酸、甘油三酯、胆固醇的合成,因此SREBPs的过量表达将促进脂质的大量合成甚至引起脂质代谢的紊乱 [10] [11] [12]。
《中华本草》中提到油茶叶味微苦,性平,有治疗皮肤溃烂瘙痒,疮疽的功效。本课题组前期证明油茶叶提取物具有良好的5α-R抑制活性,具有抵抗雄性激素能力。金黄地鼠是研究抗雄激素药物及对皮脂腺影响的理想动物模型,其背部皮脂腺斑可以提供天然的雄激素控制的皮脂腺系统,对雄激素类药物刺激的反应与人相似,且不需要人工处理造模,比如兔耳模型需要被涂抹煤焦油 [13] 或者油酸 [14] 或者接种痤疮丙酸杆菌 [15] 来建立痤疮状态模型。因此本文将以金黄地鼠为研究载体研究油茶叶提取物对金黄地鼠皮脂分泌的影响及其作用机制。
2. 材料试剂与仪器
2.1. 实验动物
SPF级健康雄性LVG叙利亚金黄地鼠(LVG Golden Syrian Hamsters) 49只,6周龄,体重100 ± 20 g:由北京维通利华实验动物技术有限公司提供,合格证号为SCXK(京)2016-0011。
2.2. 实验原料
油茶叶:由江山之间生物科技有限公司提供。
油茶叶提取物:实验室自制。
2.3. 实验试剂
总胆固醇(TC)试剂盒、甘油三脂(TG)试剂盒:南京建成生物工程研究所;金黄地鼠游离脂肪酸(NEFA)酶联免疫吸附试剂盒、金黄地鼠双氢睾酮(DHT)酶联免疫吸附试剂盒:江苏酶免实业有限公司;β-Actin购自Abcam公司;SRD5A1购自Thermo Fisher公司;SREBP-1c、AR购自SANTA CRUZ公司;丹参酮胶囊:河北兴隆希力药业有限公司。
2.4. 实验仪器
游标卡尺:得力集团有限公司;剃毛器:科德士有限公司;酶标仪:美国BioTek公司;冰冻切片机:THERMO CRYOSTAR NX50;正置光学显微镜:日本尼康NIKON ECLIPSE E100;成像系统:日本尼康NIKON DS-U3。
3. 方法
3.1. 油茶叶提取物的制备
将干燥油茶叶粉碎、过60目筛,称取油茶叶粉末按1:40 (w:v)加入50%乙醇溶液先搅拌浸泡3 h,再在50℃下超声震荡提取2 h (提取2次),4000 rpm离心10 min使得固液分离,采用旋转蒸发的方式减压浓缩上清液除去有机试剂,然后真空冷冻干燥至干粉,得到的油茶叶提取物,记为COLE (Camellia oleifera Leaves Extract, COLE)。
3.2. 动物分组及给药
《中华本草》中提到油茶叶的内服方式为取30 g/d煎汤喝下,成人体重按70 kg计,金黄地鼠与人的换算因子按7:1计 [16] [17],经过计算以900 mg/kg·d、2700 mg/kg·d作为COLE的低、高剂量。选用丹参酮胶囊作为本实验阳性对照物,根据等效计量换算,选择300 mg/kg·d作为施药剂量。根据实验需要28只金黄地鼠随机分成4组,每组7只,根据实验需求分为0.5% CMC-Na灌胃组(Gavage control group with 0.5% CMC-Na, G-CON)、COLE低剂量灌胃组(Gavage group with Low-dose COLE, G-LC)、COLE高剂量灌胃组(Gavage group with High-dose COLE, G-HC)、丹参酮胶囊灌胃组(Gavage group with Tanshinone, G-Tan)如下表1。
动物适应性饲养一周之后,进入正式试验,连续给药28 d,灌胃量为0.02 mL/g。

Table 1. Animal grouping and gavage administration
表1. 实验动物分组与灌胃给药
3.3. 皮脂腺斑面积的测量
实验前用电动剃须刀将金黄地鼠背部毛发剃除,用脱毛膏脱毛使背部的两只皮脂腺斑清晰露出,强光辅助下,使用游标卡尺测量双侧皮脂腺斑的最大横径(DT)和最大纵径(DL),计算皮脂腺斑的面积(S),并拍照记录。
3.4. HE染色
末次给药后切取金黄地鼠2 cm × 2 cm皮脂腺斑组织,10%甲醛固定液固定,石蜡包埋,切片,HE染色观察皮脂腺斑组织病理变化。
3.5. 油红O染色
固定皮肤组织,蔗糖脱水,制备冰冻切片,油红O避光染色观察皮脂腺皮脂分泌状况。
3.6. 血清以及皮脂腺斑组织TG、TC、NEFA含量的测定
金黄地鼠腹部采血,室温静置1 h待血液完全凝固,1000 × g离心10 min,分离血清。取0.5 g皮脂腺斑组织,加入9倍PBS缓冲液(pH7.4),进行匀浆,取上清液。按照试剂盒中说明进行操作,分别测定金黄地鼠血清以及测定皮脂腺斑组织内TG、TC、NEFA的含量。
3.7. 血清以及皮脂腺斑组织DHT含量的测定
样本处理同3.6,按照试剂盒中说明进行操作,测定金黄地鼠血清以及测定皮脂腺斑组织内DHT的含量。
3.8. 皮脂腺斑组织SRD5A1/AR/SREBP-1c信号通路相关蛋白的测定
采用Western blot技术测定金黄地鼠皮脂腺斑处皮肤组织SRD5A1、AR、SREBP-1c三种蛋白的表达水平,Western blot参照王薇 [18] 的方法进行:提取总蛋白,采用BCA定量试剂盒进行总蛋白定量;配制8%~12%分离胶和5%浓缩胶,每孔60 μg总蛋白上样,以浓缩胶60 V,分离胶80 V进行电泳2 h;蛋白质转膜及染色;脱脂奶粉封闭2 h;一抗杂交与二抗杂交;化学发光法显影。
3.9. 统计学方法
数据采用SPSS 17.0进行分析,用Graphpad Prism 6.0绘制,通过ANOVA分析进行统计学结果检验;采用Image J软件分析蛋白条带的光密度值。
4. 结果
4.1. 皮脂腺斑外观的变化
如图1所示,与G-CON相比,低、高剂量COLE和丹参酮胶囊随着给药时间的延长可以使皮脂腺斑变浅,皮脂腺斑与周围皮肤交界处逐渐模糊,斑点突起范围缩小。说明COLE能够改善金黄地鼠皮脂腺斑性状,使其颜色变浅。

Figure 1. Effects of COLE on the surface of sebaceous gland spots of golden hamsters
图1. COLE对金黄地鼠皮脂腺斑表观的影响
4.2. 皮脂腺斑面积的变化
金黄地鼠皮脂腺斑面积变化结果如图2所示,灌胃给药的2周内各组双侧皮脂腺斑面积变化不明显(p > 0.05),从第3周到第4周药物作用开始显现,与G-CON组相比,低、高剂量的COLE显著使双侧皮脂腺斑面积缩小(p < 0.05)。
 注:*p < 0.05表示G-LC、G-HC、G-TAN与G-CON比较;注:图A为灌胃组左侧皮脂腺斑面积,图B为灌胃组右侧皮脂腺斑面积。
注:*p < 0.05表示G-LC、G-HC、G-TAN与G-CON比较;注:图A为灌胃组左侧皮脂腺斑面积,图B为灌胃组右侧皮脂腺斑面积。
Figure 2. Effects of different COLE on the size of sebaceous gland spots (both sides) of golden hamsters
图2. COLE对金黄地鼠左右皮脂腺斑面积的影响
4.3. 皮脂腺斑病理学观察
如图3所示,与G-CON相比,G-LC组、G-HC组以及G-Tan组的皮脂腺泡明显减少且排列松散,腺体收缩变小,呈现梭状,腺体内部囊状腺泡和周围腺细胞均较少,说明COLE可以干预皮脂腺腺体的发育。
 空白灌胃组(G-CON)100×
空白灌胃组(G-CON)100×  低剂量COLE灌胃组(G-LC)100×
低剂量COLE灌胃组(G-LC)100×  高剂量COLE灌胃组(G-HC)100×
高剂量COLE灌胃组(G-HC)100×  丹参酮胶南灌胃组(G-Tan)100×
丹参酮胶南灌胃组(G-Tan)100×
Figure 3. Effects of different COLE on sebaceous gland spot tissue microstructure of golden hamsters
图3. COLE对金黄地鼠皮脂腺斑组织形态显微结构的影响
4.4. 皮脂腺斑脂质分泌观察
油红O为脂溶性染料可使组织中脂滴着橘红色,通过油红O染色观察金黄地鼠皮脂腺皮脂分泌情况,如图4所示G-CON组金黄地鼠皮脂腺斑组织内皮脂腺细胞胞浆内部明显可见大量团状红色脂滴,且融合成片状,脂滴分泌旺盛。与G-CON组相比,G-LC、G-HC、G-Tan组腺泡周围橘红色脂滴积累明显减少,说明COLE可抑制金黄地鼠皮脂腺皮脂分泌。
 空白灌胃组(G-CON)100×
空白灌胃组(G-CON)100×  低剂量COLE灌胃组(G-LC)100×
低剂量COLE灌胃组(G-LC)100×  高剂量COLE灌胃组(G-HC)100×
高剂量COLE灌胃组(G-HC)100×  丹参酮胶南灌胃组(G-Tan)100×
丹参酮胶南灌胃组(G-Tan)100×
Figure 4. Effects of different COLE on lipid accumulation in sebaceous glands by Oil Red O staining
图4. 油红O染色法检测COLE对皮脂腺斑中脂质积累的影响
4.5. 血清TG、TC、NEFA的含量
金黄地鼠血清中TG、TC、NEFA的含量变化如图5所示,G-CON相比,不同剂量的COLE与阳性药物可以极显著降低金黄地鼠血清中TG与NEFA的含量(p < 0.001),其中高剂量COLE显著减低血清中TC (p < 0.05),说明COLE可有效降低金黄地鼠体内脂质水平,并呈现剂量依赖性。
4.6. 皮脂腺斑组织TG、TC、NEFA的含量
如图6所示与G-CON,相比不同剂量的COLE与阳性药物丹参酮胶囊均可以极显著降低金黄地鼠皮脂腺斑组织中TG和NEFA (p < 0.001),该结果基本与血清脂质含量结果一致。说明COLE不仅可以显著降低体内血清脂质类成分含量,还可显著降低金黄地鼠皮脂腺斑皮脂含量。
 注:*p < 0.05,**p < 0.01,***p < 0.001表示G-LC、G-HC、G-TAN与G-CON比较;注:图A为血清TG含量,图B为血清TC含量,图C为血清NEFA含量。
注:*p < 0.05,**p < 0.01,***p < 0.001表示G-LC、G-HC、G-TAN与G-CON比较;注:图A为血清TG含量,图B为血清TC含量,图C为血清NEFA含量。
Figure 5. Effect of COLE on the contents of TG, TC and NEFA in serum of golden hamsters
图5. 金黄地鼠血清中甘油三酯、胆固醇、游离脂肪酸含量的变化
 注:*p < 0.001表示G-LC、G-HC、G-TAN与G-CON比较;注:图A为皮脂腺斑组织TG含量,图B为皮脂腺斑组织TC含量,图C为皮脂腺斑组织NEFA含量。
注:*p < 0.001表示G-LC、G-HC、G-TAN与G-CON比较;注:图A为皮脂腺斑组织TG含量,图B为皮脂腺斑组织TC含量,图C为皮脂腺斑组织NEFA含量。
Figure 6. Effect of gavaging COLE on the content of TG, TC and NEFA in sebaceous glands spot of golden hamsters
图6. 金黄地鼠皮脂腺斑组织中甘油三酯、胆固醇、游离脂肪酸的含量
4.7. 血清以及皮脂腺斑组织中DHT的含量
金黄地鼠血清中DHT含量如图7(A)所示,不同剂量COLE与阳性药物丹参酮胶囊灌胃组DHT含量水平极显著低于空白组(p < 0.001),说明COLE的干预可以极显著地抑制金黄地鼠体内DHT的生成,而血清雄性激素水平与皮脂腺分泌脂质密切相关。
金黄地鼠皮脂腺斑组织中DHT的含量结果如图7(B)所示,与G-CON相比不同剂量的COLE与阳性药物丹参酮胶囊均可以极显著降低(p < 0.01),其中G-HC组DHT水平最低。该结果基本与金黄地鼠血清DHT含量结果一致。
 (A)
(A)  (B)注:*p < 0.05,**p < 0.01,***p < 0.001表示G-LC、G-HC、G-TAN与G-CON比较。
(B)注:*p < 0.05,**p < 0.01,***p < 0.001表示G-LC、G-HC、G-TAN与G-CON比较。
Figure 7. Effect of gavaging COLE on the content of DHT in serum and sebaceous glands spot of golden hamsters
图7. COLE对金黄地鼠血清、皮脂腺斑组织内双氢睾酮含量的影响
4.8. 皮脂腺斑组织SRD5A1/AR/SREBP-1c信号通路相关蛋白的表达
COLE对于金黄地鼠皮脂腺斑组织SRD5A1/AR/SREBP-1c信号通路的影响如图8所示。与G-CON相比,不同剂量的COLE与阳性药物丹参酮胶囊的干预使得SRD5A1蛋白、SREBP1c蛋白、AR蛋白条带变浅,G-LC、G-HC、G-Tan组三种蛋白的相对表达量均极显著降低(p < 0.01)。COLE对蛋白表达的影响呈现剂量依赖性,高剂量COLE对三种蛋白表达下降程度的干预效果更加明显,说明COLE可有效降低SRD5A1-AR-SREBP1c信号通路表达,其中高剂量COLE作用效果最好。
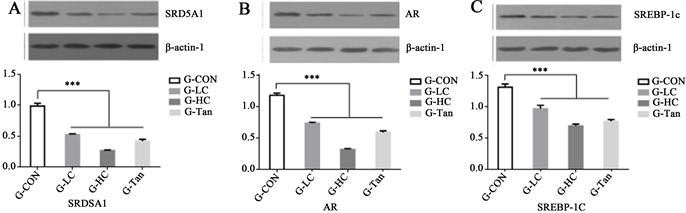 注:*p < 0.05,**p < 0.01,***p < 0.001表示G-LC、G-HC、G-Tan与G-CON相比
注:*p < 0.05,**p < 0.01,***p < 0.001表示G-LC、G-HC、G-Tan与G-CON相比
Figure 8. Effect of COLE on SRD5A1-AR-SREBP1c signaling pathway in sebaceous glands spot of golden hamster
图8. COLE对金黄地鼠皮脂腺斑组织SRD5A1-AR-SREBP1c信号通路的影响
5. 结论
本研究以金黄地鼠为研究载体探究COLE对其皮脂腺斑外观、显微结构、皮脂分泌的影响。研究结果如下:通过观察不同时间段皮脂腺斑性状发现COLE可以使皮脂腺斑颜色变浅,真皮中色素部分消失,皮脂腺斑会萎缩,色素性粗毛退化;通过比较不同时间段皮脂腺斑面积发现COLE可有效减小皮脂腺斑的面积,起到了抑制金黄地鼠皮脂腺的作用;组织病理学结果再次从微观层面印证明COLE的干预使得皮脂腺腺体排列松散,体积收缩变小,说明COLE能够抑制皮脂腺发育;油红O染色结果显示,COLE减少了金黄地鼠皮脂腺皮脂分泌;通过测定血清和皮脂腺斑组织中脂质类物质的含量发现,COLE不仅可以降低体内脂质水平,也能够降低皮脂腺脂质水平,这与油红O染色的结果一致;另外COLE还能抑制皮脂腺斑组织以及血清DHT水平。
Western blot技术测定SRD5A1/AR/SREBP-1c信号通路相关蛋白结果显示COLE的干预均可显著降低SRD5A1、AR、SREBP-1c这三种蛋白的表达。说明COLE改善其皮脂腺斑是通过激活SRD5A1/AR/ SREBP1c通路降低皮脂腺内5α-R酶蛋白的表达水平,影响其活性,使DHT的生成量大大减少,通过抑制AR的表达影响其发挥生物活性,减少DHT与AR结合的机会,进而在低水平下诱导调节脂质代谢的重要核转录因子SREBPs的表达,SREBPs内含子中的ARE与同样低水平的AR的结合调节下游脂质合成相关基因,使得整体脂质合成与分泌水平下降,缓和金黄地鼠皮脂腺斑部位旺盛的皮质分泌水平和雄激素水平。联系HE染色和油红O染色结果,COLE正是通过该过程使金黄地鼠皮脂腺斑处内部皮脂腺腺泡减少、体积变小、分布松散,从而改善外部表观性状,使其斑点变小变浅。
综上所述,本研究探讨了油茶叶提取物可以通过抑SRD5A1/AR/SREBP1c信号通路降低金黄地鼠皮脂腺脂质分泌,限制皮脂腺的发育进而改善皮脂腺斑的性状,为油茶叶和相关产品作为新的天然抗痤疮剂和化妆品添加剂的开发利用提供了研究思路和理论依据。
NOTES
*通讯作者。