1. 引言
热能储存一直是备受关注的能源问题之一。据报道,到2050年,在人口增长和工业发展的压力下,世界能源供应可能会翻一番 [1] [2]。热能可以根据其温度的高低分为低品位能源和高品位能源。高品位能源是指电力、机械功、燃气和液体燃料等。低品位能源包括热能、生物能等。在建筑能耗中,采暖、制冷是最耗能的,占整体比例的60%以上 [3]。据估计,到2030年,住宅能源消费将达到67% [4]。这些能耗可以靠太阳能、地热能等低品位能源提供 [5]。因此,如何有效地利用低品位能源并将其储存起来是目前亟待解决的问题。目前储热的方式主要分为三种:显热储热,潜热储热以及化学反应储热。与其他两种储热方式相比,潜热储热不仅拥有较大储热密度,而且设备投资较少,热量释放时更加容易控制。其中,盐水合物是常用的潜热储热材料,其热容量大,熔融过程中体积变化小 [6] [7] [8]。
相变材料作为蓄热系统中的主要材料,近年来受到了各领域的广泛关注,尤其是在建筑领域 [9]。Song Mengjie [10] 等人对近年来在建筑中加入相变材料以改善建筑能源性能进行了总结。Chaoen Li [11] 等人将相变材料与墙体结合,用于全年热能储存。在建筑储热应用方面,十二水磷酸氢二钠(Na2HPO4∙12H2O)拥有良好的前景 [12]。但是十二水磷酸氢二钠也具有大多数水合盐共同的缺点:过冷度较大及相分离等现象 [13]。通常解决这些问题的办法是添加形核剂及增稠剂。由于形核剂不能与相变材料完全结合,在长期使用过程中仍然存在过冷较大及相分离的问题。在建筑储热应用方面,要求相变材料能在缓慢降温的情况下快速完成相变。在过往的研究中,十二水磷酸氢二钠通常是在15℃及更低的环境下进行放热测试,然而在实际应用中,室温通常不会低于15℃ [14] [15]。试验发现,十二水磷酸氢二钠在15℃以上的环境下降温时,无法完全析晶。这种现象阻碍了实际应用。基于上述现象,本文研究了十二水磷酸氢二钠在不同冷却温度下冷却时,添加八水氢氧化钡(Ba(OH)2∙8H2O)以及CMC对其相变性能的影响。这对十二水磷酸氢二钠在储热方面的推广应用具有很大的意义。
2. 实验部分
2.1. 实验试剂
十二水磷酸氢二钠(Na2HPO4∙12H2O,上海阿拉丁生化科技股份有限公司,纯度:99%),八水氢氧化钡(Ba(OH)2∙8H2O,北京百灵威科技有限公司,纯度:99.9%),羧甲基纤维素钠(CMC,上海阿拉丁生化科技股份有限公司,纯度:M.W.250000)。
2.2. 实验仪器
DSC25差示扫描量热仪(美国TA公司),恒温加热槽(郑州华特仪器有限公司),低温恒温槽(宁波天恒仪器厂),PT100热电阻(颜历自动化仪表有限公司),无纸记录仪(厦门希科自动化科技有限公司),Mini Flex II型X射线衍射仪(XRD,日本理学)。
2.3. 十二水磷酸氢二钠复合相变材料的制备
采用热混法制备复合相变材料,即用电子天平称取一定质量的十二水磷酸氢二钠样品,并按一定量(1wt%, 2 wt%, 3 wt%, 4 wt%)称取八水氢氧化钡置于试管中,如表1所示。在60℃的恒温加热槽中加热到完全融化,并机械搅拌三分钟使其混合均匀。选取最佳配比的八水氢氧化钡,然后加入CMC,同样使用用热混法将其混合均匀。
2.4. 表征及测试
采用TA-DSC25差示扫描量热仪对十二水磷酸氢二钠及其复合相变材料进行热物性分析,温升范围为10℃~60℃,升温速率5℃/min;使用拉曼光谱分析仪以及X射线衍射仪对复合相变材料的晶体结构进行分析。
2.5. 熔化–凝固热循环实验升降温曲线的测定
将装有复合相变材料的试管中插入PT100热电阻(误差±0.1℃),分别编号后在温度为55℃的恒温水槽中加热。为保证相变材料完全熔化,待样品温度升至恒定温度并保温半小时以上,观察并记录样品熔化过程中的现象。最后,将完全熔化的样品材料放置在15℃,20℃,25℃低温恒温水槽中冷却凝固直至温度恒定。整个加热冷却热循环过程实时记录相变材料的温度变化,时间间隔5 s记录一次温度并传输至计算机,得出样品的步冷曲线图,经研究比较分析确定最佳形核剂。同时用此方法测得最终配比的样品的多次循环曲线。
3. 结果与讨论
3.1. Na2HPO4∙12H2O的步冷曲线
不同冷却温度下的步冷曲线如图1所示。从图中能够看出:纯Na2HPO4∙12H2O在15℃的条件下进行降温时,过冷度为4.6℃。随着冷却温度的降低,Na2HPO4∙12H2O的过冷度也随着温度降低而不断增加,当冷却温度为20℃时,样品的过冷度为7.2℃,当冷却温度为25℃时,过冷度增加到了9.6℃。同时在25℃的条件下冷却1小时,Na2HPO4∙12H2O不能完全析晶,试管上部存在一部分液体,需要继续冷却6小时后才会完全析晶。这是由于纯Na2HPO4∙12H2O在一定温度下形核后,由于应变能太大等原因而不能继续生长变大。继续降温可以获得更大的驱动力来促使析晶的发生 [16]。
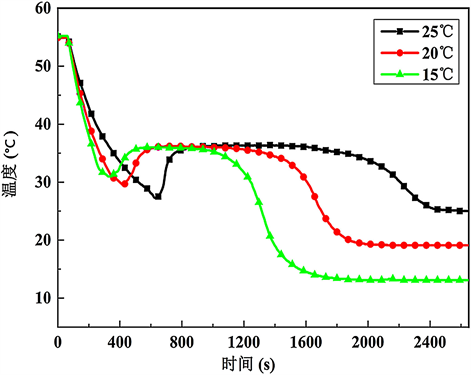
Figure 1. The supercooling degree of Na2HPO4∙12H2O at different cooling temperatures
图1. 不同冷却温度时Na2HPO4∙12H2O的过冷度
3.2. Na2HPO4·12H2O 的循环稳定性
良好的循环稳定性是复合相变材料长期使用的基础,因此对样品进行多次重复循环实验是很有必要的。为测试纯Na2HPO4∙12H2O的重复循环稳定性,分别在55℃升温,25℃、20℃、15℃降温的三种不同温度条件下对纯Na2HPO4∙12H2O各进行了20次加热–冷却循环试验,并对样品在不同冷却温度下的过冷度变化进行了统计,绘制出曲线。图2为过冷度变化曲线。
从过冷度变化统计曲线中(图2)能够看出,当冷却温度为15℃时,样品的过冷度随着循环次数的增加而略有波动,但是过冷度没有出现上升或者下降的趋势。当冷却温度升高到20℃,循环次数达到十次时,样品的过冷度随着循环次数的增加呈现出了增大的趋势。随着冷却温度升高达到25℃时,样品的过冷度在第五次循环时就出现增大的趋势。这说明冷却温度较高时,循环次数的增加会导致过冷度越早的出现增加。因此冷却温度过高会对Na2HPO4∙12H2O的析晶产生不良的影响,这在很大程度上影响了Na2HPO4∙12H2O在实际生产生活中的应用。

Figure 2. Curves of supercooling degree after multiple cycles at different temperatures
图2. 不同温度多次循环后过冷度变化曲线
3.3. Ba(OH)2·8H2O对过冷度的影响
图3为添加不同含量Ba(OH)2∙8H2O在三种冷却温度下对Na2HPO4∙12H2O过冷度影响曲线。从图3(d)过冷统计中可以看出:当冷却温度为15℃时,随着Ba(OH)2∙8H2O含量的增加,过冷度先减小后增大,添加量为2 wt%时过冷度最低为3.3℃。当冷却温度为20℃时,过冷度在2.5℃上下波动,当冷却温度达到25℃时,Ba(OH)2∙8H2O添加量为2 wt%时,复合相变材料的过冷度最低为4.2℃。添加Ba(OH)2∙8H2O后,相变材料在各个冷却温度下冷却一小时均能完全析晶。综合上述实验结果,当Ba(OH)2∙8H2O的添加量为2 wt%时,在三个冷却温度下的过冷度均为最小,因此Ba(OH)2∙8H2O的最佳含量定为2 wt%。添加Ba(OH)2∙8H2O起到了成核剂的作用:降低以界面自由能为主要障碍的成核位垒,晶核在成核剂上形成,就有可能使界面自由能降低,因此成核所需的驱动力减小,即成核可以在较小的过冷度下发生 [17]。
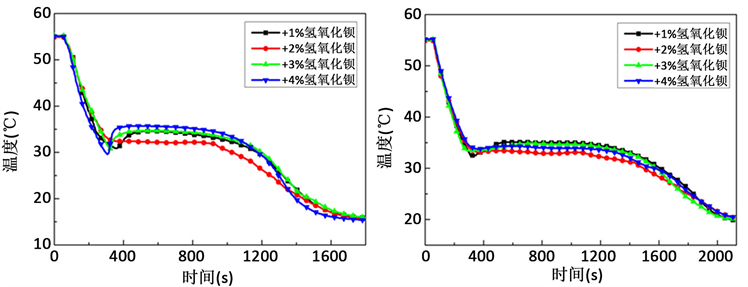 (a) (b)
(a) (b) 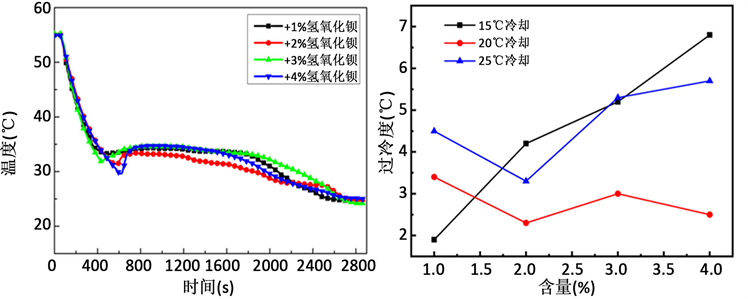 (c) (d)
(c) (d)
Figure 3. Influence of Ba(OH)2∙8H2O on the supercooling degree; (a) Cooling at 15˚C, (b) Cooling at 20˚C, (c) Cooling at 25˚C, (d) Supercooling degree
图3. Ba(OH)2∙8H2O对过冷度的影响;(a) 15℃冷却,(b) 20℃冷却,(c) 25℃冷却,(d) 过冷度统计
3.4. Ba(OH)2·8H2O对晶体结构的影响
图4为XRD图谱,从图中可以看出,未添加Ba(OH)2∙8H2O和添加Ba(OH)2∙8H2O后的样品特征衍射峰基本一致,未出现新的特征衍射峰,这表明加入Ba(OH)2∙8H2O不会改变Na2HPO4∙12H2O的晶体结构。
3.5. Ba(OH)2∙8H2O对热物性的影响
一般来说,性能优良的形核剂在减少过冷度的同时,不会对基体相变材料的热物性产生较大影响。从图5中可以看到纯Na2HPO4∙12H2O的相变温度为35.8℃,相变潜热为241.45 J/g,添加Ba(OH)2∙8H2O后样品的相变温度变为35.39℃,降低了约1.1%,相变潜热下降为237.26 J/g,下降了约1.7%。这是由于添加形核剂后,样品中相变材料的质量减少,储热密度有所降低。
 (a) (b)
(a) (b)
Figure 5. DSC curves of (a) pure Na2HPO4∙12H2O and (b) adding 2 wt% Ba(OH)2∙8H2O
图5. (a)纯Na2HPO4∙12H2O和(b)添加2 wt% Ba(OH)2∙8H2O的DSC曲线
3.6. CMC对复合材料热物性的影响
通常,添加增稠剂不会对复合相变材料的热物性造成严重的影响,但可以有效提高循环稳定性。添加2 wt% Ba(OH)2·8H2O/3 wt% CMC样品DSC测试曲线如图6所示,可以看出复合材料的相变温度为34.5℃,相变潜热为235.62 J/g,与未添加CMC之前相比,相变潜热有所下降,但下降幅度很小,仅为1.36 J/g。这说明添加3 wt%的CMC对复合材料的热物性影响很小。

Figure 6. DSC curves of samples with 2 wt% Ba(OH)2∙8H2O and 3 wt% CMC added
图6. 添加2 wt% Ba(OH)2∙8H2O和3 wt% CMC样品DSC曲线
3.7. CMC对复合材料循环稳定性的影响
从图7的过冷度统计中能够看出,在15℃冷却条件下,复合相变材料的过冷度在前六十次循环中可以维持在7.2℃以内,当循环次数超过60次后,过冷度开始逐渐增大;当冷却温度升至为20℃时,复合相变材料可以维持六十次较为稳定的循环,六十次之后过冷度仍然会随着循环次数的增加而不断增大;

Figure 7. Supercooling degree after circulation at different cooling temperatures
图7. 不同冷却温度下循环后过冷度
当冷却温度升至25℃时,复合相变材料的过冷度可以维持在7.4℃左右,随着循环次数的增加,复合相变材料的过冷度存在波动但没有出现增大的趋势。这说明添加CMC可以有效增加复合材料的循环稳定性。
3.8. 复合材料析晶情况
图8为纯Na2HPO4∙12H2O和最终制备的复合相变材料在25℃冷却条件下析晶0.5小时的对比图。从图中可以看出,纯Na2HPO4∙12H2O经过0.5小时的冷却,仍有接近一半未完全析晶,制备的复合相变材料完全析晶。这表明实验所制备的复合相变材料可以在较高冷却温度下快速完全析晶。

Figure 8. Photographs of (a) pure Na2HPO4∙12H2O and (b) composite phase change material after crystallization for 0.5 h
图8. (a)纯Na2HPO4∙12H2O和(b)复合相变材料在析晶0.5 h后的照片
4. 结论
本文主要研究了以Na2HPO4∙12H2O为基体,2 wt% Ba(OH)2∙8H2O为形核剂,3 wt% CMC为增稠剂的复合相变材料的过冷度,热物性以及循环稳定性,得到结论如下:
1) 十二水磷酸氢二钠的冷却温度越高,过冷度越大,完全析晶所需要的时间超过1小时。通过添加2 wt% Ba(OH)2∙8H2O可以有效将不同冷却温度下的过冷度控制在2℃至4.5℃之间,同时可以缩短完全析晶的时间。
2) XRD以及DSC测试结果表明,添加2 wt% Ba(OH)2∙8H2O对Na2HPO4∙12H2O的晶体结构和热物性影响很小。
添加3 wt% CMC可以明显提高循环稳定性,循环稳定的次数明显增加,同时DSC测试表明,CMC不会影响复合相变材料的热物性。复合相变材料在25℃冷却时可以在0.5 h内完全析晶,可以在实际生活中有效应用。
参考文献