1. 引言
含硫杂环化合物在医药、农药、合成和材料等领域有着重要的作用,其中四氢噻吩(噻吩类)广泛存在于天然产物分子和药物生物分子中,从合成和生物角度上来看也是一类具有吸引力的明星结构单元,在过去的几十年中,它引起了许多化学家和生物学家的高度重视。以四氢噻吩为骨架的衍生物具有重要的生理药理活性(图1),如:辅酶素Biotin [1] 是一种可溶性的维生素,可参与很多生物学功能;α-葡萄糖苷酶抑制剂Salacinol [2] 和Kotalanol [3] 能减缓小肠对葡萄糖的吸收从而降低血糖,有效避免糖尿病患者发生心血管疾病;盘尼西林衍生物(Penicillin G) [4] 可以破坏细菌的细胞壁来杀死细菌;(R)-Tetrahydrothiophen-3-ol [5] 是一种制备抗菌剂刘培南(Sulopenem)的关键中间体;4′-硫杂阿拉伯核苷(4'-Thioarabinonucleosides) [6] 对几种疱疹病毒具有抗病毒活性,对抑制人体巨细胞病毒特别有效,等等。因此其衍生物的合成方法引起了人们极大地研究兴趣。
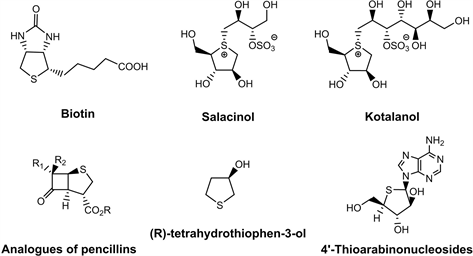
Figure 1. Some bioloigically important tetrahydrophene derivatives
图1. 一些重要的具有生物活性的四氢噻吩类衍生物
由于四氢噻吩类化合物的重要用途,近年来,越来越多的催化体系被应用到合成四氢噻吩类化合物的合成反应中。已报道的方法有:一、α-巯基酮与α,β-不饱和醛发生的Michael/Michael多米诺反应 [7];二、g-卤代芳酮与硫代磷酸进行的串联反应 [8];三、2,5-二羟基-1,4-二噻烷和α,β-不饱和羰基化合物进行Sulfur-Michael/Aldol串联反应 [9] [10]。在这里,本课题组选用2,5-二羟基-1,4-二噻烷为硫源来合成四氢噻吩类化合物,其中,以硝基烯类化合物为Michael受体的研究较少 [11] [12] [13]。本文将制备的Cu-MOF/FeOOH复合材料应用于水相中催化2,5-二羟基-1,4-二噻烷与硝基烯的串联环化反应(图2),分别考察了催化剂种类、反应温度、反应时间和催化剂用量等因素对反应产率的影响,同时对反应底物普适性进行了研究(最高产率可达98%),并对反应机理进行了分析。

Figure 2. The Friedel-Crafts reaction of Indole and 1-Vinylpyrrolidin-2-one
图2. 吲哚与1-乙烯基吡咯烷-2-酮的傅克反应
2. 实验部分
2.1. 试剂与仪器
1H NMR使用Varian inova-400型核磁共振仪(TMS为内标,CDCl3为溶剂);反应跟踪用ZF-2型三用紫外仪观察;柱层析用硅胶(200~300目,青岛海洋化学公司生产);所用试剂及溶剂均从Adamas-Beta试剂公司订售,用前未经处理。
2.2. 双金属复合材料的合成
2.2.1. Cu-MOF前驱体的制备
称取Cu(NO3)2·3H2O (9 mmol, 2.188 g)在反应釜内衬中,加入20 mL去离子水,磁力搅拌均匀得到溶液A;称取1,3,5-苯三甲酸 (即3 mmol, 1.05 g)和量取20 mL无水乙醇在50 mL烧杯中,超声溶解得到溶液B。随后,在搅拌下将溶液B迅速倒入溶液A中,搅拌十钟后转移至反应釜中,在110℃下保温12 h,待反应结束后,冷却至室温,用无水乙醇作为洗液,离心洗涤四次,得到的样品置于烘箱进行80℃干燥12 h。最后得到Cu-MOF前驱体。
2.2.2. Cu-MOF/FeOOH复合材料的制备
称取FeCl3·6H2O (1 mmol, 0.2703 g)和量取40 mL无水乙醇于50 mL烧杯中,再加入0.5000 g上述制得的Cu-MOF前驱体,超声10 min,在磁力搅拌下加入NH4HCO3 (3 mmol, 0.2703 g),用保鲜膜封住烧杯口,室温搅拌12 h。反应完全后,离心洗涤分离,用无水乙醇作为洗液,离心洗涤三次,所得固体样品放进减压干燥箱干燥,干燥温度为60℃,干燥12 h,得到Cu-MOF/FeOOH复合物材料。
2.3. 目标化合物3a-3m的合成结构分析
目标化合物的合成(以标准反应为例):将硝基苯乙烯1a (0.6 mmol, 0.08949 g)、2,5-二羟基-1,4-二噻烷2 (0.75 mmol, 0.1142 g)、Cu-MOF/FeOOH (0.005 g)和1.5 mL去离子水于反应管中,在100℃下磁力搅拌回流反应10 min。反应结束后,用二氯甲烷萃取三次,减压浓缩,柱层析(乙酸乙酯:石油醚 = 1:4洗涤)分离纯化得目标产物。目标化合物的表征如下:
3a:4-硝基-5-苯基四氢噻吩-3-醇,浅黄色油状物;1H NMR (400 MHz, CDCl3) d:7.48~7.45 (m, 2 H),7.37~7.30 (m, 3 H),5.24 (d, J = 8.0 Hz, 1 H),5.07~4.99 (m, 2 H),3.52~3.48 (m, 1 H),3.07~3.04 (m, 1 H)。
3b:5-(4-氯苯基)-4-硝基四氢噻吩-3-醇,黄色油状物;1H NMR (400 MHz, CDCl3) d:7.33 (d, J = 8.0 Hz, 2H),7.22~7.20 (m, 2H),5.14 (d, J = 8.0 Hz, 1H),4.96~4.85 (m, 2H),3.42~3.38 (m, 1H),2.95~2.91 (m, 1H)。
3c:4-硝基-5-(对甲苯基)四氢噻吩-3-醇,浅黄色油状物;1H NMR (400 MHz, CDCl3) d:7.35~7.27 (m, 2H),7.13 (d, J = 8.0 Hz, 2H),5.22 (d, J = 8.0 Hz, 1H),5.02~4.84 (m, 2H),3.46~3.42 (m, 1H),3.00~2.97 (m, 1H), 2.30 (s, 3H)。
3d:5-(4-异丙基苯基)-4-硝基四氢噻吩-3-醇,浅黄色油状物;1H NMR (400 MHz, CDCl3) d:7.30 (d, J = 8.0 Hz, 2H),7.13 (t, J = 8.0 Hz, 2H),5.16 (d, J = 12.0 Hz, 1H),4.96~4.91 (m, 2H),3.41~3.37 (m, 1H),2.95~2.92 (m, 1H),2.83~2.76 (m, 1H),1.14 (s, 6H)。
3e:5-(4-(苄氧基)苯基)-4-硝基四氢噻吩-3-醇,黄色油状物;1H NMR (400 MHz, CDCl3) d:7.35~7.18 (m, 6H),6.87 (d, J = 4.0 Hz, 1H),6.80~6.73 (m, 2H),5.05 (d, J = 4.0 Hz, 1H),4.86~4.76 (m, 2H),3.81 (s, 2H),3.20~3.16 (m, 1H),3.06~3.01 (m, 1H)。
3f:5-(萘-1-基)-4-硝基四氢噻吩-3-醇,无色油状物;1H NMR (400 MHz, DMSO) d:7.77~7.73 (m, 2H),7.52~7.43 (m, 2H),7.43~7.41 (m, 3H),5.36~5.33 (m, 1H),5.06~5.02 (m, 2H),3.51~3.47 (m, 1H),3.06~3.03 (m, 1H)。
3. 结果与讨论
3.1. 反应条件的优化

Table 1. Different condition effect on the reaction
表1. 不同反应条件的优化a
a反应条件:硝基苯乙烯(0.6 mmol),2,5-二羟基-1,4-二噻烷(0.9 mmol),催化剂(0.005 g)在水(1.5 mL)中回流条件下反应。b柱层析产率。c催化剂用量0.01 g和0.0025 g。
以硝基苯乙烯和2,5-二羟基-1,4-二噻烷在水相中的反应为标准反应,进行系统的反应条件优化(表1)。在没有催化剂的条件下,反应8 h没有检测到目标产物;当Cu-MOF/FeOOH复合材料加入反应体系中,反应8 h后有93%的产物生成。在这里考虑到合成复合材料的原料会对反应有影响,即对CuSO4和FeOOH进行了考察,结果显示CuSO4对反应无催化效果,FeOOH只有很低的催化效果。确定了Cu-MOF/FeOOH复合材料为催化剂后进行了反应时间的考察,当反应进行10 min后,反应就能得到91%的产率;如果继续缩短反应时间,反应产率明显降低。同样,当反应温度降低,即温度没有达到回流状态,产率也出现降低趋势,室温下没有产物生成。最后对催化剂的用量进行了考察,结果显示,增加催化剂用量对反应产率提升不大或无变化;当减少催化剂用量对反应产率有较大影响(0.0025 g Cu-MOF/FeOOH,产率下降到74%)。确定的最佳反应条件为:硝基苯乙烯(0.6 mmol)、2,5-二羟基-1,4-二噻烷(0.9 mmol)和Cu-MOF/FeOOH (0.005 g)在水(1.5 mL)中回流条件下反应10 min。
3.2. 反应底物的扩展

Table 2. Substrate scope of tetrahydrophene cyclization reaction
表2. 四氢噻吩类环化反应底物普适性研究a
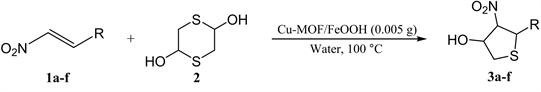
a反应底物比例硝基烯:2,5-二羟基-1,4-二噻烷 = 4:5,催化剂Cu-MOF/FeOOH的用量0.0050 g,1.5 mL去离子水作为溶剂,在100℃下反应。b柱层析产率。
在最优条件下研究了含有不同取代基的硝基芳乙烯与2,5-二羟基-1,4-二噻烷的串联环化反应(表2)。随着R芳环4-位上取代基团位阻不断变大(Entry 1,3和4),反应产率呈现下降趋势(91%,88%和73%);当芳基4-位为卤素(如Cl-)取代时,反应可以得到98%的高产率(Entry 2);当芳基4-位是苯甲氧基取代时,反应只能得到15%的目标产物(Entry 5);当底物换成1-(2-硝基乙烯基)萘时,只能得到6%的目标产物(Entry 6)。
3.3. 放大量实验研究
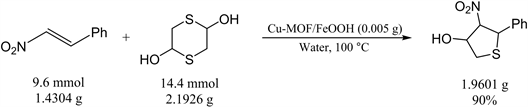
Figure 3. Scale-up version of the reaction
图3. 4-硝基-5-苯基四氢噻吩-3-醇合成的扩大量反应
在最优反应条件下,对标准反应进行了反应放大量实验研究(如图3)。反应物均放大到克级,最终反应依然可以得到90%的产率。
3.4. 催化剂循环使用性
为了验证催化剂Cu-MOF/FeOOH的循环利用能力,我们对反应溶液进行了离心并分离出催化剂,干燥后继续用于第二次催化反应,依此操作进行后续的催化剂循环使用研究实验。如图4所示,催化剂在进行二次利用时,催化剂活性明显降低(42%产率),但在进行第三次循环使用总,反应未获得目标产物。可能双金属复合物结构中的活性组分在水相分离中有大量的流失,以至于无法进一步进行反应催化。于是在后续的“沥滤反应”研究中,发现水相滤液对反应有催化活性,从而说明,催化剂的活性组分溶解到水溶剂中,也说明Cu-MOF/FeOOH的结构在水中不稳定。为了提高此复合材料的稳定性和催化活性,我们对复合材料进行了高温热处理获得Fe3O4/Cu/C纳米材料,然后将其应用到4-硝基-5-苯基四氢噻吩-3-醇合成反应中,只能得到较低产率的目标产物。由此可以得到,配合型复合材料对本反应的催化效果优于金属氧化物复合材料。

Figure 4. Recycling test of Cu-MOF/FeOOH Composites
图4. Cu-MOF/FeOOH复合物材料的循环研究
3.5. 反应机理
硝基苯乙烯与2,5-二羟基-1,4-二噻烷反应制备四氢噻吩类化合物可能的反应机理如图5所示。根据已报道的工作 [10] [11],2,5-二羟基-1,4-二噻烷在反应过程中首先原位生成巯基乙醛,然后与硝基苯乙烯发生硫迈克加成反应,在硝基的α-位生成碳负离子,最后碳负离子进攻醛基发生分子内的Aldol反应,从而生成四氢噻吩类化合物。

Figure 5. Proposed reaction mechanism for the reaction
图5. 反应可能的机理
4. 结论
本文设计了一种简单有效的合成多取代四氢噻吩衍生物的方法。利用制备的Cu-MOF/FeOOH双金属复合材料作为催化剂,水相中能够有效地催化硝基苯乙烯和2,5-二羟基-1,4-二噻烷的串联环化反应,获得了较好的产率,最高可达98%。该反应具有操作简单、反应时间短、原子利用率高和环境友好等特点,极大地丰富和发展了四氢噻吩结构的催化合成方法。
基金项目
广东省基础研究面上项目(2020A1515010252)和岭南师范学院人才专项基金(No. ZL1908)支持。