1. 引言
不同土地利用方式是人类干预土壤质量最直接的活动,转变土地利用方式会通过影响土壤有机物的输入、水分和养分迁移以及微生物活动等,最终导致土壤质量发生变化 [1]。土壤质量与健康状况,可以通过土壤微生物的物种数量和群落结构及其空间分布反映出来 [2] [3] [4]。土壤微生物多样性是指土壤生态系统中所有的微生物种类、拥有的基因以及其与环境之间相互作用的多样化程度 [5]。目前,关于土壤微生物多样性的研究主要集中在土壤微生物多样性的科学内涵及其生态服务功能 [5]、土壤微生物多样性监测的技术与方法 [6] [7]、不同植被恢复模式及环境因素对土壤微生物多样性的影响 [8] [9] [10] [11]、土壤微生物多样性的维持机制 [12]、栽培技术及管理措施对土壤微生物多样性的影响 [13]、植物群落演替对土壤微生物多样性的影响 [14] [15] [16]。王晓雯曾对贵州葡萄园土壤微生物多样性进行研究 [17],部分学者也对喀斯特峰丛洼地植被变化过程中的土壤微生物数量及群落功能多样性进行研究 [18],但关于石山坡地不同土地利用方式土壤微生物多样性的研究报道甚少,关于桂西北岩溶地区山野葡萄种植坡地土壤微生物多样性的研究鲜有报道。
土壤微生物是土壤质量的重要组成及物质循环的调节者,对凋落物的分解、腐殖质的合成、养分循环以及物质和能量的代谢有重要的作用 [19]。丛枝菌根真菌能够提高植物对土壤中大量元素氮、磷等和多种微量元素的吸收能力,促进植物生长发育,继而达到涵养水源,保持水土的作用 [20]。相关研究结果表明,在不同类群的土壤微生物中,细菌和放线菌的数量最多 [21]。在喀斯特岩溶地区不同土地利用方式中,耕地土壤微生物的多样性指数最大,荒地最低,且细菌在土壤微生物组成中数量最多 [22]。由于人类过度干扰破坏造成的土地石漠化,使土壤微生物数量与种类急剧下降,降幅高达98%以上 [23],从而使脆弱的岩溶地区土壤环境更为恶化。
土壤酶对维持土壤生态系统的正常功能具有十分重要的作用。土壤酶能催化有机质分解和养分循环等生化反应,其活性可作为表征土壤质量的关键指标之一 [24],不适当的土地利用方式,会使土壤中的动植物残体及腐殖质富集情况发生改变,从而使与之相关的土壤酶活性受到影响 [25]。
桂西北岩溶地区由于特殊的地质背景及强烈的人为干扰破坏,导致其生态环境脆弱,石漠化问题比较严重 [26]。喀斯特岩溶地区土地资源紧缺,人地矛盾突出,当地群众为了解决生计问题,对石山坡地进行高强度的开发利用,陡坡耕种使土壤结构遭受破坏,土壤养分丧失,土地生产力严重下降,进一步加剧了水土流失和土地荒漠化。本研究拟通过高通量测序技术与传统的土壤理化分析相结合,说明桂西北石山坡地不同土地利用方式的土壤微生物种群多样性及其结构差异,以便为喀斯特岩溶地区石山坡地的可持续利用提供基础数据和理论支持。
2. 材料与方法
2.1. 土壤样品采集及处理
在查阅文献和实地调查的基础上,2019年11月中旬,在广西河池市罗城仫佬族自治县某山葡萄种植基地及其邻近石山坡地,根据土地利用方式不同,分别选取植被严重破坏的裸地(编号LCS1)、山葡萄种植样地(编号LCS2)和保护状况较好的次生植被样地(编号LCS3)作为研究样地,每个样地面积不少于200 m2,坡度坡向和地形地貌基本一致。按梅花形采样法采集土壤样品,过2 mm标准筛,并做好相关的采样记录,一部分土壤样品存于灭菌的聚乙烯密封袋中,放到移动小冰箱低温保存,尽快带回实验室,放入−86℃超低温冰冻箱中保存,用于土壤微生物DNA序列测定;另一部分土壤样品则放置于阴凉处自然风干,去除杂物和凋落物,用微型土壤样品粉碎机粉碎,过20目、60目和100目标准筛,分别装入聚乙烯密封袋中,做好标记,阴凉干燥处保存,用于土壤理化性质和土壤酶活性的测定。
2.2. 实验方法
2.2.1. 土壤理化性质测定
土壤pH测定用电位计法(水土比为2.5:1) [27];水分含量的测定用重量法;有机质含量测定用重铬酸钾氧化——分光光度法(HJ615-2011)得到有机碳含量,有机质含量的计算还需乘系数1.724 [28];全氮含量的测定用凯氏定氮法 [29];碱解氮含量的测定用碱解扩散法 [30];全磷含量的测定用氢氧化钠碱熔——钼锑抗比色法 [31];速效磷测定用碳酸氢钠浸提——钼锑抗比色法 [32];全钾含量的测定用氢氧化钠碱熔——火焰光度计法 [33];速效钾含量测定用醋酸铵浸取——火焰光度计法 [34]。
2.2.2. 土壤酶活性测定
本研究测定的土壤蔗糖酶、脲酶、碱性磷酸酶活性,分别用3,5-二硝基水杨酸比色法、苯酚钠比色法和磷酸苯二钠比色法 [35]。
2.2.3. 土壤微生物DNA序列测定
土壤微生物DNA序列的测定由专门的测序公司进行。16S-V4为测序区域,GreenGene数据库为注解数据库,测序的具体流程主要为:样品制备→核酸质检→PCR扩增→产物纯化→文库质检→HiSeq上机测序 [36]。
2.3. 数据处理
在土壤理化性质的测定中,每个样品的测定均做3个重复,结果取平均值;在土壤酶活性的测定中,一个实验做3个重复的无土空白对照,每个样品除了做3个重复之外,还需要做1个无基质对照;土壤微生物测序数据,主要是通过数据过滤处理筛选高质量的序列reads出来拼接成Tags,接着进行OUT聚类、物种注释,再次筛选后得到用于后期分析的OUT [37] [38]。
用Office Excel 2019和SPSS22.0对以上数据进行分析处理,用最小显著性差异法(LSD)对实验结果进行多重比较方差分析 [39]。
3. 结果与分析
3.1. 不同样地土壤理化性质及土壤酶活性的差异
三种不同调查样地土壤的基本理化特性及土壤酶活性测定结果见表1。

Table 1. Test results of soil physical and chemical properties and soil enzyme activity in different sites
表1. 不同样地土壤理化特性及土壤酶活性测定结果
注:同一个指标的不同字母表示差异显著(0.05水平)。
3.1.1. 土壤pH
由表1可知,LCS1样地的土壤pH接近中性(pH ≈ 6.5),LCS3样地pH为中性(pH = 6.5~7.5),LCS2样地pH在5.5~6.5之间,属于弱酸性土壤。说明石山坡地种植(特别是施用化肥)在一定程度上会造成土壤酸化,且随着种植时间的增加,土壤酸化越来越严重,导致土壤微生物数量渐少,影响土壤有机质的分解和土壤中碳、氮循环等,从而影响作物正常生长发育。
3.1.2. 土壤含水量
三个不同样地土壤含水量差异显著,其高低排序为:LCS3 > LCS2 > LCS1。在未被破坏的LCS3样地中,地表植被种类和数量较多,植被通过对降水的截留、吸收和下渗来保持水土、涵养水源。而相比之下,LCS1样地土壤含水量大大降低,植被完全被破坏,地表水分得不到储存。LCS2样地含水量较低,这可能是由于山葡萄栽培过程中,经常需要清除杂草和松土,植被覆盖率降低,土壤水分蒸发所致。
3.1.3. 土壤有机质含量
由表1可知,三个调查样地的土壤有机质含量差异显著。LCS3样地有机质含量为62.36 g/kg,最为丰富,LCS2样地次之,LCS1样地最贫乏。按照我国第二次土壤普查养分分级标准 [40] (以下简称分级标准)来看,LCS2样地和LCS3样地土壤有机质含量为很丰富的等级(>40 g/kg),LCS1土壤有机质含量属于丰富等级(30~40 g/kg)。土壤中的有机质主要是动植物残体,能为土壤中生物体的生命活动提供营养条件 [41]。种植山野葡萄的LCS2样地,其土壤有机质含量比未受人为严重干扰的LCS3样地低得多,可见,在石山坡地进行陡坡耕种,因水土流失等原因,会降低土壤有机质的含量。
3.1.4. 土壤氮含量
氮能促进细胞分裂和增长,促进植物生长和果实的发育,还能影响光合作用必备的叶绿素a和叶绿素b的合成,因此,氮素也是与产量密切相关的营养元素。土壤氮素包括全氮和碱解氮,土壤全氮可分为有机氮和无机氮,其含量用于衡量土壤肥力状况。相关研究结果表明,碱解氮的含量与有机质含量密切相关,有机质含量高,碱解氮含量也高,反之亦然 [42]。由表1可知,三个不同样地土壤全氮含量表现为:LCS1 > LCS3 > LCS2,裸地LCS1的土壤全氮含量最高。依照最新的土壤普查养分分级标准 [40],本研究的三个调查样地土壤全氮含量均在1.0~1.5 g/kg范围内,属于中等水平。三个样地碱解氮含量表现为:LCS3 > LCS2 > LCS1,其排序与土壤有机质含量的高低排序相同。
3.1.5. 土壤磷含量
磷是植物生长发育必备的一种元素,它可以加速细胞的分裂与增殖,促进植物体的生长发育,合理施用可增加作物产量,改善品质。由表1可知,三个不同样地土壤全磷含量差异显著,从高到低为:LCS2 > LCS3 > LCS1,LCS2样地的全磷含量为1.14 g/kg,位列三个样地之首。土壤速效磷含量更是有着十分明显的不同,种植状况好的LCS2中速效磷的含量高达51.79 mg/kg,属于分级标准中的很丰富等级(>40 mg/kg),这是由于农民施用的磷肥量大,地表速效磷残留较多,使得速效磷在土壤中得到富集。与之相比,裸地和未被破坏样地的土壤速效磷含量偏低,属于缺乏等级(5~10 mg/kg)。
3.1.6. 土壤钾含量
钾亦是植物生长所必需的一种元素,钾含量充足时,植物不易患病,抗倒伏,产品品质较好。由表1可知,三个不同样地的土壤全钾含量从高到底排序为:LCS3 > LCS2 > LCS1,并无显著差异。从养分分级标准来看,三个样地的全钾含量均属于很缺乏等级(5~10 mg/kg),由此可见,在桂西北石山坡地中,全钾含量在土壤养分组成中是最为缺乏。速效钾是土壤中容易被作物吸收利用的钾素,其含量可作为土壤钾素供应状况的重要指标。但钾素在土壤中的移动性较强,容易受水土流失的影响 [43]。从表1可见,三个样地土壤速效钾含量有显著差异,其中,LCS2样地中速效钾的含量最高(359.81 mg/kg),含量最低的样地为裸地LCS1 (86.17 mg/kg),这可能是由于人为破坏地表植被覆盖,在一定程度上导致了水土流失,间接影响了土壤钾素含量。
3.1.7. 土壤蔗糖酶活性
土壤中的蔗糖水解成葡萄糖和果糖,这个过程需要蔗糖酶催化,催化产物是植物和土壤微生物的营养源,关系到作物的生长 [44]。由表1可知,所研究的三个样地的土壤蔗糖酶活性在46.07~57.14 mg/g之间。LCS3样地的蔗糖酶活性最高,达57.14 mg/g;LCS2样地次之,为54.26 mg/g;LCS1样地最低,仅为46.07 mg/g。
3.1.8. 土壤脲酶活性
土壤脲酶能催化尿素分解,将不容易被植物根系吸收利用的氮转为易吸收的氨,土壤的供氮能力可以通过其活性来反映 [45]。由表1可知,三个样地的脲酶活性有显著的差异,从高低排序为:LCS3 > LCS1 > LCS2。其中,LCS3样地的脲酶活性最高,为0.52 mg/g;LCS2样地的活性最低,为0.26 mg/g;LCS1样地则为0.30 mg/g。
3.1.9. 土壤碱性磷酸酶活性
土壤中的磷酸酶可将有机磷化合物分解,参与磷循环,催化磷酸酯类或磷酸酐的水解,其活性高低直接影响土壤有机磷的分解转化及其生物有效性 [46]。由表1可知,三个样地土壤的碱性磷酸酶活性相差不大,LCS3样地的碱性磷酸酶活性最高,为1.52 mg/g;LCS1样地的酶活性次之,为1.22 mg/g;LCS2样地的酶活性最低,为1.12 mg/g。
3.2. 不同样地土壤细菌Tags、OTU差异比较
3.2.1. 细菌测序数据过滤及Tag连接
三个不同样地的原始测序数据经过精细的数据过滤后得到的结果见表2。由表2可知,三个样地土壤细菌的原始测序的长度范围在44.33~45.23 Mbp之间,过滤后的Clean Data长度都是37.5 Mbp;原始测序数据过滤后的数据保留率较高,在82.92%~84.60%之间。也就是说,该结果能够比较真实地反映三个不同调查样地的土壤细菌群落结构。

Table 2. Filtering table of different soil bacterial sequencing data
表2. 不同样地土壤细菌测序数据过滤表
对Clean Data进行序列拼连得到Tags连接,结果见表3。由此可知,三个不同样地的原始序列条数分别为:LCS1样地75,039条,LCS2样地75,033条,LCS3样地75,035条,序列条数相差甚微。连接率高达99.9%,Tags连接后每个样地的去除引物序列Tags Without Primer各个样地约有73,000多条,其中LCS3样地的Tags Without Primer最少,仅有73,460条,三个样地的Tags连接利用率在97.90%~98.33%之间,平均长度为253 bp。
3.2.2. 细菌OTU聚类
OTU聚类是根据序列的相似性将其分为不同小组,一个小组为一个OTU,经比对后得到OTU丰度统计表。三个样地的土壤细菌OTU聚类结果见表4。由此可知,LCS1样地的Tag 数量和OTU数量最低,LCS2样地的OTU数量最高,达4000种以上,LCS3样地的OTU数量为3728种。不同的土地利用方式对土壤微生物物种丰度有着较大的影响,裸地土壤细菌群落最少,种植山野葡萄的样地土壤细菌群落最多。

Table 4. Statistics of OTU clustering results of soil bacterial communities in different plots
表4. 不同样地土壤细菌群落OTU聚类结果统计
3.2.3. OTU Venn图
OUT Venn图可以清楚地展示样品间的OTU数目,包括共有的和特有的。三个不同样地土壤细菌群落的Venn图如图1所示。由此可见,三个不同样地之间的土壤细菌群落均有重复,其中LCS1样地特有的土壤细菌OTU数为607,LCS3样地特有的为672,LCS2样地为805。可见,在种植山野葡萄的样地土壤中,其特有的细菌群落比裸地和未受人为明显破坏的样地明显增多,一定程度上反映了不同土地利用方式对土壤微生物多样性的影响,也从一个侧面验证了适度干扰可以提高生物群落物种多样性的假说。
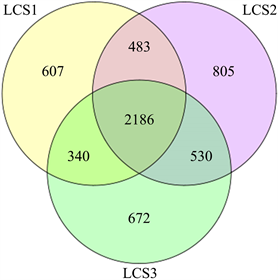
Figure 1. Venn diagram of soil bacteria in different plots
图1. 不同样地土壤细菌的Venn图
3.3. 不同水平土壤细菌群落组成
3.3.1. 门水平
图2为三个不同调查样地的土壤细菌群落在门水平上的物种丰度柱状图。图中不同的细菌门类被不同颜色标记,颜色的比例大表示该细菌门类物种相对丰度高,反之则低。LCS1样地检测到的细菌门数为36门,LCS2样地34门,LCS3样地40门。门水平的土壤细菌群落相对丰度见表5。在LCS1样地中,相对丰度大于1%的细菌菌群相对丰度总和是97.28%,LCS2样地是96.84%,LCS3样地则是96.75%。由图2和表5可知,酸杆菌门在LCS1和LCS2样地中相对丰度达26%以上,是优势菌门,这两个样地的次优势菌门均为变形菌门;而LCS3样地的优势菌门恰好与之相反,为变形菌门。总体来看,三个不同样地的土壤细菌特点是物种组成相似,占比不同,相对丰度在10%以上的菌门几乎相似,不同的是LCS2样地的放线菌门丰度低于10%。

Table 5. The relative abundance of soil bacteria at the phylum level
表5. 门水平上的土壤细菌相对丰度
注:相对丰度的单位用%表示,样地中所有相对丰度 ≤ 1%的菌门合并为罕见门类。
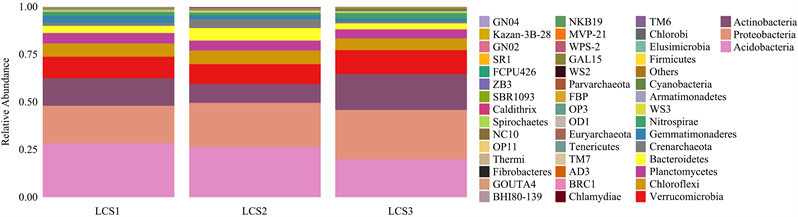
Figure 2. Histogram of species abundance of soil bacterial communities in different plots (phylum level)
图2. 不同样地土壤细菌群落物种丰度柱状图(门水平)
由物种相对丰度可得到物种丰度热图,不同样地土壤细菌在门水平的物种丰度热图如图3所示。纵向聚类表示枝长越短,不同样品间物种组成越相似;横向聚类则是表示枝长越短,不同调查样地的土壤样品之间,该物种的丰度越相似。由图3可知,从纵向聚类来看,LCS1和LCS2这两个样地土壤细菌的物种组成相似;从横向聚类来看,放线菌门和硝化螺旋菌门枝长最短,说明这两个菌门在本研究的石山坡地三种不同样地中丰度情况相似。

Figure 3. Species abundance heat map of soil bacterial communities in different plots (phylum level)
图3. 不同样地土壤细菌群落物种丰度热图(门水平)
3.3.2. 属水平
图4是三个不同样地的土壤细菌群落在属水平的物种丰度柱状图。由图4可知,在属的水平上,三个不同样地的土壤细菌物种组成几乎相同,只是占比不同。属水平上的土壤细菌群落相对丰度见表6。由此可知,三个不同样地的优势菌属均为DA101,其中,LCS1样地的次优势菌属为红游动菌属,未指明菌属Candidatus_Nitrososphaera以及凯斯通氏菌属;LCS2样地的次优势菌属为未指明菌属Candidatus_Nitrososphaera、红游动菌属、凯斯通氏菌属;LCS3样地的优势菌属和次优势菌属情况和LCS1样地表现一致。

Figure 4. Histogram of species abundance of soil bacterial communities in different plots (genus level)
图4. 不同样地土壤细菌群落物种丰度柱状图(属水平)

Table 6. Relative abundance of soil bacteria at the genus level
表6. 属水平上的土壤细菌相对丰度
注:Others为属水平上所有样品丰度低于0.5%的物种集合。
3.3.3. 种水平
图5为三个不同样地土壤细菌群落在种水平的物种丰度柱状图。其中,Others为所有样品丰度低于0.5%的物种集合。由此可知,从种水平的相对丰度来看,三个不同样地共有的优势菌种均为未指明菌种Candidatus_Nitrososphaera_SCA1170,但LCS2样地中该菌种的相对丰度最大,为3.70%,LCS1样地次之,为0.88%,LCS3样地最低,仅为0.66%。说明在种植山野葡萄的石山坡地中,Candidatus_Nitrososphaera_ SCA1170种群数量和相对丰度较大,推测其对该种作物的种植可能有积极影响。

Figure 5. Histogram of species abundance of soil bacterial communities in different plots (species level)
图5. 不同样地土壤细菌群落物种丰度柱状图(种水平)
3.4. 土壤细菌丰富度及多样性比较
Alpha多样性包括chao指数、ace指数,shannon指数,coverage指数等,是对单个样品中物种多样性的分析 [47]。三个不同样地Alpha多样性指数分析结果见表7。由此可知,三个不同样地的coverage指数均为0.978,说明被测样品序列覆盖率高,测序深度几乎覆盖了全部。三个不同样地的chao1指数和ace指数的高低排序均为:LCS2 > LCS3 > LCS1,这说明种植山野葡萄的LCS2样地土壤细菌群落丰富度最高,未被严重破坏的次生植被样地LCS3次之,受到严重破坏的裸地样地LCS1的土壤细菌物种丰富度最低,这很可能是由于人为破坏石山坡地地表植被所造成的。三个不同样地的shannon指数高低排序为:LCS2 > LCS1 > LCS3,与上述两个指数的排序稍有区别。
3.5. 相关性分析
为了说明环境因子对土壤微生物多样性的影响,可利用数理统计软件SPSS22.0对不同样地的土壤理化特性与土壤细菌丰度前10的种类(门水平)进行相关性分析,具体结果见表8和表9。
由表8可知,酸杆菌门、浮霉菌门、芽单胞菌门均与土壤含水量、有机质、碱解氮和全钾含量呈显著负相关;而变形菌门则与土壤含水量、有机质、碱解氮和全钾含量呈显著正相关;放线菌门、疣微菌门、硝化螺旋菌门与土壤pH呈显著正相关,说明这些菌群的丰度受到pH的显著影响;土壤全氮、全磷、速效磷及速效钾含量与土壤细菌丰度(多样性)有一定的相关性,但不显著。
由表9可知,土壤蔗糖酶活性与酸杆菌门、浮霉菌门和芽单胞菌门呈显著负相关,与变形菌门呈显著正相关;脲酶和碱性磷酸酶与不同土壤细菌种类的相关性表现一致,其中,放线菌门、疣微菌门以及硝化螺旋菌门均与脲酶和碱性磷酸酶活性呈显著正相关,说明脲酶和碱性磷酸酶活性受到这些菌群较强的直接或间接作用,这与李冰等学者对土壤磷酸酶的研究结果一致 [48]。而绿弯菌门、拟杆菌门、泉古菌门则与脲酶和碱性磷酸酶活性呈显著负相关。

Table 8. Correlation coefficients between soil physical and chemical indexes and soil bacterial species (phylum level)
表8. 土壤理化指标与土壤细菌种类的相关系数(门水平)
注:1) 表中MC、OM、TN、AN、TP、AP、TK、AK分别指土壤水分、有机质、全氮、碱解氮、全磷、速效磷、全钾、速效钾含量;2) 用英文简写表示土壤细菌门类,具体细菌门类见表5,如Aci表示酸杆菌门;3) **表示相关性在0.01水平(双尾)显著,下表同。

Table 9. Correlation coefficients between soil enzyme activity and soil bacterial species (phylum level)
表9. 土壤酶活性与土壤细菌种类的相关系数(门水平)
注:表中SUC、URE、APA分别指土壤蔗糖酶、脲酶、磷酸酶。
4. 讨论
土壤理化性质的差异与土地利用方式密切相关,孙彩丽 [49] 等研究表明,喀斯特坡耕地转为撂荒地后,土壤全氮含量明显增加。在本研究中,裸地样地的土壤全氮含量高,与之结果不完全一致,可能是因为该裸地原为耕地,刚弃耕时间不长,且位于三个调查样地的最下方,坡度相对平缓,水土流失程度相对较轻,土壤养分损失较少,多年的耕种和人为施肥对其土壤全氮含量有较大的影响。在三个不同样地中,种植山野葡萄的样地为酸性土壤,为追求高产,农民在作物栽培过程中大多施用化肥,这可能是土壤酸化的重要原因 [50]。随着栽种时间的延长,土壤酸化愈加严重,从而导致土壤养分失衡。栽培山野葡萄的样地LCS2土壤速效磷和速效钾含量远高于其余两个样地,可能是农民在作物耕种时施加复合肥(磷肥和钾肥)所致。
土壤蔗糖酶活性与有机质含量成正相关 [51],有机质含量的下降使蔗糖酶的催化底物减少,从而导致其活性下降。由表1可知,在本研究的三个样地中,样地LCS3植被完好,土壤表层的生物量增加,凋落物较多,其腐烂分解之后对土壤的输入量也较大,能为土壤生态系统提供更充足的碳源,因此在一定程度上增加了土壤蔗糖酶活性。在石山坡地开荒种植,因为水土流失等原因,会使土壤有机质含量下降,尤其在桂西北岩溶坡地,土壤瘠薄,表土覆盖有限,连年高强度开荒种植大量消耗土壤养分,极度加速了土壤有机质的消耗,直接和间接地降低了土壤酶的活性。酶是一种特殊蛋白质,土壤酶的生理活性受多种土壤环境因子的影响。王涵 [52] 等研究指出,土壤pH对土壤脲酶的活性具有显著的影响,本研究所得结果与之相似。
通过OTU聚类统计、chao1指数和ace指数分析,发现裸地样地的土壤细菌群落的丰富度最低,其原因可能是由于该样地的土壤水分、有机质等养分含量下降,使土壤微生物生长繁殖所需的营养物质减少,从而影响其丰度,该研究结果与杨泽良等人的研究结果相似 [15]。在本研究的三个不同调查样地中,土壤微生物的优势菌门相同(均为酸杆菌门、变形菌门、放线菌门、疣微菌门、绿弯菌门、浮霉菌门、拟杆菌门、泉古菌门、芽单胞菌门、硝化螺旋菌门),但占比各不相同,该结果与叶雯等人的相关研究结果相似 [53] [54]。酸杆菌门细菌属于嗜酸菌,相关实验研究结果表明,土壤pH、含水量与酸杆菌门细菌丰度呈显著负相关。在本研究中,酸杆菌门与土壤含水量呈显著负相关,与土壤pH呈负相关,但不显著;变形菌门与土壤有机质、碱解氮及蔗糖酶活性呈显著正相关。据文献报道,土壤酸化可以导致土壤微生物(放线菌等)丰度和多样性的下降 [55]。由此可知,土壤养分及土壤酶的生理生化活性,对土壤微生物丰度具有重要的影响 [56]。在不同样地土壤细菌门水平相对丰度比较中发现,种植山野葡萄的样地LCS2,其放线菌门细菌的丰度较低,该研究结果与前人研究结果一致。
由于本研究的样地数量比较少,且采样只集中在一个月份,所得的实验结果还不能揭示不同样地土壤微生物多样性季节变化的规律,也不能全面了解桂西北岩溶地区石山坡地土壤微生物对外界干扰的响应特点。因此,今后有必要适当扩大调查范围,增加样地个数,选择不同种植年限的山野葡萄样地和不同恢复年限的裸地,以保存完好的自然植被样地作为对照,将传统研究方法与现代科学技术手段结合,用空间代替时间的方法进行对比试验,根据春夏秋冬不同季节进行定点采样,进一步丰富调查研究的实验数据,以便深入了解岩溶地区石山坡地土壤微生物多样性的影响因子及变化规律,更好地为区域经济社会发展服务。
5. 结论
根据以上实验结果及分析讨论,可以初步得到以下结论:
1) 不同土地利用方式对石山坡地土壤微生物多样性具有重要的影响,适度的干扰,可以提高土壤微生物的物种多样性。
2) 土壤理化性质对土壤微生物丰度具有重要的影响,不同理化因子对土壤微生物多样性的影响不同,两者的相关性存在较大的差异。其中,放线菌门、疣微菌门、硝化螺旋菌门与土壤pH呈显著正相关;变形菌门与土壤含水量、有机质、碱解氮、全钾含量、蔗糖酶活性呈显著正相关;放线菌门、疣微菌门、硝化螺旋菌门与脲酶和碱性磷酸酶活性呈显著正相关;酸杆菌门与土壤含水量呈显著负相关,与土壤pH呈负相关,但不显著。
3) 在门水平上,LCS1和LCS2样地的优势菌门均为酸杆菌门,LCS3样地的优势菌门为变形菌门;在属水平上,三种不同样地的优势菌属均为DA101;在种水平上,三种不同样地的优势菌种均为未指明的菌属Candidatus_Nitrososphaera_SCA1170。可见,不同土地利用方式,可以使土壤微生物多样性的组成和结构发生较大差异;人为干扰比较严重的样地LCS1和LCS2,其土壤微生物优势菌门为酸杆菌门,破坏程度较轻的自然植被样地LCS3,其土壤微生物优势菌门为变形菌门;本研究的三种不同土地利用方式调查样地,其土壤微生物多样性仅在门水平有较大的差异,而在属、种水平则优势菌一致,但丰度不同。
4) 岩溶地区生态环境脆弱,过度的人为干扰破坏,不利于土壤生态系统的恢复和土地资源的可持续利用。
基金项目
广西自然科学基金项目(桂科自0832273),桂西北地方资源保护与利用工程中心资助项目(桂教科研[2012] 9号),桂西北岩溶地区石漠化综合防治实验室资助项目(校政发[2016] 91号),河池学院高层次人才科研启动费项目(XJ2018GKQ016)。
NOTES
*通讯作者。