1. 引言
油茶Camellia oleifera属山茶科、山茶属、油茶组,灌木或乔木 [1],广泛分布于我国长江流域以南的l8个省(自治区) [2],是振兴区域经济,脱贫致富的优势产业。其种子富含不饱和脂肪酸和维生素E [3],是我国南方主要食用油料树种,也是世界四大木本食用油料树种之一 [4]。截至2017年,油茶的栽植面积已经达到4 × 106 hm2,但是由于油茶存在“花而不实”、“千花一果”的现象,坐果率较低,仍不能满足市场的需求 [5] [6]。为了解决油茶的坐果率较低的问题,许多研究对油茶真花粉的储存和生活力等方面进行了探究 [7]。
在探究油茶真花粉特性时,有研究人员发现了一种不同于正常花粉的畸形花粉,并认为其是“假花粉” [8]。假花粉已在兰科 [9] 和山茶科 [10] 的多种植物中被发现。在兰科植物中,假花粉常为多细胞组成的白色念珠状组织,常含蛋白质、淀粉等营养物质,且已被证实可在兰科植物授粉策略中作为食物报酬吸引昆虫 [11]。山茶科植物的假花粉与兰科植物完全不同,多为圆形单细胞,Tsou等人认为这种假花粉可能是山茶属植物所特有的 [10]。山茶科各物种假花粉外壁纹饰并不完全相同,现已发现其具有三种不同的外壁纹饰,且不同的外壁纹饰代表着不同的进化程度,有研究认为山茶科植物的假花粉具有帮助植物吸引昆虫的作用 [12]。并且前人的研究均认为山茶科植物的真假花粉在花药开裂后会进行混合 [13]。
虽然假花粉在植物学研究中已经受了广泛的重视,但是大多数研究主要针对兰科植物,油茶乃至整个山茶科植物假花粉的研究现仅停留在发现阶段,尚未见有关油茶真假花粉形态和发育过程的差异的研究。本研究通过花粉悬液,石蜡切片,光学观察等方式对油茶真假花粉的形态差异和发育过程进行比较分析,并初步探索了假花粉的生物学功能,旨在明确真假花粉形态和发育过程的差异,为后期确定两者在油茶传粉系统中的功能差异奠定基础。
2. 材料与方法
2.1. 采样地点
花药和花芽均采自中南林业科技大学油茶苗圃(28˚8'14N, 112˚59'08E)中种植的种间杂交种油茶YH-3,YH-3是由攸县油茶(C. yuhsienensis “Hu”) (P1) × “华硕”油茶(C. oleifera “Huashuo”) (P2)种间杂交得到的F1代优良单株。2020年9月2日至2021年12月4日间,每周五采集一次花芽。从2020年11月油茶进入盛花期开始收集花药。将采集的花药铺开在纸上,于28℃,相对湿度40%,4000 lx的条件下放置一个晚上后将散落的花粉收集于干燥的1.5 mL离心管中,并于4℃冰箱中进行临时储存 [14]。
2.2. 花粉悬液
用1 g琼脂,50 g蔗糖,0.1 g硼酸,加水定容至200 ml后再加热定容至2000 ml作为悬液。取三个称量瓶,并于每瓶中加入20 mL悬液和适量花粉,摇匀。随后用移液枪于称量瓶中吸取1~2 µl花粉悬液,滴于干净的载玻片上制成临时玻片,在Leica S/M432299倒置显微镜下观察并拍摄照片。每瓶制作三个临时玻片作为重复,每个玻片选取三个视野进行拍照用以对照 [15]。
2.3. 真假花粉测量
对花粉悬液中的花粉粒进行拍照,并利用图像处理软件image J测量真花粉和假花粉侧面观的极轴长度、赤道轴长度、表面积。
2.4. 石蜡切片
采集的花芽置于卡诺试剂(CF;乙酸:乙醇,3:1,v/v)中固定,密封抽气一夜,再用75%酒精洗涤三次,随后利用梯度浓度法彻底脱水,再对材料进行透明处理(首先置于二甲苯:无水乙醇 = 1:1中半小时,取出,转入纯二甲苯中静置,每次静置半小时,重复该步骤两次)。后将材料浸蜡,浸蜡结束后立即包埋材料,修块。再将材料固定在Leica RM-2235手动旋转切片机上切成10 µm的薄片,蜡带置于28℃左右的展片台上展片,烘片。烘片完成后利用二甲苯和乙醇进行逐步脱蜡 [9]。脱蜡完成后不进行染色,而是立即用中性树胶封片保存。最后利用Leica S/M432299倒置显微镜在蓝光和绿光波段的光下进行切片观察并进行拍照。
2.5. 花药观察
在盛花期随机采集新鲜的正常花药,败育花药及瓣化花药,并立即利用Leica S/M432299倒置显微镜进行光学观察并拍照,以记录三种花药上油茶真花粉与假花粉的位置分布,以及正常花药的开裂全过程。
2.6. 数据分析
采用t检验来分析对比了真花粉和假花粉的主要形态特征差异。所有的数据分析采用SPSS 26 version完成。
3. 结果与分析
3.1. 真假花粉形态差异
油茶真花粉粒与假花粉粒均为粉末状颗粒,真花粉多为黄色三角形,而假花粉呈现半透明不规则形状。在悬液中,真花粉在常温下培养7日后会萌发出花粉管,而假花粉则不会(图1(A))。在40倍镜下,可观察到假花粉表面具有明显的肋骨状纹路,而真花粉没有(图1(B))。
除颜色、形状及纹饰等方面的区别外,真假花粉在大小上也具有显著差异。假花粉的极轴长和赤道轴长均显著大于真花粉(P < 0.05)。虽然假花粉侧面观的平均面积大于真花粉,但两者并不存在显著差异 (P > 0.05)。此外,假花粉极轴长、赤道轴长及侧面观的平均面积的变异系数(CV)均大于真花粉(表1)。

Figure 1. Aqueous suspensions of pseudopollen. (A): The pollen develops pollen tube (*) while the pseudopollen does not germinate; (B): The difference in appearance between normal pollen and pseudopollen. Black arrows refer to normal pollen; Red arrows refer to pseudopollen. Bar = 200 µm
图1. 花粉悬液。(A):花粉萌发出花粉管(*)而假花粉不萌发;(B):真假花粉外观差异。黑色箭头指代真花粉;红色箭头指代假花粉。Bar = 200 µm

Table 1. Comparison of morphological characteristics of pollen and pseudopollen
表1. 真假花粉特征形态比较
*真花粉假花粉形态指标的t检验,P < 0.05。
3.2. 花药自发荧光指示小孢子及假花粉发育
在蓝光和绿光波段下,不同发育时期的油茶花药都可以发出明显的荧光(图2)。但仅在蓝光波段下,三个时期的油茶花药荧光情况才表现出明显的差异(图2(A)~(C))。在绿光波段下,无论哪个时期,油茶花药都是呈现出强烈的红色荧光(图2(a)~(c))。
在蓝光波段下,油茶花药在造孢细胞阶段表现出明显的黄色荧光(图2(A)),随着花粉逐步发育成熟,花药的荧光也在小孢子母细胞阶段变为黄绿色,此时细胞核的荧光明显(图2(B))。后期,由于花药壁细胞变为空泡细胞,花药壁的荧光也随之消失仅细胞壁存在微弱荧光,但成熟的花粉粒具有明亮的绿色荧光(图2(C))。
假花粉在不同的发育阶段,蓝光波段下花药的荧光也存在差异。在假花粉发育初期即小孢子母细胞时期,形成假花粉的药隔薄壁细胞紧密相连,并在蓝光波段下呈现出黄绿色荧光(图2(B))。随着花粉逐渐发育成熟,药隔薄壁细胞逐渐膨大并空泡化,相邻药室连接处的细胞发育成为成熟的假花粉并彼此分离出现间隙。此时蓝光下的药隔薄壁细胞内部的荧光消失,仅细胞壁部分出现微弱绿色荧光(图2(C))。
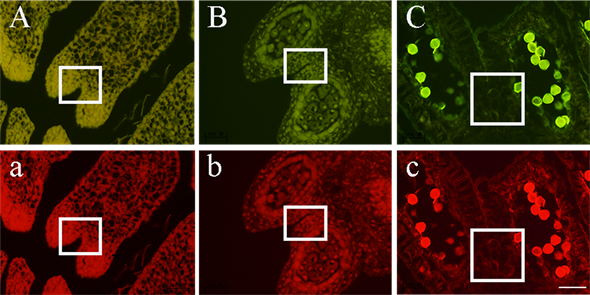
Figure 2. Autofluorescence of anthers in different developmental stages under f inverted microscope. (A)~(C) Blue light; (D)~(F) green light. The white box indicates pseudopollen. Bar = 100 µm
图2. 花药不同发育时期在倒置显微镜下的自发荧光。(A)~(C) 蓝光;(a)~(c) 绿光。白框所指为假花粉。Bar = 100 µm
3.3. 假花粉参与花药的开裂
真假花粉形成后,花药开裂机制在适宜条件下被触发,此时真花粉仍未被释放,仅在花药开裂处可见少量的假花粉(图3(A))。在油茶的花药开裂过程中,花药壁逐渐打开,花粉囊内的真花粉逐渐被释放,此时在药隔和花药壁处可见明显的假花粉粒(图3(B),图3(C))。花药完全打开后,可明显观察到真假花粉在花药上各自占据不同的位置,大部分假花粉集中在裂口位置,而其余假花粉围绕真花粉形成一个包围圈,真花粉零散的分布在圈内(图3(D))。
除此之外,在败育和瓣化的花药中均可见明显的假花粉颗粒存在(图4)。在败育的花药中,真花粉颗粒不存在或萎缩,但仍可见发育成熟的假花分颗粒(图4(A)~(C));在瓣化的花药中,花药扭曲且前端呈白色,但花药仍然正常开裂,并可观察到真花粉和假花粉粒的存在(图4(D))。与正常花药的假花粉分布部位一致,败育和瓣化的花药的假花粉均主要集中于花药开裂的裂口部位,其余分布在花药外围(图4)。

Figure 3. Cracking process of Camellia oleifera anther. Bar = 100 µm
图3. 油茶花药的开裂过程。Bar = 100 µm

Figure 4. Dehiscence of abnormal anthers. (A)~(C): Anthers that do not normally produce fertile pollen; (D): Petaled anther. Red arrows refer to pseudopollen. Bar = 100 µm
图4. 不正常花药的开裂情况。(A)~(C):不能正常产生可育花粉的花药;(D):瓣化花药。红色箭头指代假花粉。Bar = 100 µm
4. 结论与讨论
油茶真假花粉在形态上存在较大差异。油茶真花粉为黄色粉末状三角形颗粒,具有萌发孔可以产生花粉管,而假花粉为白色半透明的外壁具有肋骨状纹路的粉末状颗粒,不具有产生花粉管的能力,且假花粉侧面观的极轴长,和赤道轴长显著大于真花粉。假花粉的侧面观的极轴长、赤道轴长及横截面积变异系数较大,这说明真花粉的形状大多是一致的,而假花粉容易出现畸形。真花粉起源于小孢子母细胞,而假花粉是由药隔薄壁细胞发育而来,两者起源不同,发育过程也存在明显差异。真花粉与大部分物种的小孢子发育过程相同,而油茶假花粉的发育过程与兰科植物的假花粉的发育过程截然不同 [15] [16]。兰科植物假花粉由唇瓣上的毛状体细胞发育而来,而油茶假花粉由药隔薄壁细胞发育而来,在发育初始,薄壁细胞紧密相连,随着相邻药室壁连接处细胞逐步空泡化,并形成细胞间隙彼此分离,薄壁细胞最终发育成为成熟的假花粉。
此外,我们还发现花药的自发荧光可能可以指示真假花粉的发育阶段 [17]。油茶花芽多个时期的石蜡切片的观察结果表明,在蓝光和绿光下不同时期油茶花药均表现出明显的荧光,但在蓝光下,不同发育时期的荧光具有明显差异。在造孢细胞阶段,假花粉还没有发育,药隔薄壁细胞紧密相连,整个花药的荧光呈现明亮的黄色。此时花药壁刚形成,随着花药壁的发育,表皮、药室内壁、中层和绒毡层分层 [18],花药壁的结构和细胞内含物的组分不断发生变化,当花粉发育到小孢子母细胞时期,假花粉开始发育,油茶花粉囊的荧光由黄色转变为黄绿色。随后真花粉和假花粉逐步发育成熟,花药壁细胞中央逐渐空泡化,薄壁细胞荧光逐渐消失,仅真花粉和薄壁细胞的细胞壁存在绿色荧光。
假花粉可能参与了花药的开裂机制。油茶花芽多个时期的石蜡切片观察结果表明,油茶花药在开裂过程中并不形成断口,而是以产生假花粉的形式使两个花粉囊的壁在连接处断裂 [19]。在花药的开裂过程中,假花粉在药隔中首先被释放,并在外界光照等因子的刺激下,花药逐渐打开释放出真花粉和假花粉,但是真假花粉并非如此前的研究所认为的那样,会在花粉囊中进行混合 [10],它们在花药上各自拥有独立的分布位置。此外,在瓣化和败育的花药中同样观察到了假花粉的存在,这说明假花粉并非与真花粉相伴而生,假花粉发育的过程是一个独立的过程,它不会因正常花粉发育过程出现异常而发生异常或不产生假花粉。通过观察切片和花药,发现假花粉的形成位置、集中分布的位置与花药的开裂位置一致,当假花粉成熟后,假花粉粒彼此分离,形成间隙,此时两个相邻药室的药室壁发生断裂,花药逐渐打开,真花粉逐渐被释放。在整个过程中,相邻药室的连接处未形成裂口组织,这表明油茶花药的开裂方式可能与其他植物不同,它是通过形成假花粉使花药壁断裂 [20]。
基金项目
全国大学生创新创业训练计划项目(S202010538002)。
NOTES
*第一作者。
#通讯作者。