1. 引言
妊娠期高血压疾病是妊娠且伴随血压升高的一种疾病,一般会伴随全身水肿、蛋白尿、肝脏和肾脏功能损害、头痛、视物模糊等临床表现的妊娠期各个系统损伤性疾病 [1]。在妊娠期相关的各类高血压疾病中,子痫前期(preeclampsia, PE)的发病率排名第一,不论是母体方面还是胎儿方面,都造成了一定的生命安全方面的威胁 [2]。同时也不利于胎儿生长发育。从全球角度来看,子痫前期的发病率约为3%~5%,而在国内人群中,其发病率约为9%~10%,随着我国计划生育政策的不断放开,子痫前期发病率明显升高,占所有育龄妇女的3.2%~12% [3]。
目前关于子痫前期的发病机制仍不明确,病理生理机制复杂同时也并伴随各个系统功能改变,临床上也没有有效的药物治疗子痫前期。根据近些年的研究,目前认为机制主要有以下几种:1) 遗传与环境交互作用;2) 母体–胎儿之间免疫平衡失调;3) 螺旋动脉重铸;4) 滋养细胞分化障碍;5) 胎盘内血管的血流灌注欠佳而产生的血流减少及氧气不足;6) 内皮细胞功能障碍;7) 全身炎症反应。早些年,子痫前期的机制一直被认为是二阶段学说。第一阶段是在妊娠8周至18周之间,因胎盘发育还未成熟,胎盘绒毛间隙灌注功能失调导致子痫前期的发生,一般不产生临床症状。下一阶段是在妊娠18周之后,因胎盘的母胎界面发生氧化应激,将一些血管内皮生长因子等释放到母体循环中,出现临床症状如高血压、蛋白尿等。随着深入探究子痫前期的发病机制,又进一步细化继续提出了六阶段学说。第一阶段是由于同房和受精之间的时间较短,从而导致母体对胚胎中来自男性配偶一方的基因缺乏耐受性。第二阶段过程中,滋养细胞侵袭子宫螺旋小动脉,多发生在妊娠的第8周至18周之间,当胎盘有缺陷时,产生应激反应,这一过程为子痫前期的第三阶段。第四阶段与母亲血液中胎盘衍生因子过多或不足有关。通常没有临床症状,如果出现高血压、蛋白尿、水肿等症状出现,这就说明第五阶段已经开始。低于1/2的子痫前期患者会转到第六阶段,这个阶段胎盘灌注进一步减少,螺旋动脉弹性消失,螺旋动脉血栓形成和胎盘梗死 [4]。综合以上研究来看,滋养细胞浸润过浅或浸润障碍导致螺旋小动脉重铸障碍和内皮细胞功能障碍是子痫前期发病机制中的两个关键特征,且目前子痫前期的临床诊断主要靠临床表现。通过现有的手段很难有效地诊断和预测指标。所以对症治疗和终止妊娠是该病最常见的临床处理措施。本文通过探究PlGF、sFlt-1、CD146等相关特异性指标,从该病的滋养细胞浸润障碍及内皮细胞障碍分析与子痫前期的相关性,为临床上识别、干预、治疗提供帮助。
PlGF是一种二元多聚异受体糖原球蛋白,起初是由Maglione [5] 等人最先获得,他们所用的方法是通过在人胎盘cDNA文库中提纯而得到,主要在滋养细胞表达 [6]。它与血管内皮生长因子具有高度的序列相似性,一般是通过自分泌或旁分泌在人胎盘的血管生成和滋养细胞增值分化中发挥作用。有研究显示去除妊娠小鼠的PlGF基因,胎盘血管的分支就会因此减少,再次给妊娠小鼠注射PlGF,随着PlGF的增多,也发现妊娠小鼠的滋养细胞侵袭能力增强 [7]。此外,多项结果研究表明,在正常妊娠中,胎盘滋养细胞分泌PlGF,促进血管生成,但因为在妊娠早期这一阶段,母体内的胎盘发育相对不足,其内部的血流结构不健全,使得胎盘的所需供给不足,所以在妊娠5~15周,PlGF水平较低;胎盘成长发育到后期,血流逐渐被完全确立,血液供应和氧气供应充分,由此导致胎盘中的相关血管结果发生变化,使其PlGF的产生和分泌增加,在15周之后迅速增加,于28~30周尤为明显,并达到最高值 [8]。在滋养细胞所处的环境中,氧气浓度不足或血液供应不足时,均会导致PlGF含量减少,进而出现胎盘的生长及自身功能发生改变,这就会使宫内的胎儿得不到生长发育所需要的物质和能量,可以引起一系列的妊娠相关疾病,这就可以得出一个推论,PlGF可以反应胎盘滋养层细胞的功能 [8] [9]。
sFlt-1是合胞滋养细胞分泌的生物活性因子之一,也是在滋养细胞中表达的,可以在合体滋养细胞中检测到较高浓度的sFlt-1,在早期子痫前期的发病机制中发挥重要作用 [10]。sFlt-1属于PlGF的特异性配体,通过分子间结合进行信号传导,介导PlGF的功能,可以抑制PlGF生物活性,使血管生成受阻,导致滋养细胞破损 [11]。已有研究表明,sFlt-1在子痫前期的发病过程中起重要作用,通过表达抑制血管活性的物质,从而使内皮细胞和滋养细胞的正常功能受到影响,影响滋养细胞增殖,阻碍了正常胎盘中母胎面的血管的产生及生长,由此出现胎盘的血流灌注不足及相应的氧气及营养物质缺乏。而sFlt-1又会因为前者氧含量不足而升高,出现恶性循环,引发子痫前期 [12]。研究显示 [13],PLGF会作用于内皮细胞使其增殖,加快胎盘血管生成,并促进滋养细胞有丝分裂,抑制滋养细胞凋亡。PLGF水平降低容易引起胎盘血管生成障碍,影响滋养细胞有丝分裂过程,从而造成胎盘功能不良,增加子痫前期发生风险。
免疫球蛋白超家族中有一个黏附分子是CD146 (cluster of differentiation 146,简称CD146),具有I型跨膜结构 [14]。它也被称为s-endo1,P1H12,Mel-CAM和MUC18,是内皮细胞的一种被广泛描述的粘附标记物。由于CD146被认为具有特异性,它的表达被作为鉴定循环内皮细胞(CECs)的唯一标准 [15]。目前有许多相关研究文献已经报道,CD146主要表达分布于血管内皮细胞、植入位点中间滋养层细胞 [16]。CD146也是血管内皮细胞的关键标志分子 [15]。有研究发现CD146分子在胚胎正常发育过程中在侵袭性滋养细胞中表达,但在妊娠高血压中,滋养细胞的侵袭性显著降低,CD146分子呈弱表达或不表达 [17]。上述研究表明,胎盘上CD146的表达和中间滋养层细胞浸润范围和浸润深度密切相关。
鉴于子痫前期发病率高,且发病机制也未完全明确,也没有好的治疗方式,临床上患病数量高,因此本课题以研究sFlt-1/PLGF、胎盘CD146两者在子痫前期患者中表现出的相关性为目的,从而为以后临床上子痫前期的诊断、治疗及其预防提供指导意义。也为科研人员更好地探究子痫前期的发病机制提供选择。
2. 研究材料与方法
2.1. 研究对象
选取就诊青岛市市立医院东院区产科孕妇,就诊日期为2020年1月~2021年10月,按照以下纳入和排除标准进行分组,研究组55例,对照组60例。所有孕妇研究调查对象资料来源都经过相关知情人的同意。
2.1.1. 对照组纳入标准
1) 我国正常妊娠组年龄25~40岁的初产妇或经产妇;
2) 单胎活产;
3) 怀孕期间无血压异常,定期定时产检,尿蛋白检测均为阴性;
4) 无子痫前期家族病史;
5) 体质量指数(body mass index, BMI)在18.5~24之间。
2.1.2. 对照组排除标准
1) 多胎妊娠;
2) 前3个月有服用药物者;
3) 怀孕中出现妊娠期相关疾病;
4) 有慢性高血压病史、甲状腺功能亢进或甲状腺功能减退、心脏病、糖尿病、肝肾疾病病史、结缔组织病等疾病;
5) 各种原因导致的必要终止妊娠的;
6) 无法继续追踪的。
2.1.3. 实验组纳入标准
1) 中国正常妊娠组年龄25~40岁孕妇;
2) 单胎活产;
3) 符合子痫前期的诊断标准,该诊断标准参考人卫出版社出版的全国高等学校教材第九版《妇产科学》;
4) 无子痫前期家族病史;
5) 体质量指数(body mass index, BMI)在18.5~24之间。
2.1.4. 实验组排除标准
1) 多胎妊娠;
2) 前3个月有服用药物者;
3) 怀孕中出现妊娠期相关疾病;
4) 有慢性高血压病史、甲状腺功能亢进或甲状腺功能减退、心脏病、糖尿病、肝肾疾病病史、结缔组织病等疾病;
5) 各种原因导致的必要终止妊娠的;
6) 无法继续追踪的。
2.2. 子痫前期诊断标准
本实验中所用诊断标准均以人民卫生出版社第九版《妇产科学》教科书中的诊断标准作为依据。
子痫前期诊断标准:妊娠20周后出现收缩压 ≥ 140 mmHg和(或)舒张压 ≥ 90 mmHg,伴有尿蛋白 ≥ 0.3 g/24 h,或随机尿蛋白(+)或虽然无蛋白尿,但合并下列任何一项者:
· 血小板减少(血小板 < 100 × 109/L);
· 肝功能损害(血清转氨酶水平为正常值2倍以上);
· 肾功能损害(血肌酐水平大于1.1 mg/dl或为正常值2倍以上);
· 肺水肿;
· 新发生的中枢神经系统异常或视觉障碍。
3. 实验方法及步骤
3.1. 临床资料收集
1) 主要信息:孕妇的ID、就诊卡号、联系电话、年龄、姓名、住院号、标本编号。
2) 妊娠相关信息:末次月经、孕次、产次、胎次、流产次数、身高、体重、采血日孕周、怀孕期间血压波动范围、尿常规结果、24小时蛋白尿定量分析、诊断为子痫前期的孕周、不良孕产史、心脏病、糖尿病、自身免疫疾病、肝脏肾脏疾病、家族遗传疾病、传染病、妊娠相关并发症合并症、既往是否发生过子痫前期等病史。
3.2. 血清标本采集与处理
1) 从空腹研究对象取5 ml肘部静脉血,置于红色干管中,可在4℃冰箱中保存不超过24小时。如果24小时未能检测,需将样本在−20℃冷冻保存(不超过6个月)。
2) 离心机3000 r/min离心10~15分钟。
3) 取上层血清300 ul分装于EP管中,在管上标上姓名和实验编码。
4) 血清标本置于−80℃保存备用。
5) 血清样本在检测前放置4℃~8℃溶解。
6) 打开荧光免疫分析仪。
7) 检查校准卡与试剂盒的批号是否一致,然后把校准卡插入仪器中并将校准卡中的曲线导入仪器。
8) 取出检测卡放置室温后,吸取80 ul血清样本分别滴加到PlGF检测卡及sFlt-1检测卡的加样孔中。
9) 室温反应15分钟。
10) 分别将检测卡插入荧光脉冲分析仪的承载器,按下测试按钮,仪器就会自动扫描检测卡。
11) 荧光免疫分析仪自动检测结果并计算样本中sFlt-1和PlGF的含量,并给出sFlt-1/PlGF的值。
12) 将用完的检测卡移除,将其妥善放置在生物危害品放置处。
3.3. 胎盘的采集与处理
1) 胎盘取材与固定:应在胎儿分娩后,首先取母体面,大小为1 × 1 × 1 cm的组织,立即将其置入10%的福尔马林中进行固定(最好不需要超过24小时)。
2) 脱水透明:80%乙醇、90%乙醇、95%乙醇、100%乙醇,依次每个2小时。
3) 浸蜡:使组织完全包裹于石蜡中。
4) 包埋:将固定、脱水、透明、浸腊过的组织放在熔化的石蜡包埋框中。使胎盘组织和包埋剂冷却,待凝固后,根据要求贴上标签,于零下20℃冷却。
5) 切片:使用德国徕卡厚度在4 μm左右的显微切片对包埋的石蜡进行切片。将切片置于40℃保温箱的液面上,将其展平,然后用载玻片收集并编号。
6) 烤片:置于烤箱机内,温度60℃烘烤,待水烤干,蜡烤化后取出后于室温冷却。
7) 脱蜡:在65℃温度下,对切片进行20分钟的烘烤,将石蜡熔化到切片上。然后将二甲苯I溶液和二甲苯II溶液放入37℃恒定温度的箱内加热15分钟,将石蜡切片拿出并放在通风柜中,置于二甲苯溶液内,然后置于37℃的保温箱中,然后对每个二甲苯溶液进行10分钟的脱蜡。在脱蜡过程中,必须确保每个切片的物质全部没入二甲苯溶液。
8) 水化:在常温下,分别将切片置于无水乙醇、无水乙醇、95%乙醇、80%乙醇、70%乙醇、50%乙醇和蒸馏水中,每个5分钟。在水化过程中,需要把切片上的组织全部没入乙醇溶液。
9) 过氧化物酶处理:切片置于保湿盒,给所有切片都滴入1滴3%的过氧化氢酶。为了使切片中的过氧化物酶的活性失活,在常温将切片置于阴暗处10分钟。再用磷酸缓冲盐溶液多次冲洗,每次冲洗时间约为5分钟左右,共洗三次。
10) PH6.0柠檬酸抗原修复(高压及高温修复):将切片置于适量的抗原修复溶液内,组织没入液面,在5℃~100℃下水浴加热20分钟左右。再用20~30分钟将其温度降至常温,再用PBS清洗3次,每次持续约5分钟。
11) 滴加5%羊血清封闭:从组织切片上去除PBS缓冲剂,用纸巾轻轻擦拭剩余的PBS缓冲剂,依次将其放在保湿盒中,用5%山羊血清将其密封,依次将血清添加到组织切片,应使所有切片都没入在液体中。用37℃保温箱中保温1小时。
12) 滴加一抗:将组织切片上的残液甩掉,将剩余残液用纸巾缓慢擦除。将抗mcam兔多克隆抗体滴入标本,所有切片都没入在液体中,将等量的5%山羊血清注入阴性对照组,并于4℃冰箱内储存。在第二天,将其用PBS缓冲液冲洗2次,每次持续约5分钟。
13) 滴加二抗:将组织切片上的PBS缓冲液甩掉,小心擦拭剩余液体,将处理后的组织切片放入保湿盒内,并且依次给组织切片滴加酶标山羊抗兔IgG,静置于保温箱中,温度设置在37℃为宜,时间约为45分钟。取出片子后,对其用PBS缓冲液洗两次,每次持续约5分钟。
14) DAB显色:将组织切片上的PBS缓冲液甩掉,然后将上面的残液轻轻擦除,将现制的DAB显色试剂溶液滴到所有切片上,5分钟暗处存放。利用显微镜来对切片染色情况进行观察,细胞质和细胞膜为主要观察的染色部位,当两者染色为褐色或黄色时则为阳性表现,当染色较浅时,可将染色时长增加,最后用清水使染色停止。
15) 苏木素复染:将切片经上述步骤处理后,再放入苏木素液中进行染色1分钟,再清水反复冲洗。
16) 脱水及透明:在常温环境下,用蒸馏水、50%乙醇、70%乙醇、80%乙醇、95%乙醇、无水乙醇和无水乙醇脱水,置于二甲苯溶液–二甲苯溶液中脱水。将二甲苯溶液切片用中性树脂来封存,将组织完全覆盖。在盖上盖玻片时要防止气泡,然后将其自然干燥。
17) 观察:显微成像系统中观察、拍片。
18) 分析:图像分析。
3.4. 统计分析
利用计算机辅助统计分析软件SPSS26.0,通过该软件对所有实验数据进行定量统计分析,统计描述采用平均值和标准差(x ± s)进行分析。血清结果均符合正态分布。用man-Whitney-u试验用于对结果的对比,P < 0.05,由此可得出结论,差异有统计学意义,使用计算机统计分析软件SPSS26.0,进行对胎盘的数据统计分析,采用χ2检验,P < 0.05为差异有统计学意义。
3.5. 胎盘的判定结果
检测CD146是用免疫组化法来分析胎盘组织中的定位和表达水平,定位带有棕色或黄色细胞称为阳性细胞。病理学家双盲法阅片。将染色强度与阳性细胞分布区相组合,通过这一方法进行半定量分析。通过评估相应阳性细胞所占据的分布面积:阳性细胞数为0,细胞数 < 10%为1,细胞数为10%~60%为2,细胞数为60%为3。不同着色深度的阳性细胞分:未着色记0。浅黄色为弱阳性记1,棕色为强阳性记为3,黄色与棕色之间记为2。将两种方法统算的分数作乘,0~1:(−),2~3:(+),4~5:(++),5:(+++)。
4. 结果
1) 实验组与对照组之间年龄、身高、体重均没有统计学差异(P > 0.05),具体结果详见表1。
2) 在对照组血清中,其sFlt-1/PlGF的结果要比子痫前期组低,其中(P < 0.05),即差异有统计学意义,具体结果详见表2。
3) 子痫前期孕妇组胎盘CD146呈低或不表达,正常对照组胎盘CD146呈高表达,见表3。
4) 实验组与对照组胎盘CD146与血清中sFlt-1/PlGF不属于正态分布,根据其胎盘表达情况及血清比值做斯皮尔曼相关性分析,结果显示血清sFlt-1/PlGF与CD146负相关性。(P = 0.000, r = −0.934)

Table 1. The differences of age, height and weight between the experimental group and the control group were analyzed
表1. 实验组与对照组年龄、身高、体重差异性分析

Table 2. Difference analysis of sFlt-1/PlGF between experimental group and control group
表2. 实验组与对照组sFlt-1/PlGF差异性分析

Table 3. CD146 expression in experimental group and control group
表3. 实验组与对照组CD146表达情况
附图:
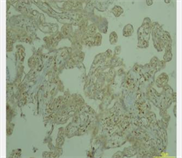

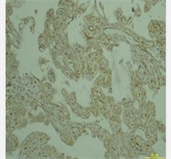
(对照组)
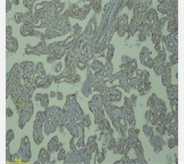
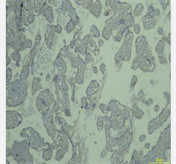
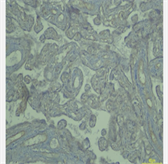
(实验组)
5. 讨论
5.1. PlGF与sFlt-1与子痫前期关系
尽管在过去的半个世纪中,子痫前期的发病率和死亡率显著下降,但在治疗子痫前期及其探究其发病机制及病理生理方面尚未取得革命性进展。各种药物(如阿司匹林和钙)的使用对早期预防很有希望,但并不能治疗其根本。虽然子痫前期的机制被认为是两个阶段的过程,但越来越多学者已将二阶段学说细化 [18]。现证据证实,由于滋养细胞侵入深度不足,致使螺旋动脉的重铸受到影响,而同样受到影响发生障碍的还有内皮细胞的功能,这是子痫前期发病机制中的两个最重要的特征。而VEGF在子宫血管中扮演重要角色的过程中。VEGF有促进血管内皮生长及促进血管生成的作用 [19] [20]。血管内皮细胞因子家族中有PlGF,在滋养细胞高表达,使细胞增殖和血管内皮细胞分化得到加强,使血管渗透性得到提高,并且防止细胞凋亡,对胎盘血管生成也有重要作用 [21]。Tidcell等研究第一次提出,发展成为PE的孕妇血清PlGF水平明显低于同孕周的正常孕产妇且临床症状越明显的PlGF含量越低 [22]。最近的证据指出,sFlt-1不仅是一种抗管生成因子,也是内皮功能障碍的因子,但它的起源及其在子痫前期具体作用仍不清楚 [23]。它也是由胎盘制造,通过VEGF和PlGF特异性受体起作用。子痫前期患者中胎盘血管生成障碍,缺氧又可以增加sFlt-1的表达,所以可在血清中检测出高浓度sFlt-1和低浓度PlGF和游离的VEGF。这类出现蛋白由血管生成的不正常情况,多出现在发生子痫前期、水肿、血压升高等临床症状的前几周 [24]。2003年第一次由Maynard [5] 等提出sFlt-1与子痫前期孕妇的关系,有证据表明,子痫前孕妇的sFlt-1-mRNA会增多,在子痫前期,孕妇的血清中sFlt-1浓度是健康孕妇的4~5倍。然后单独给怀孕小鼠注射sFlt-1,孕妇小鼠表现出与子痫前期相似的症状,如高血压、蛋白尿和全身水肿。同年Sugimoto [25] 等发现给大鼠注入sFlt-1后,sFlt-1可导致肾小球内皮细胞快速剥离,导致蛋白尿的产生 [26]。当PlGF与sFlt-1受体相遇并结合时,促进新生血管产生以及加快滋养细胞增殖和浸润等这些生物活性,都可以被sFlt-1受体阻断,且有强效的拮抗作用,引起胎盘中血管生成障碍。在子痫前期患者血浆中,因缺氧导致的sFlt-1增多,而PlGF生物活性被抑制,可以使滋养细胞的增殖能力减弱,也降低了滋养细胞的浸润能力,导致子痫前期疾病的发生。
所以有关学者认为可以利用sFlt-1/PlGF来辅助子痫前期诊断和临床上决策的制定。Kusanovic [27] 等做了一项1622例的队列研究,用酶联免疫吸附法测定孕妇PlGF和sFlt-1浓度,发现sFlt-1/PlGF值对早发性子痫前期有很好的预测效果。本实验也通过发现单独从血清中PlGF含量以及单独sFlt-1含量中,差异均不如sFlt-1/PlGF大。在实验组与对照组中,PlGF含量相差四倍多,而sFlt-1含量相差二倍多,sFlt-1/PlGF却相差十倍以上,这说明sFlt-1/PlGF与子痫前期的相关性更明显。从诊断的角度来看,可溶性血管生成标志物的发现,无论是单独使用还是与其他标志物联合使用,都为子痫前期的诊断和筛查提供了巨大的希望。
5.2. 胎盘CD146与子痫前期关系
CD146是一类单链跨膜糖蛋白,又叫MUC18 [28]。CD146分子在血管内皮细胞、平滑肌细胞植入位点中间滋养层细胞分布,有膜型和可溶性两种形式。参与细胞的粘附和转移、及其免疫应答,且与肿瘤的发生、转移密切相关 [29]。
CD146目前被广泛认为是一种新发现的内皮生物标志物,是血管壁中主要存在的基质分子,可以在血管壁中高表达,包括血管内皮细胞。也有研究表明,CD146与VEGFR-2在内皮细胞上直接相互作用,并在分子水平上确定了CD146与VEGFR-2结合的结构基础 [30]。它也是子宫内膜间充质标记物之一,可以作为VEGFR-2的共同激活因子,从而促进内皮细胞迁移和微血管形成 [31]。有研究表明,CD146也可以参与血管生成和肿瘤生长 [32]。而人的胎盘是一种类似恶性肿瘤样结构,具有高度侵袭性,通过滋养细胞亚群“绒毛膜外滋养细胞”(extra villous trophoblast, EVT)又称中间滋养层细胞,侵入子宫蜕膜及其血管系统,以建立充分的母体胎儿物质交换。其侵袭的分子机制与癌细胞相同 [33]。EVT能够通过侵入子宫蜕膜,进而使胎盘牢固附着于子宫上,同时EVT可以向血管内侵袭,尤其是螺旋动脉,逐渐替代其内皮层。在这一系列的过程中,这些螺旋动脉的血管成分发生改变,血管内的平滑肌被降解,同时弹性纤维被破坏,但螺旋动脉的结构仍没有改变,从而导致了螺旋动脉的直径扩大,进而使其血管内血流阻力降低,血管内血容量升高 [34]。而滋养层细胞侵入过浅或失败,在妊娠中都会产生与之有关的疾病,如先兆流产、子痫前期等 [16]。Liu等 [35] 人研究表示,在正常胎盘中,CD146染色在最具侵袭性和迁移性的中间滋养细胞中特异性检测到。然而,在子痫前期胎盘中,CD146不再存在于中间滋养细胞中。说明CD146在滋养层细胞侵袭中起重要作用,而子痫前期又与滋养细胞侵入过浅或浸润不足有关,我们就此推断CD146与子痫前期具有相关性。
5.3. sFlt-1、PlGF、sFlt-1/PlGF、胎盘CD146与子痫前期的关系
本研究通过对比对照组及实验组血清sFlt-1、PlGF、sFlt-1/PlGF的值及产后胎盘CD146的结果115例,选取纳入55例子痫前期患者标本作为实验组,60例正常妊娠孕妇标本作为对照组,可以得出在实验组血清中sFlt-1表达水平明显高于正常妊娠组,而实验组的血清中PlGF表达水平明显低于对照组,(P < 0.05)。证明了sFlt-1/PlGF与子痫前期的发病有相关性。实验中也表明,在正常胎盘中,在所有妊娠期锚定绒毛和蜕膜的中间滋养细胞上均特异性检测到粘附分子CD146。然而,在子痫前期,中间滋养层细胞CD146染色显著减少或无法检测到 [36]。这进一步说明子痫前期导致滋养细胞侵袭能力下降,CD146与子痫前期具有相关性。在子痫前期中,细胞滋养细胞向中间滋养细胞的分化不完全,中间滋养细胞侵袭较浅或失败。血管内侵入不会超出子宫螺旋小动脉的浅表部分,异常的侵袭常伴有细胞表面细胞粘附分子表达的明显改变。因此,这些螺旋小动脉保留了其内皮内壁,保持了相对狭窄、高阻力的血管,导致相对于正常妊娠,母体流向胎儿–胎盘单位的血液明显减少。这种胎盘灌注不良被认为是发生子痫前期的重要危险因素,再次说明CD146与子痫前期的相关性。由此我们也可以得知,滋养细胞在缺血缺氧时分泌PlGF减少,sFlt-1是通过PlGF受体起到抑制作用,而胎盘CD146只表达在正常妊娠胎盘中间滋养层细胞中,所以我们可以进一步推断,在子痫前期发生时,因中间滋养细胞侵袭不足导致螺旋小动脉障碍,导致胎盘滋养细胞缺血缺氧,引起高阻力低容量的发生,致使PlGF减少,而sFlt-1的含量增多。我们也通过数据验证胎盘CD146与sFlt-1/PlGF具有相关性,r = −0.934,说明sFlt/PlGF越高而胎盘CD146表达越低。而多项研究已证实,sFlt-1/PlGF有希望作为一种有助于分娩前预测PE的一项指标。
由此得知,在子痫前期发展中,如sFlt-1、PlGF、CD146等因子的表达起到了重要的作用,并且两者的比值及胎盘CD146与子痫前期的发展同样有密切的关联,在实验组的血清中,其sFlt-1、sFlt-1/PlGF的结果都要高于对照组,但实验组的PlGF值要比对照组低。在实验组中,胎盘CD146呈不表达或弱表达,而在对照组中,胎盘CD146呈强表达。通过CD146未在实验组患者的中间滋养层表达的现象,说明中间滋养细胞浸润螺旋动脉不全是子痫前期的病理改变,这也导致了子宫胎盘灌注不足 [37]。也为CD146在滋养细胞侵袭和子痫前期发病机制中的作用提供了进一步的证据,综上所述,胎盘CD146和sFlt-1/PlGF与子痫前期具有相关性。
NOTES
*通讯作者。