1. 引言
目前许多免疫疗法都旨在增强NK细胞对造血系统恶性肿瘤的细胞毒性作用 [1]。最先进的技术已经揭示了NK细胞在安全性和靶向非肿瘤效应方面的显著优势,所以NK细胞被认为是CAR修饰T (CAR-T)细胞的替代物 [2],用于治疗血液系统恶性肿瘤和实体瘤。目前存在许多NK细胞的培养方法 [3] [4] [5],最开始的试验中,借助免疫磁珠的方法将血液中所含有的NK细胞(CD3−/CD56+)单独分离出,再使用无血清培养液(其中含自体血浆 + IL-2又或其余细胞因子)进行扩增NK细胞。此种方法扩增的NK细胞其纯度较高,但是因为缺乏其余免疫细胞提供的支撑作用,所以最终NK细胞的扩增倍数并不理想。另外,利用免疫磁珠对NK细胞提纯,花费高,同时需要特殊的设备仪器,使得NK细胞难以在临床中应用 [6]。近期,许多研究利用单个核细胞进行扩增培养NK细胞,同时将K562细胞用作其滋养层。但是K562细胞为白血病细胞的一种,在检测NK细胞的杀伤活性时常用作靶细胞,并且,K562细胞所分泌的微囊能够导致正常的造血细胞发生恶变 [7]。所以,将K562细胞用作滋养层,阻碍其临床使用的最大障碍便是安全问题,特别是长期的安全性不能得到保证。目前研究较多的方法还包括纯细胞因子诱导法,将IL-2,IL-15,IL-12,IL-21,IL-18等细胞因子添加至培养扩增NK细胞的过程之中,但是,该培养方法的稳定性较差 [8],常常由于个体差异导致结果相差甚远,达不到临床试验所要求的标准。所以如何获得高纯度和高活性的大规模临床级NK细胞,成为以NK细胞为基础的肿瘤免疫治疗的最主要障碍 [9]。在此,我们对一种新型的、以往文献中尚未报道的原代NK细胞扩增和培养方法进行了验证,探讨其扩增NK细胞的能力。
2. 材料和方法
2.1. 主要试剂与仪器
自然杀伤细胞诱导培养试剂(其中包括NK细胞无血清培养基、NK细胞激活剂、NK细胞活化剂达科为,深圳),胰蛋白酶(北京,索莱宝),Ficoll分离液(北京,索莱宝)。抗人CD3抗体(美国BioLegend),抗人CD56抗体(美国BioLegend),自体血浆,PE-Annexin V/7AA调亡检测试剂盒(美国BioLegend)。低温高速离心机(Thermo美国),水浴锅(Fisher美国),超净工作台(中国海尔),流式细胞仪(Becton-Dickinson, USA),光学显微镜(Olympus Jpan),细胞培养箱(Thermo Germany)。
2.2. 实验对象
选取济宁医学院附属医院工作的健康志愿者6人,年龄为20~26岁(中位年龄23岁),其中2例男志愿者,4例女志愿者,为入选的每位志愿者进行无菌采外周血20 ml,抗凝管均为肝素钠,进行采血前每位志愿者均签署了《知情同意书》;在外周血采集之后4小时内开始进行试验。每位志愿者的血标本单独处理并获得一次独立的实验结果,此次研究获得本医院伦理委员会的批准(JYHL2018FZD004)。
2.3. 外周血单核细胞的分离
首先使用75%的酒精消毒含有所需实验标本的抗凝管外部,而后将抗凝管转移到经过紫外线消毒30 min的超净操作台内,取50 ml离心管,将10 ml淋巴细胞分离液加至50 ml离心管内,50 ml离心管倾斜约30˚,将外周血贴着管壁慢慢的加入,使外周血能够浮在淋巴细胞分离液的表面,防止加样速度过快,避免血液和淋巴分离液混合。室温下2500 rpm,离心15分钟,离心结束之后,可以清楚的观察到离心管的分至4层:从上到下分别为血浆、白膜层(亦即单个核细胞)、淋巴细饱分离液层以及红细胞层,首先吸取最上层淡黄色透明的血浆于新的15 ml无菌离心管内,封口膜封口,56℃水浴锅内灭活30分钟,1000 g 离心10分钟取上清制得热灭活的自体血浆。随后将白膜层小心的吸取到新的无菌离心管内。在无菌管内加入PBS将细胞洗涤2次,3000 rpm,5 min。
2.4. NK细胞的扩增和培养
将新鲜分离的5 × 106个单个核细胞接种至T25培养瓶中,培养瓶内加入6 mL NK细胞扩增培养基(加入NK细胞活化剂),600 μl热灭活自体血浆(所占比例为培养基体积的10%),同时加入12 μl NK细胞激活剂(每ml培养基2 μl激活剂)。放入培养箱内(条件为37℃,5% CO2)进行培养。
第3天,显微镜下观察细胞状态,若细胞已开始形成克隆团,进行等体积补液(6 ml NK细胞扩增培养基,600 μl热灭活自体血浆)。D5天起,每两天进行1次取样计数,根据细胞的密度(调整NK细胞密度为每ml 1.0~1.5 × 106个)决定补加NK细胞扩增培养基的量,此时血浆浓度可降为5%。D7天之后,所加培养基内的热灭活自体血浆浓度可以降低到1%。14天为1个培养周期。
2.5. 检测NK细胞的纯度
在第0、5、7、11、14天分别收集细胞于1.5 ml EP管内,通过流式细胞数检测CD3、CD56标志物。将收集的细胞进行离心、PBS洗涤后,用100 μl PBS将细胞重悬,注意操作轻柔,随后加入3 μl CD3、CD56抗体,轻轻的吹打使之充分混匀,4℃冰箱内避光孵育30 min。进行孵育抗体时,间隔5分钟震荡离心管,使得细胞和抗体能够充分的接触。30 min后,向EP管内加入200 μl PBS。而后应用流式细胞仪进行检测,收集分析20,000个细胞,扩增NK细胞的纯度等于CD3− CD56+所占总细胞的比例。
2.6. 检测NK细胞的杀伤能力
将培养14天的NK细胞收集作为效应细胞,K562、THP-1细胞作为靶细胞。首先使用荧光染料CFSE对靶细胞进行标记,用1640培养液(10% GIBCO血清)将细胞浓度调整至6 × 105/mL。按照效靶比2:1加入相对应数量的NK细胞;每个孔均设置了相同的3个复孔,放置于37℃,5% CO2培养箱内孵育4小时。4小时结束之后,细胞全部收集,离心、PBS洗涤后,用100 μl Binding Buffer重悬细胞,而后将3 μl Annexin V以及7-AAD加至每管中,室温下避光孵育15分钟,孵育结束之后再向管内加入200 μl Binding Buffer,准备应用流式细胞仪进行检测,同时分析数据。
3. 结果
3.1. NK细胞生长增殖情况
在NK细胞体外培养培养过程中收集细胞,利用流式细胞术进行分析。结果表明,体外培养14天时NK细胞比例可达50.12% ± 6.05%,细胞数量由5 × 106个增至1.0~3.0 × 109个,扩增约300倍,其中第5~11天,NK细胞增长速度最快。并且应用此种方法并不会导致CD3阳性T细胞的扩增,同时细胞保存着良好的生存状态。详见图1~3。
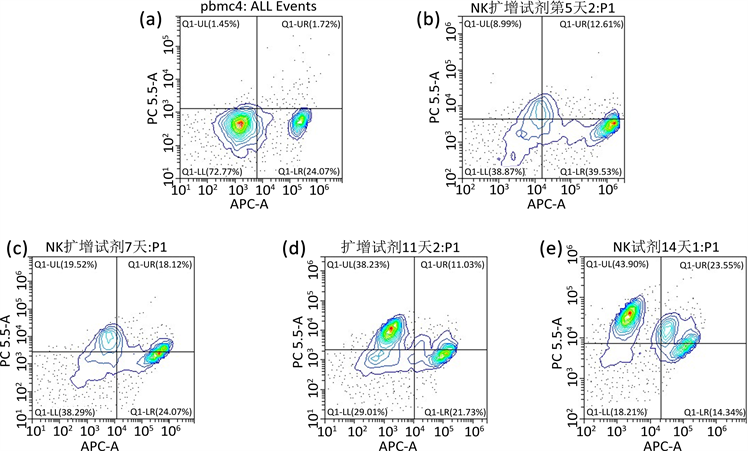
Figure 1. Changes in NK cell proportions
图1. NK细胞比例变化
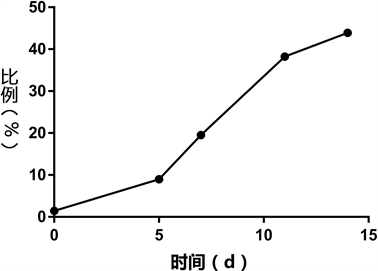
Figure 2. The proportion of NK cells changes
图2. NK细胞比例变化趋势
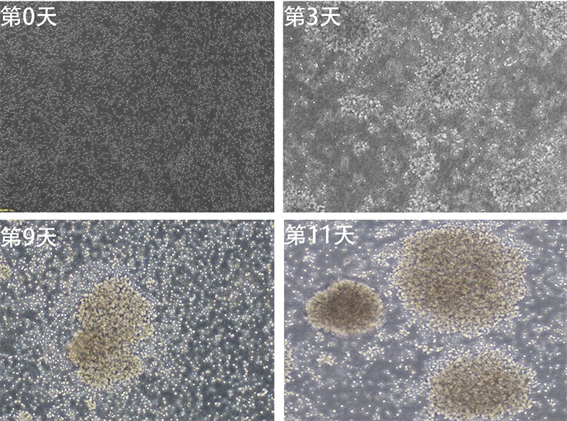
Figure 3. NK cell morphology (light microscopy 10×)
图3. NK细胞形态(光学显微镜10×)
3.2. NK细胞体外杀伤能力的检测
于NK细胞体外培养第14天,检测体外杀伤能力。通过流式细胞仪分析可以得出在效靶比为2:1时,对K562、THP-1细胞株的杀伤效率均超过40%,且对K562细胞的杀伤作用优于THP-1,并且发挥作用迅速,能够在4小时之内发挥杀伤作用。详见图4。

Figure 4. The killing ability of amplified NK cells to target cells
图4. 扩增后的NK细胞对靶细胞的杀伤能力
4. 讨论
本次研究应用的是一种新的、临床级别的细胞培养液,但是以往文献中尚未对该方法进行报道,此方法操作较为简单,并且花费少,只需要将外周血单个核细胞分离出来,调整至适合的细胞浓度后便可直接进行体外扩增,不需要加入有安全隐患的饲养细胞(例如经γ射线辐照之后的K562细胞),同时不需要加入额外的细胞因子,通过14天的培养,细胞总数可以达到约300倍的扩增,NK细胞的纯度可达50%左右。但是该方法因为缺乏其余免疫细胞提供的支撑作用,所以最终NK细胞的扩增倍数低于细胞因子方法以及饲养层细胞方法。此种方法进行NK细胞扩增时需注意以下2个问题:1) 勿将2个或者3个志愿者的外周血所提取的单个核细胞进行混合培养,如此进行不仅会减缓NK细胞扩增的速度,还会影响细胞的状态。2) NK细胞是一种半贴壁半悬浮细胞,团簇状生长,若在培养过程的第3天或者第5天细胞仍未形成克隆团,又或是基本全部为悬浮细胞,那么也意味着此次的扩增可能失败。
在本研究中同时尝试了另外两种扩增NK细胞的方法,包括研究最多的饲养细胞层法,我们构建了含有K562-41-BBL-IL-15细胞饲养层,使用1640培养基(含10% Gibco血清),每两天进行换液并加入200 IU/L的IL-2,最终扩增的NK细胞比例最高也仅为7.00%左右(结果未显示在本文,NK细胞原始比例1.00%左右)。通过查阅文献 [10] 发现来那度胺可以增强NK细胞的活性,由于姜黄素和来那度胺同为免疫调节小分子药物,所以我们便将来那度胺、姜黄素分别加入至分离的单个核细胞培养基内进行刺激,结果相对于来那度胺而言,姜黄素刺激NK细胞的效果更为显著,培养14天NK细胞扩增的比例同样可达7.00%左右(本文未显示该结果,NK细胞原始比例1.00%左右),故姜黄素同样可以促进NK细胞的扩增,但是由于最终扩增数目不多,且纯度不高,未再深入研究。
综上所述,采用NK细胞诱导培养试剂盒扩增NK细胞的方法,虽然最终NK细胞的扩增倍数并不理想,但其操作简单,花费低,安全性高,可靠性强,可以为临床应用提供一种新的扩增方法。
基金项目
山东省自然科学基金(ZR2021MH320)。