1. 引言
目前已知的硼同位素有13种,分别是7B、8B、9B、10B、11B、12B、13B、14B、15B、16B、17B、18B、19B、20B、21B [1] 。其中,只有10B与11B是能在自然界中稳定存在的同位素,其余都是放射性同位素,且半衰期很短,都小于1 s,在自然界中几乎不存在。10B与11B在自然界的相对丰度分别为19.10%~20.31%和79.69%~80.90%,不同地区的含量差异较小 [2] 。
10B性质特殊,在一般的含硼物质中,其慢中子俘获面积为767靶(barn),而10B达到了惊人的3873靶(barn),仅次于113Cd (19500靶(barn))及一些稀土元素的同位素。这一特殊的性能使其成为了核工业中不可或缺的日用品。在核电站上,控制箱内若加入以硼酸为载体的30%~60%的10B,可使反应堆内核反应的速度得到有效控制,使核反应更加稳定、安全地进行,同时加入了10B丰度为92%的碳化硼的控制箱还可以与铬、锂等元素做成的控制棒一起对核反应堆起到保护和应急的作用;在核废料的运输环节,使用含10B丰度90%~97%的吸收材料可以有效吸收废物产生的中子,确保运输过程的安全性。除核电领域外,在军事上,10B可被应用于由核动力驱动的舰船(如核潜艇和核动力航空母舰)的反应堆中。通过冶炼技术在金属材料中融入10B而制成的合金钢,重量轻,能大大减轻舰船的负荷,提高舰船的作战能力。基于反应10B + n → [11B] → Li + 4He在医学上产生了新的癌症治疗法:硼中子俘获疗法(BNCT),此法是目前癌症研究的热点,目前此方法已被临床用于治疗皮肤癌。利用此反应还可以将含硼丰度为90%以上的材料制成中子计数器。10B还对γ射线具有良好的屏蔽阻挡作用,因而可以用来做射线防护材料。在环境科学上,利用10B含量的差异可判断水源受污染的程度,从而得出居民生活用水对水源的影响,还可用于判断不同样品水的来源。在地质科学上,精确测定硼同位素比在地质学中有重要意义。通过比较硼及硼同位素比的变化,可以帮助科研人员推断不同类型的岩石形成的年代及方式、河流的形成等 [3] [4] [5] 。对于11B,其几乎不吸收中子,慢中子俘获面积仅为0.005靶(barn)。在半导体制造行业中,高纯的BF3可以作为硼掺杂剂,也可以作为等离子刻蚀气体用于硅离子布植等方面。但是热中子等高能粒子与集成电路中的10B能发生反应,从而导致集成电路芯片出现故障。所以随着IC产业的发展,不仅对BF3的纯度要求高,还对其中11B的丰度提出了较高的要求。其能够有效提高器件的半导体性能和抗辐射抗干扰能力,减少事故的发生。此外,11B还可用于特种钢材制造行业,用于提高材料的耐高温和耐辐射性能 [6] 。
早在第二次世界大战时期,美国的曼哈顿计划就开始了对硼同位素的分离研究,在1944年就有报道利用化学交换分离法年产300 kg丰度为95%的10B的工业生产装置 [7] 。截止目前,分离硼同位素的方法众多,具体可以分为化学交换分离法、低温精馏、吸附分离法、激光法等。
目前能够高纯硼同位素的生产技术主要掌握在美国等国家,我国尚处于起步发展阶段。随着科技的发展,对于高丰度硼同位素制品的需求也越来越大。摆脱对进口的依赖,实现自主产业化的发展是我国刻不容缓的需求。因此,本文从原理、方法等方面系统性地总结了目前硼同位素分离的研究进展,分析了不同方法的利弊,希望可以对生产实践给出一点的参考、建议。
2. 化学交换分离法
2.1. 原理
化学交换分离法是利用同位素化合物与配合物的结合能力有差异,通过化学交换及精馏过程,使得同位素得以分离的方法。对于硼同位素来说,其分离的机理如下图1所示。
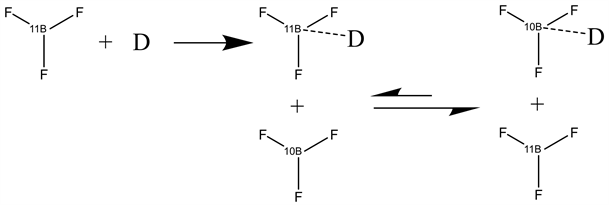
Figure 1. Separation mechanism of boron ısotope by chemical exchange distillation
图1. 硼同位素的化学交换精馏分离机理
从分离机理的反应方程式中可以看出,配体选择的是三氟化硼,其中D为电子给体,是富电子的化合物。在硼的化合物中,三氟化硼缺电子特性更高,更加易于与其他电子给体形成配合物。且三氟化硼稳定性较好,在精馏、加和物裂解过程中不易分解,价格也适中。所以在化学交换精馏法中,配体的选择一般都是三氟化硼。由于11BF3与10BF3与富电子物系的结合能力不同,10BF3要强于11BF3,所以经过化学交换以及精馏过程后,二者可以得到分离,其中10BF3在塔底富集,11BF3在塔顶富集 [8] 。
2.2. 分离因子定义
衡量上述反应的分离情况,一般使用分离因子这一参数来进行比较,在上述体系中,分离因子的定义为:
(1)
分离因子越大则分离的情况越好,在上述体系,中气相与液相的比值一般保持在1:50与1:100之间。在简化计算时,要求气相与液相的比值为1:25,所以可以使用右式进行计算。
2.3. 配体的选择
分离因子是精馏过程的一个非常重要参数,它直接决定塔的高度,并在一定程度上影响化学交换精馏法的分离效果和成本。分离因子的大小主要与BF3和配体之间的相互作用力有关,科学家们对许多配体都进行了研究。目前,研究的配体主要集中在普通醚类、苯甲醚类、酰基类,以及其他常见的电子给体。配合物的分离因子的范围在1.020~1.060之间。在相同的温度下,以配合物的配位点对于三氟化硼配位能力的不同(考虑电子效应以及空间效应),取苯甲醚类 [9] [10] [11] 配合物按照从大到小排序作图可以得到配位能力大小与分离因子的关系图,如下图2所示。
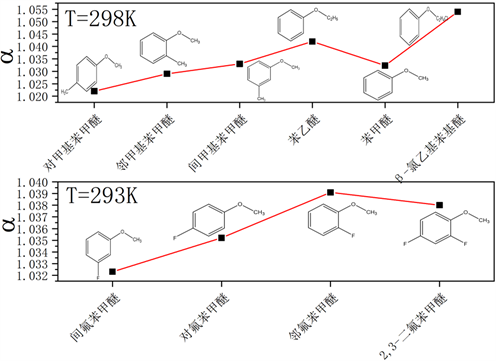
Figure 2. Relationship between coordination ability and separation factor
图2. 配位能力大小与分离因子的关系
由图2可看出,在一定范围内,配体的配位点能力越弱,反而分离因子更大。但是随着配位能力的变小,分离因子开始下降,不再单纯地呈现出单纯的趋势性变化。因此,可以看出,配位能力的强弱要控制在一定的范围内,过低则选择性较差,无法达到良好的分离效果。过高则配合物过于稳定,难以裂解,造成分离效果较低。这也是配合物的分离因子在一个小范围区间的原因。
在配体的选择上,不单单要考虑分离因子的影响,此外还要考虑毒性、腐蚀性、经济性、塔操作条件等多种因素。在这些综合条件的影响下,目前苯甲醚作为最为合适的配体被应用于工业化当中。
2.4. 化学交换精馏法的工业化历程
化学交换精馏法经历了三氟化硼–乙醚、三氟化硼–甲醚、三幅化硼–苯甲醚三个阶段。
在最早的分离实验中,科学家使用的是三氟化硼–乙醚体系该法与1957年在英国中试 [12] 成功,但存在的问题较多。首先,三氟化硼–乙醚配合物会在近沸点时分解,为了减少这一分解,整个装置在真空状态下进行,这就导致了装置的复杂程度提高,运行成本大幅增加。其次,由于塔顶流出物中三氟化硼–乙醚配合物部分分解,以及不能作为原料液回流重复利用或进入下一塔进行下一步分离,这就导致了原料液利用的大幅下降。最后,由于真空的影响外界空气容易进入塔内,空气中的水在此条件下会与三氟化硼生成氢氟酸等物质腐蚀塔器,对设备维护造成较大影响,同时影响了产物的纯度。此方法问题较多,不久后便被弃用。
之后,科学家们发现三氟化硼–甲醚体系更优于三氟化硼–乙醚体系。在这个体系下,配合物的分解率比三氟化硼–乙醚体系低20倍,真空度可以放宽近20倍,单位时间内的产率能提高100倍。这个体系虽然减少了三氟化硼–乙醚体系的缺点,但操作条件仍然很苛刻,所以也不是工业化生成的最佳选择。
目前,最为广泛使用的工业化生成硼同位素的体系是三幅化硼–苯甲醚体系 [13] 。此体系的分离可在常温常压下进行,操作条件较好,生产效率很高,非常适合大规模的工业化生产。在这方面,我国的天津大学对此进行了大量的研究。
谭国峰 [14] 对三幅化硼–苯甲醚体系进行了初步的数学建模,通过热力学计算方法得出了分离因子级平衡常数与温度的关系式:
(2)
并初步建立了分离塔的数学模型,得出采用较低温度以及较大的回流比可以有效提高产品纯度、减少塔板数,降低塔高。
王辉 [15] 建立了基础的中试装置,给后续研究带来一定的参考。庞宝琳 [16] 对苯甲醚的除杂进行了模拟研究,通过模型可以得出当原料组成为98%,塔顶苯甲醚产品的平均浓度苯甲醚≥ 99.80%时,适宜的理论板数为13块,回流比为1.5,所得到苯甲醚产品的单程收率为92.04%。史志强 [17] 对分离塔器的填料进行了研究,发现发泡镍规整填料比一般的与CDGl700X规整填料比较,其更适合硼同位素的工业化实验。张鸾 [18] 研究了3A及4A及分子筛对苯甲醚微量水的吸附行为,得出经3A分子筛吸附后的苯甲醚的含水量在10~25 ppm之间,经4A分子筛吸附后的苯甲醚的含水量在13~26 ppm之间,并得出Yoon-Nelson模型和Thomas模型可以为工业放大提供理论依据。何娜娜 [19] 对交换反应中的副反应进行了研究,发现160℃是苯甲醚为络合剂时最优裂解温度。可以使用氮气辅助裂解、抽真空裂解以及温度梯度法对裂解反应进行优化。氮气可以将裂解温度降到110℃,并降低副产物含量,是一种潜在的辅助裂解剂,抽真空可以减少裂解时间、减低裂解温度,采用温度梯度法,可以减少苯甲醚与高温解除的时间,提升苯甲醚含量。周娇娇 [20] 对苯甲醚–三氟化硼反应的过程进行了研究,得出了反应器内侧传热系数关联式:
(3)
并发现反应温度随苯甲醚向下流动先升高后下降,逐渐接近冷媒温度。反应转化率的增速导热系数增加而增加,最后接近极限转化率、反应器的温度最高值以及平衡塔高和苯甲醚流量、入口温度、冷媒温度呈正比关系,与冷媒流速呈反比关系。苯甲醚的极限转化率只和冷媒温度有关。唐银 [21] 设计了一套基于红外光谱法的在线同位素比测定装置,并安装在化学交换精馏法分离硼同位素的装置中。对同位素比进行在线测定,对同位素分离的生产进行指导且总结出苯甲醚–三幅化硼特定温度下密度与络合度之间的关系并推导出相应的拟合公式,利用在线密度计对反应进行实时监测。
3. 低温精馏法
3.1. 原理
低温精馏法是利用不同物质饱和蒸气压的差异来进行物质分离的一种方法,与精馏过程一样,只是操作温度在低温下进行,所以又称为低温精馏法。
对于硼同位素分离来说,低温精馏法相对于化学交换精馏法来说,有着没有副反应、步骤简单、仅需要控制温度和压力就能控制精馏过程、产物杂质少、纯度高、分离装置更加简便等优点。
3.2. 分离因子的定义
衡量低温精馏法的物质之间的分离程度,一般用分离因子来进行,其计算公式为:
(4)
此外,还用富集因子来进行表示:
(5)
3.3. 分离物质的选择
对于硼的同位素低温精馏,人们研究了许多化合物的精馏,例如硼烷,然而由于他们的不稳定性与较低的分离因子(如BO3(CH3)2 α ≈ 1.001),实验分离没有成功。在众多化合物中,仅有硼的三卤化物脱颖而出。由于硼的三卤化物的分离因子以及稳定性随着卤化物原子序数的增加而减少,且溴化物与碘化物价格较贵,所以只有BF3与BCl3有实际的应用。
在初步确定了分离物质后,研究人员就对BF3和BCl3分别进行了小型分离实验,研究发现,BF3分离因子在塔中为1.0076,BCl3分离因子在塔中为1.0032。BCl3在进行分离实验时,分离塔在分离700 h后,10B的浓度仅富集5倍 [22] ,而BF3分离塔在480小时后10B的浓度可以达到95%~96%。总的优缺点比较如下表1所示。

Table 1. Comparison of low-temperature distillation of boron trifluoride and boron trichloride
表1. 三氟化硼与三氯化硼低温精馏对比
尽管BCl3能够在常温下进行分离,但其分离因子太小、平衡时间太长,导致获得高纯度硼同位素较为困难,所以目前进行低温精馏实验都是用BF3进行。其中,前苏联在1955年便完成了对于低温精馏分离硼同位素的大规模实验,获得了丰度较高的产品,由于相关的技术数据均处于保密状态,具体的实验过程以及实验数据未知。
3.4. 分离因子的测量
对于低温精馏来说,分离因子直接决定了精馏塔的重要参数如:塔板数、塔高、回流比等,是精馏塔设计的重要参数,所以分离因子的测量十分重要。
对于BF3的低温精馏过程,Sevryugova等人 [23] 对其分离因子进行了测定,由差压法可以得到的实验结果如下表2所示。

Table 2. Separation factor data of boron trifluoride by low-temperature distillation
表2. 三氟化硼低温精馏分离因子数据
通过对上述数据的拟合可以得到其分离因子α与温度T的图像如下图3所示。
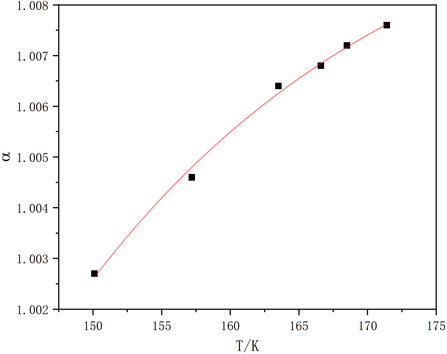
Figure 3. Relationship between separation factor and temperature
图3. 分离因子与温度的关系
对数据进行拟合可以得到:
(6)
由于分离过程的分离因子很小,轻微的温度扰动或压力变化都会对其测定的准确性造成影响。测定富集因子可以更容易克服这些影响,减少实验的误差。为了获得更加准确且范围更高的数据,Amirkhanova等人 [24] 又对分离过程的富集因子进行了测定,测试得到的结果如下:
(7)
(8)
为了实现工业化的生产,Sevryugova等人 [22] 还设计了一个级联玻璃柱系统。该柱用1.6 × 1.6 mm的迪克森填料填充该生产装置是每根高度17.4米的两柱的级联。为了确保绝热过程,该柱被放置在两个不同的真空容器中。这样分别放置可以防止容器之间的相互影响,保证每根柱子的独立性。在直径为56 mm的第一柱加入富含50%的B-10的产品,在冷凝器顶部,B-10的含量降低至9%。在直径为44 mm的第二柱中,容器中B-10的含量被富集到95%。整个装置通过液氮冷凝。第一柱上部的压力自动保持在850 mmHg,回流率为14.5 kg/小时。该仪器生产可生产26公斤/年的基本硼。
4. 吸附分离法
4.1. 原理
吸附分离法是利用吸附剂对两种硼同位素化合物的吸附程度不同从而达到对某一同位素的选择性吸附而达到同位素分离效果的方法。化学交换分离虽然已经应用了很多年了,但是由于其能耗高、污染大、可循环性差、设备损耗严重等缺点,促使人们一直在寻找新的可替代方法。而吸附法的分离因子高、操作条件简单、能耗更低,它一般采用廉价易得且更为环保的硼酸作为原料,具有良好的发前景。根据吸附剂和操作方法的不同可以将吸附分离法分为离子交换色谱法、无机法、金属有机骨架(MOFs)法。根据离子交换剂不同,通常又把离子交换色谱分为:强碱性阴离子交换树脂、弱碱性阴离子交换树脂、硼特异性离子交换树脂。
在几种方法中,只有离子交换色谱法有一定规模的分离装置,而剩余的方法均只处于实验室研究阶段,尚未有搭建分离装置的能力。对于离子交换色谱法来说,一般的分离过程为:
将离子吸附剂放入柱中,硼酸连续的通入分离柱的顶部,在树脂被硼酸溶液饱和后,通过充分的硼酸溶液洗涤后能形成一条浓度梯度分布的硼酸溶液带。随着带的发展,较轻的同位素10B在后带中富集,较重的同位素11B在前带富集。一旦带后的10B同位素摩尔分数达到要求的值,就可以开始收集10B同位素,收集完成后将柱子上的10B洗脱,即可完成同位素的分离。
不同的分离方法的分离机理不同,目前仅有离子色谱法的分离机理较为确定 [25] ,对于使用硼酸溶液的离子色谱法分离法来说,同位素的分离是在B(OH)3和
之间进行的,研究表明,11B更容易以平面三角形的形式存在,即富集在B(OH)3中,而10B更容易以四面体形式存在,即富集在
中,分离过程可用如下方程式表示:
(9)
同位素分离的平衡常数为:
(10)
反应的KB一般在1.026~1.033之间,平衡常数大于1,这也验证了11B更容易以平面三角形形式存在,10B更容易以四面体形式存在。
对于MOFs法来说,有学者猜测其机理和离子色谱法相同 [25] ,硼酸根离子主要存在于MOF相中,硼酸分子主要存在于液相中。无机法的分离机理与其物质相关,不同物质的分离机理不同,目前各物质的分离机理尚不清楚。
4.2. 分离因子定义
为了更好地展现分离的效果,通常使用单级同位素分离因子来代表吸附剂中的分离效率。其定义为:
(11)
4.3. 吸附剂分离性能研究
目前,学者对大量的吸附剂进行了研究,测定了许多吸附剂的分离因子,具体的总结如下表3所示 [26] - [38] 。
从表3可以看出,对于离子交换色谱法来说,弱碱性阴离子树脂的分离因子最低,大多数的分离因子在1.01左右,强碱性阴离子交换树脂次之最高可达1.027,硼特异性离子树脂最高,最高达到了1.140。但是一般分离因子越大则越难洗脱。对于这三种树脂来说硼特异性离子树脂最难洗脱,强碱性阴离子交换树脂次之,弱碱性阴离子交换树脂最好洗脱,利用纯水就可以完成操作。洗脱率低就难以完成分离操作,这也是为什么大多数分离小型实验都是使用弱碱性阴离子交换树脂的重要原因之一。此外,这些树脂都有着比表面积小、稳定性差、再生困难等问题。这些都限制了离子交换法进行工业化生产的可能,目前进行的实验大多数都在实验室规模。寻找更加稳定、选择性更好、更加经济性、操作更加简便的树脂是目前研究新型离子交换树脂的重点。
MOFs法相对于其他分离方法分离因子十分的高,但是由于其洗脱难度非常大,使用浓盐酸、硝酸等都不能使硼被洗脱,且材料不能再生,这极大地限制了其在工业上的应用。但MOFs法有着极高的分离因子,可以将其应用与最后高纯同位素的富集,获得电子级需求的同位素制品。

Table 3. Separation factor data for different adsorbents
表3. 不同吸附剂分离因子数据
对于无机吸附法来说,Fe3O4磁性纳米粒子是目前研究的热点,其分离因子很高,且制备简单、易于回收、成本较低,是一种具有较大潜力的无机吸附剂,但他的缺点在于制备产物的粒径太小,导致填充柱时压力过大,对设备要求较高。目前的研究点在于制备更大的毫米级别的Fe3O4磁性例子以及与其他色谱柱进行连用,获得分离能力更强的磁性离子交换树脂。Wang等人 [39] 将四氧化三铁磁性纳米粒子负载至大孔强酸性阳离子交换树脂(D001)表面制备毫米级的四氧化三铁负载树脂复合材料(Fe3O4@Resin),分离因子达到1.312,可以获得10B丰度为23.32%的产品。
5. 激光分离法
5.1. 原理
激光分离法是利用同位素质量所引起的能量差,这个能量差可以导致某元素的同位素原子或由其组成的分子在吸收光谱上具有微小差异,这样就可应用线宽及窄的激光有选择地将某一种同位素原子或分子激发到一个特定的激发态,再采用物理或化学的方法将激发的同位素原子或分子与未被激发的其他同位素原子或分子分开。激光分离法按照处理目标的不同可以分为两类分别是原子蒸汽激光同位素分离法(AVLIS)和分子激光同位素分离法(MLIS)。对于分离硼同位素来说主要使用分子激光同位素分离法。
5.2. 富集因子定义
衡量激光分离法的分离程度一般用富集因子表示,其计算公式为 [40] :
(12)
式中,N为产品中稀有同位素的含量,n为进料中稀有同位素的含量,由于10B在自然界含量较少,在硼同位素的富集中,一般将10B看作稀有同位素。
5.3. 激光分离法分离硼同位素研究
分子激光同位素分离一般使用CO2作为光源,光电转化效率很高,分离的对象一般为气体,无需高温加热,多适用于轻同位素的分离。对于硼同位素来说,研究人员针对不同光源、激发谱线、分离物质等进行了研究,具体可以总结为下表4所示 [41] - [49] 。

Table 4. Summary of laser separation
表4. 激光分离法总结
由上表可以看出,研究多集中于使用CO2激光及BCl3通过调整谱线对富集因子进行测定。上述体系富集因子都很大,最大的情况下,达到了8。这表明,使用激光分离法能够很大程度上对同位素进行富集。但是激光分离法存在的一个重大缺陷就是最后一步的分离反应多为可逆反应,这会导致分离效率的大幅下降,单位时间内获得的硼同位素很少,这大大地限制了其工业化的应用。但是由于激光分离法的富集因子大,得到的产物纯度很高,其他方法难以达到激光分离法的纯度,所以这一方向仍然有很大的吸引力。
Lyakhov等人 [50] 就希望通过控制激光分离法的过程来达到激光分离法分离硼同位素的效果,为此他们引入了激光辅助延迟凝聚法(SILARC)。激光辅助延迟凝聚法通过利用激光的能量和方向性,控制和促进中间体中微观结构的形成和演化,从而实现对中间体结构和性质的调控。Lyakhov通过制造激光照射电池作为谐振器来节省昂贵的激光光子,通过选择适当的气体流量膨胀条件,以及目标气体的浓度、载体气体的选择、气体流动和环境气体的压力和温度选择可以增加气体的分离率。结果发现,即使在最优条件下,同位素分离率也相当小。但是这种方法仍然有吸引力,因为每个分离同位素的能量仍然明显小于其他激光分离的方法。Lyakhov等人的研究给未来激光分离硼同位素做了一个很好的铺垫。
6. 总结
通过上述介绍,按照工业化的可行程度从小到大排序可以做出下图4。
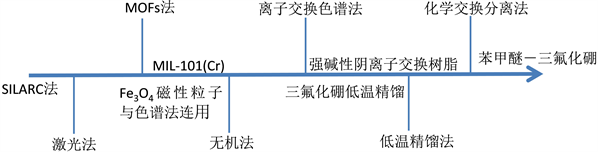
Figure 4. Feasibility ranking of boron isotope separation industrialization
图4. 硼同位素分离工业化可行性排序
目前,在工业化的可行性上,只有化学交换分离法以及低温精馏法有较大的可行性,其他方法虽然有着较大的分离因子,但存在着较为明显的缺点,以至于工业化十分困难,各方法的优缺点总结如下表5所示。

Table 5. Summary of various methods for boron isotope separation
表5. 硼同位素分离各方法总结
总的来说,对于能够工业化的方法,需要继续对过程、设备、操作条件等继续进行优化以提高生产效率,达到高效生产的目的。对于难以工业化的方法,需要寻找新的稳定物质,提高反应的效率,增加反应的利用率,从而达到工业化的条件。