1. 引言
近年来,重金属浓度大幅增加,主要来源于集约化农业、采矿活动和工业废水排放,造成严重的环境污染 [1] 。目前主要采用化学沉淀法 [2] 、离子交换法 [3] 和吸附法 [4] [5] [6] 等处理重金属废水。其中吸附法具有灵活、操作简单且经济等优点,得到了广泛关注。但现有吸附材料存在处理效率低、吸附平衡时间长、共存离子影响大等缺点,因此需要开发低成本、高效稳定、快速处理的吸附剂。
中空结构的微/纳米材料具有大表面积、低密度、高负载能力和高效的光收集能力等特性,在重金属离子吸附领域具有潜力。目前,不同形貌的CeVO4纳米材料在锂电池存储、电化学储氢和催化剂领域都已得到相应的研究,但在吸附领域的研究还不多,故本论文欲探究其在吸附领域的应用效果。从吸附角度来看,由纳米级单元组装的空心结构具有较大的比表面积和更多的活性位点,有利于反应物与CeVO4表面更好的接触和污染物迁移,因此,合成形貌可控的CeVO4空心微球具有重要的研究价值。
氨基酸可以控制和改变产物的形貌,是一种优良的结构导向剂,氨基酸辅助法已被用于制备多种纳米材料 [7] [8] [9] [10] 。氨基酸辅助法在合成不同形貌的无机纳米材料方面已经得到了许多应用。然而,使用氨基酸辅助法合成空心微球的研究却不多。本论文将采用溶剂热法,以L-Asp为结构导向剂,通过改变实验变量,选择性地合成CeVO4空心球,并研究其对重金属铅离子的吸附性能。
2. 实验部分
2.1. 试剂与仪器
Ce(NO3)3∙6H2O、L-Asp和丙三醇均为分析纯。
2.2. 样品表征
物相分析采用X射线衍射仪(Bruker D8 ADVANCE),Cu Kα为辐射源(=1.54178 Å);采用场发射扫描电镜(Hitachi S-4800)和透射电镜(JEOL-2100F)检测样品的微观形貌和尺寸;通过ASAP-2020C测量样品的比表面积。
2.3. 样品制备
量取1 mmol Ce(NO3)3∙6H2O和1.0 mmol L-Asp分散在6 mL丙三醇和18 mL蒸馏水中,并在室温下搅拌溶液30 min,再加入1 mmol NH4VO3,搅拌直至全部溶解。将溶液转移至内有聚四氟乙烯衬套的水热釜中,150℃干燥箱中加热12 h。通过离心10 min (5000 r∙min−1转速)收集和分离产物,并用蒸馏水和无水乙醇各洗涤3次,将所得样品在70℃干燥3 h。
3. 结果与讨论
3.1. 物相分析和N2吸附–脱附等温线表征
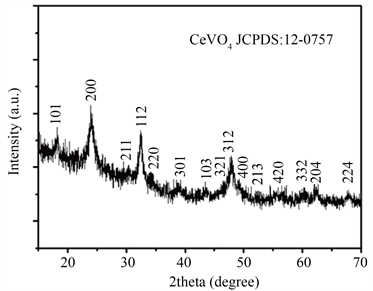
图1(a)为在6 mL丙三醇和18 mL水混合溶液中150℃加热12 h制得的CeVO4的XRD图。图中所有的衍射峰均与四方晶系的CeVO4 (JCPDS:12-0757)相匹配。在实验的误差范围内,没有明显的杂峰存在。图1(b)为CeVO4空心微球的N2吸附-脱附等温线,属于H3型滞回线的IV曲线,说明产物具有空心结构。当溶剂为6 mL丙三醇和18 mL水的混合溶液时,加入1 mmol L-Asp,反应温度为150℃,反应时间为12 h时,通过计算得出制得的由纳米棒组装而成的具有空心结构的CeVO4微米球的BET (多分子层吸附模型)比表面积达到57.16 m2/g,比表面积大,能够在反应中提供更多的吸附活性位点,所以说CeVO4有望成为一种理想的吸附剂。
 (a)
(a)  (b)
(b)
Figure 1. (a) The XRD patterns and (b) N2 adsorption-desorption isotherms of the CeVO4 hollow microspheres
图1. (a) CeVO4空心微球的图和(b) N2吸附–脱附等温线
3.2. SEM和TEM表征
图2为在6 mL丙三醇和18 mL水混合溶液中150℃加热12 h制得的CeVO4的SEM图2(a)~(c)和TEM图2(d),图2(e)。如2a低倍SEM图,发现有许多表面粗糙的微球,平均直径大约为2.5 μm。如图2(b)高倍SEM图,看出CeVO4微球为球壳厚度约为500~600 nm的空心结构。如图2(c)高倍SEM图,晶体表面为平均长度为30~40 nm的纳米棒。TEM图像(如图2(d),图2(e))再次证明制备出的CeVO4样品是由纳米棒自组装而成的空心微球。L-Asp在CeVO4空心微球的形态的形成中起着关键作用。鉴于L-Asp中存在丰富的羧基和氨基,羧基和氨基之间的强相互作用(即氢键配位和静电作用)可能是其自组装结构形成的主要动力。
3.3. CeVO4空心微球对铅离子吸附性质研究
随时间变化的t时刻的吸附量qt (mg/g)和平衡时CeVO4空心微球对Pb2+吸附量qe (mg/g)按公式式(1)和(2)计算:


Figure 2. The SEM (a)~(c) and TEM (d)~(e) images of as-obtained CeVO4 hollow microspheres
图2. CeVO4空心微米球的SEM图(a)~(c)和TEM图(d)~(e)
(1)
(2)
CeVO4空心微球对Pb2+去除率根据公式(3)计算:
(3)
C0和Ce (mg/ L)分别对应初始时间t0和平衡时间t时水溶液中的Pb2+浓度。V (L)和m (g)分别表示Pb2+溶液的体积和CeVO4的质量。
Langmuir等温方程见公式(4):
(4)
qe为平衡时吸附Pb2+的量(mg/g),Ce为平衡时Pb2+溶液浓度(mg),b为Langmuir常数(L/mg),qm (mg/g)为最大吸附容量。
准二级方程为公式(5):
(5)
qe和qt (mg/ g)分别表示平衡时刻和t时刻吸附量,K2为准二级方程的速率常数。
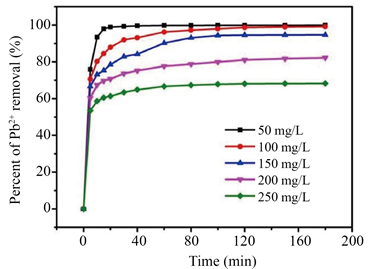
如图3(a),50 mg/L Pb2+溶液在15 min内完全去除,其它浓度溶液在100 min后达到平衡,Pb2+的去除率随着Pb2+浓度增加从99.91%下降到68.21%。如图3(b),当初始Pb2+浓度从50 mg/L增加到250 mg/L时,吸附量从99.93 mg/g增加到341.2 mg/g。可见随着Pb2+初始浓度的升高,去除率逐渐降低,吸附量增加,最终趋于稳定。如图3(c),Langmuir拟合的相关系数为0.9995,Pb2+的吸附过程符合Langmuir模型,为单分子层吸附且吸附均匀,理论最大吸附量qm为343.6 mg/g,与实际测量的吸附量相差不大。
 (a)
(a) 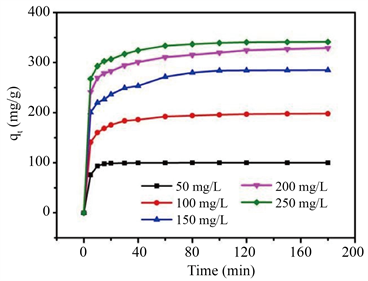 (b)
(b)  (c)
(c)
Figure 3. (a) The removal rate; (b) Adsorption capacity of nanorods-assembled CeVO4 hollow microspheres towards Pb2+; (c) Langmuir isothermal adsorption curve
图3. 由纳米棒组装成的CeVO4空心微球对(a) Pb2+的去除率;(b) Pb2+的吸附容量随时间变化曲线;(c) Langmuir等温吸附曲线

Table 1. Relevant parameters of the quasi-secondary kinetic model
表1. 准二级动力学模型的相关参数
表1数据表明,准二级的R2都接近1,计算的qe值与实验数据吻合较好,Pb2+的吸附过程符合准二级动力学模型。由纳米棒组装成的CeVO4空心微球对Pb2+的吸附是化学吸附。

Figure 4. XRD comparison of the products before and after adsorption
图4. 吸附前后产物的XRD对比图
通过对由纳米棒组装成的CeVO4空心微球吸附前后的XRD进行对比(如图4),发现吸附Pb2+之后样品由CeVO4转变为CeVO4和Pb2V2O7,测出了Pb2V2O7的特征衍射峰,Pb2V2O7的生成说明Pb(NO3)2和CeVO4发生了化学反应,再次证明该吸附属于化学吸附。
4. 结论
以L-Asp为结构导向剂,通过溶剂热法制备了纳米棒自组装而成的空心微球的CeVO4,并详细研究了对产物对Pb2+的吸附性能。经拟合发现纳米棒组成的CeVO4空心微球对Pb2+的吸附过程符合二级动力学模型和Langmuir模型,对Pb2+的最大吸附量可达343.6 mg/L。这一工作为今后可控合成CeVO4空心微球及其应用提供了新的实验依据。
基金项目
感谢国家自然科学基金(22075152)和江苏省大学生创新训练项目(202210304023Z, 202210304099Y)的支持。
NOTES
*通讯作者。